Фосфоліпіди в ліпопротеїнах: відмінності у складі між ЛПНЩ, ЛПНЩ та ЛПВЩ у вагітних
Анотація
Об’єктивна
Метою цього дослідження було проаналізувати відмінності у складі фосфоліпідів моношарів дуже низької щільності (ЛПНЩ), низької щільності (ЛПНЩ) та ліпопротеїнів високої щільності (ЛПВЩ) у вагітних худорлявих та ожирілих жінок.
Методи
ЛПНЩ, ЛПВЩ і ЛПНЩ були виділені із зразків плазми 10 худих і 10 вагітних жінок із ожирінням, а їх видовий склад фосфатидилхолінів (ПК) та сфінгомієлінів (СМ) аналізували методом рідинно-хроматографічної тандемної мас-спектрометрії. Тест Уілкоксона-Манна-Уітні та аналіз основних компонентів (PCA) використовувались для дослідження того, чи відрізняються метаболітні профілі між худими/ожирілими групами та між видами ліпопротеїнів.
Результати
Істотних відмінностей у рівнях метаболітів у вагітних із ожирінням та без ожиріння не виявлено. Компоненти PCA 1 і 2 розділялися між ЛПНЩ, ЛПВЩ та ЛПНЩ, але не між нормальною вагою та жінками з ожирінням. Дванадцять SM та одна РПЖ мали більшу кількість ЛПНЩ, ніж ЛПНЩ. На відміну від них, чотири ацил-алкіл-ПК та два діацил-ПК були значно вищими в ЛПВЩ порівняно з ЛПНЩ. ЛПНЩ і ЛПВЩ відрізнялись у трьох СМ, семи ацил-алкіл-ПК та одному діацил-ПК (вищі значення у ЛПВЩ) та 13 СМ (вищі у ЛПОНЩ). Ми також виявили асоціації деяких видів фосфоліпідів з холестерином ЛПВЩ та ЛПНЩ.
Висновок
У вагітних жінок склад фосфоліпідів суттєво відрізняється по ЛПВЩ, ЛПНЩ та ЛПНЩ, як і попередні результати у чоловіків та невагітних жінок. Вагітні жінки з ожирінням та худорлявістю не виявили значних відмінностей у своєму профільному метаболітному профілі, пов’язаному з ліпопротеїнами.
Вступ
Ожиріння та супутні захворювання є основною проблемою охорони здоров’я [1]. Було показано, що вагітність і раннє життя вже можуть встановити шлях до несприятливого метаболічного стану, як при ожирінні. У зв’язку з цим ожиріння матері під час гестації є фактором ризику ожиріння потомства в подальшому житті [2]. У механічному відношенні ліпопротеїни є одним з основних джерел живлення плоду, оскільки вони містять триацилгліцерини (ТГ). Ожиріння пов'язане з порушеним профілем ліпопротеїнів [3]. Отже, більш високі рівні ліпопротеїнів та змінена структура моношару фосфоліпідів є важливим об'єктом дослідження, оскільки модифікації можуть мати наслідки для енергозабезпечення плода та раннього програмування пізніших несприятливих наслідків для здоров'я через надмірне або недостатнє споживання енергії.
У стані голодування функція ліпопротеїдів дуже низької щільності (ЛПНЩ) полягає у транспортуванні жирних кислот у формі ТГ з печінки до позапечінкових тканин, а під час вагітності - до плода для енергетичного обміну та підтримання структури [4]. Частинки ЛПНЩ перетворюються на ліпопротеїди низької щільності (ЛПНЩ), які містять менше ТГ і більше холестерину, ніж ЛПНЩ. Холестерин ЛПНЩ може поглинатися тканинами, опосередкованими рецепторами ЛПНЩ, або на високому рівні депонуватися в клітинах-поглиначах в інтимі-середовищах судин, що сприяє ризику серцево-судинних захворювань [5]. Навпаки, ЛПВЩ запам'ятовує холестерин із позапечінкових тканин і транспортує його назад до печінки для виведення з жовчю, сприяючи зменшенню серцево-судинного ризику [6].
Загальні жирні кислоти в плазмі сильно пов'язані з метаболізмом ліпопротеїнів, а різні особливості ліпопротеїнів, такі як холестерин та вміст насичених видів, пов'язані зі здоров'ям серцево-судинної системи [7,8,9]. Незважаючи на існуючі докази важливості складу ліпопротеїнових жирних кислот для метаболізму та функціональності деяких з цих частинок [10], відмінності в молекулярних видах, виявлені в різних ліпопротеїнах, навряд чи вивчені.
Поверхня всіх ліпопротеїдів складається з фосфоліпідів, переважно фосфатидилхоліну (ПК) та сфінгомієліну (СМ) [11]. Ці дві групи фосфоліпідів позитивно асоціювались із вищим ІМТ у клінічних цілеспрямованих дослідженнях метаболоміки [12,13,14,15]. Більшість сучасних досліджень метаболоміки використовують цілу плазму для аналізу жирних кислот та фосфоліпідів крові [16], і зазвичай різні ліпопротеїни не аналізуються далі перед аналізом. Таким чином, відмінності складу ліпопротеїнів не враховуються.
Різниця у складі фосфоліпідів ліпопротеїнів раніше була показана у чоловіків та невагітних жінок [17].
Ми прагнули охарактеризувати фосфоліпідний склад ЛПНЩ, ЛПВЩ та ЛПНЩ у ожирілих та худорлявих вагітних, який, крім видів ліпопротеїнів під час вагітності в цілому [18], досі не був детально описаний. Циркулюючі ліпіди значно змінюються під час вагітності, і рівень ліпідів пов'язаний з антропометрією потомства [19]. Висока плацентарна експресія ендотеліальної ліпази (EL), яка переважно розщеплює фосфоліпіди, свідчить про участь фосфоліпідів у плацентарному переносі жирних кислот [20]. Таким чином, порівняння фосфоліпідів між ліпопротеїнами у вагітних може поліпшити розуміння ліпідного обміну під час вагітності та підтримує планування подальших досліджень метаболоміки щодо включення ліпопротеїнових аналізів.
Матеріали і методи
Предмети
Двадцять вагітних жінок були досліджені під час пологів (між 37 і 41 тижнем вагітності) в акушерсько-гінекологічній службі клінічної лікарні Вірген де ла Арріксака, Мурсія (Іспанія), у тому числі 10 жінок із ожирінням (ІМТ до вагітності> 30 кг/м 2) та 10 жінок із нормальною вагою (ІМТ до вагітності 20-25 кг/м 2). Усі жінки задовольняли наступним критеріям включення: одноплідна вагітність, термін пологів, вік 18–40 років, всеїдна дієта, не вживання добавок ДГК протягом останнього триместру, некуріння, нормальне допплерографічне дослідження плоду та проведення планового кесаревого розтину. Суб'єкти, які повідомляли про проблеми зі здоров'ям або ускладнення вагітності, були виключені. Письмова інформована згода була отримана від усіх суб’єктів. Це дослідження було схвалено Комітетом з питань етики лікарні.
Відбір проб
На момент пологів зразки крові у матерів, що постили, відбирали за допомогою пробірок, що містять ЕДТА. Зразки центрифугували протягом 3 хв при 1200 г для отримання плазми.
Біохімічні аналізи
Інсулін аналізували за допомогою хемілюмінесценції (DIAsource INSIRMA, Nivelles, Бельгія), а глюкозу, загальний холестерин, TG, холестерин LDL та холестерин HDL визначали кількісно за допомогою автоматичного аналізатора (Roche-Hitachi Modular PyD Autoanalyzer, Мангейм, Німеччина).
Виділення ліпопротеїдів
Ліпопротеїни материнської плазми виділяли з 1,5 мл свіжої плазми шляхом ультрацентрифугування з використанням розривного градієнта щільності NaCl/KBr [21] в ультрацентрифузі Optima L-100 XP, оснащеному ротором 100Ti (Бекман Коултер, Каліфорнія, США). Решту плазми заморожували в рідкому азоті і зберігали при - 80 ° C до аналізу.
Вимірювання метаболоміки фосфоліпідів
Аналіз метаболоміки проводили у Відділі метаболічної та харчової медицини дитячої лікарні доктора фон Хаунера в Мюнхені, Німеччина, за допомогою рідинної хроматографії в поєднанні з тандемною мас-спектрометрією (LC-MS/MS), як описано раніше [12].
Аналіз полярних ліпідів включав діацил-фосфатидилхоліни (PCaa), ацил-алкіл-фосфатидилхоліни (PCae) та SM. Аналітична методика не здатна визначити положення подвійних зв’язків та розподіл атомів вуглецю між бічними ланцюгами жирних кислот. Види ліпідів описуються за допомогою номенклатури CX: Y, де X - довжина вуглецевого ланцюга (C), Y - кількість подвійних зв'язків. "А" означає, що ацильний ланцюг пов'язаний ефірним зв'язком з основою, а "е" означає ефірний зв'язок.
Для всіх аналізів метаболоміки, збір даних на мас-спектрометрі, обробку даних та кількісну оцінку проводили за допомогою програмного забезпечення Analyst 1.6.2 (AB Sciex, Дармштадт, Німеччина).
Контроль якості
Контроль якості (QC) результатів проводили, використовуючи шість зразків QC на партію. Загалом було виміряно дві партії з десятьма зразками для кожного виду ліпопротеїну та плазми.
Контроль якості базувався на між- та внутрішньосерійному дисперсійному коефіцієнті (CV). Для внутрішньосертивної CV ми використовували 20%, а для внутрішньої CV використовували 30% як порогове значення. Ми виключили метаболіти, якщо більше ніж 1 значення зразків контролю якості перевищувало показник IQR в 1,5 рази. Це було зроблено, оскільки для 6 зразків контролю якості випадково можуть бути 2 значення, що перевищують показник IQR в 1,5 рази.
Статистика
Програмне забезпечення R (3.0.2) (R Project for Statistical Computing, http://www.r-project.org/) було використано для всіх статистичних аналізів у цьому дослідженні.
Ми графічно перевіряли дані для нестандартного та нормального розподілу. Критичні значення визначали як значення, які в 1,5 рази перевищували показник IQR вище або нижче медіани. Серед критичних значень вимірювання, які були двома стандартними відхиленнями, крім наступного значення, були оголошені впливовими спостереженнями.
Відсутні значення враховувались за допомогою імпутації k найближчого сусіда (knn) [22], оскільки для обчислення відсотків необхідний повний набір даних. Якщо після внесення knn все ще залишалися впливові спостереження відповідно до наведеного вище визначення, відповідну вибірку виключали. Ми розрахували відсотки метаболітів для кожної особини та кожного виду, щоб описати відносний склад фосфоліпідів у ліпопротеїнах. Відсотки розраховували, виходячи з усіх метаболітів, а також групово метаболітів (PCaa, SM, PCae). На першому етапі ми дослідили відмінності у складі фосфоліпідів між худими та ожирілими вагітними жінками, стратифікованими за видами ліпопротеїдів. Було застосовано тест Уілкоксона Манна Уітні, як при невеликому розмірі вибірки (\ (\ ліворуч (\ frac = \ kern0.5em 0.0007 \ праворуч) \). стор-значення повідомляються, вони коригуються Бонферроні. Ми визначаємо тенденції як невиправлені стор-значення
Результати
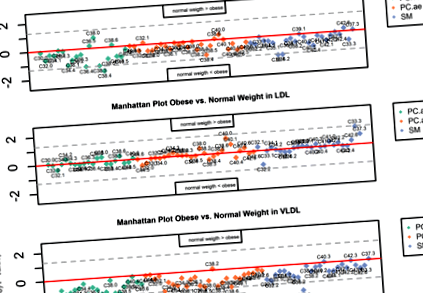
Характеристики предмета наведені в таблиці 1. Загалом 71 ПК та СМ пройшли наші критерії контролю якості, включаючи 20 PCaa (11 поліненасичених видів), 27 SM (16 насичених та мононенасичених) та 24 PCae (15 поліненасичених). U-тест Уілкоксона Манна Уітні на різницю в концентраціях метаболітів між нормальною вагою та пацієнтами з ожирінням не показав суттєвих відмінностей після корекції Бонферроні в жодному з підгруп ліпопротеїнів, хоча тенденція стор-значення Таблиця 1 Характеристика вагітних
Манхеттенський сюжет, що відображає | –log10 (p) | -значення (вісь y) тесту Уілкоксона Манна Уітні U, тестування на різницю метаболітів у плазмі між нормальною вагою та ожирінням вагітних, стратифікованих за видами ліпопротеїнів. Розсіяна лінія: некорегований рівень α при ± log10 (0,05) = ± 1,3
Аналіз PCA продемонстрував дискримінаційну тенденцію між видами ліпопротеїнів на основі основних компонентів (PrC) 1 і 2. Метаболіти з найвищими показниками в PrC 1 складалися в основному з видів SM, а також у PrC2 видів PC (Рис. 2, Таблиця 2 ). Діаграма балів показала, що PrC1 в основному відокремлює ЛПНЩ від інших двох, ЛПВЩ та ЛПНЩ, тоді як PrC2 відокремлює ЛПНЩ від ЛПНЩ і ЛПВЩ. PCA підтверджує, що склад фосфоліпідів у вагітних із ожирінням та худорлявих збігів подібний.
Графік балів для аналізу основних компонентів складу метаболітів ліпопротеїнів нормальної ваги та вагітних жінок із ожирінням
Під час тестування на відмінності між ЛПНЩ та ЛПВЩ у окремих видів метаболітів ЛПНЩ в основному містила насичені та мононенасичені СМ. SM C36: 1, SM C34: 1, SM C32: 1, SM C42: 3, SM C41: 1, SM C42: 2, SM C35: 1, SM C33: 1, SM C39: 1, SM C34: 2, SM C33: 3, SM C42: 1 та PCae C32: 1 були виявлені значно вищими при LDL. Відсоток поліненасичених жирних кислот (ПНЖК), що містять ПК, PCaa C38: 5, PCae C38: 5, PCae C36: 3, PCae C40: 6, PCae C44: 5 та PCaa C36: 4, був значно вищим у ЛПВЩ, ніж у ЛПНЩ (рис . 3).
У порівнянні між метаболітами видів ЛПНЩ і ЛПВЩ SM C42: 2, PCae C38: 5, SM C42: 1, PCae C42: 6, PCae C44: 5, PCae C38: 4, PCae C40: 6, PCae C36: 3, PCaa C32: 0, PCae C44: 6 та SM C41: 1 були значно вищими у ЛПВЩ порівняно з ЛПНЩ. Жоден метаболіт не був значно вищим у ЛПНЩ, ніж у ЛПВЩ (рис. 3).
LDL показав значно вищий відсоток SM C42: 2, SM C36: 1, SM C41: 1, SM C34: 1, SM C42: 1, SM C34: 2, SM C41: 2, SM C36: 2, SM C33: 3, SM C42: 3, SM C32: 1, SM C33: 1 та SM C35: 1 порівняно з ЛПНЩ (рис. 3). Загалом, 25 (35%) усіх виміряних фосфоліпідів показали значні відмінності між видами ліпопротеїдів.
Кореляція Спірмена між окремими видами фосфоліпідів та загальним вмістом холестерину ЛПВЩ та загального холестерину ЛПНЩ показала асоціації з різними видами, залежно від ліпопротеїну, але розсіяні графіки не показали чітких тенденцій (додатковий файл 1: Рисунки S1-S5) Найпопулярнішими метаболітами та холестериновими асоціаціями в ЛПВЩ з коефіцієнтом кореляції> 0,3 були PCae C32: 1, PCae C36: 3, PCae C38: 5, PCaa C36: 4, SM C33: 3, SM C34: 2, SM C34: 1 та SM C32: 1. У ЛПНЩ основними асоціаціями між холестерином та фосфоліпідами були PCae C44: 5, PCaa C38: 5, SM C42: 3, SM C42: 1 та SM C32: 1 (Додатковий файл 1: Рисунки S1-S5).
Обговорення
Склад фосфоліпідів ліпопротеїдів від 10 худих та 10 ожирілих вагітних жінок суттєво не відрізнявся між двома групами.
Цікаво, що видовий склад фосфоліпідів для основних видів ліпопротеїдів, ЛПНЩ, ЛПВЩ та ЛПНЩ подібний до даних, повідомлених раніше для чоловіків та невагітних жінок [17] (Таблиця 3).
Ми також виявили, що рівень СМ в ЛПНЩ вищий, ніж ЛПНЩ або ЛПВЩ, тоді як ЛПВЩ демонструє вищий відсоток ПК, переважно PCae, ніж інші два ліпопротеїни. Метаболіти, пов’язані з ЛПНЩ, містять більше насичених і мононенасичених видів, тоді як фосфоліпіди, виявлені у більшій пропорції в ЛПВЩ, містять більше поліненасичених видів. SM, загалом, в основному складаються з насичених та мононенасичених видів [24]. LDL асоціюється з більш насиченими видами, і встановлене вище співвідношення SM до PC свідчить про це [25]. Це дослідження показує, що не тільки насиченість або SM більш тісно пов'язані з LDL, ніж HDL, але це також специфічно для видів SM.
Фосфоліпідний склад ліпопротеїдів в останньому триместрі вагітності має особливе значення, оскільки саме тоді перенесення плацентарних ліпідів в основному залежить від активності EL, яка виявляє фосфоліпазу, а не активність ліпази TG [26]. Отже, особливо важливий для плоду вміст довголанцюгових поліненасичених та незамінних видів жирних кислот. Вони в основному містяться в ЛПВЩ [27], що підтверджено у цьому дослідженні. Було показано, що SM має інгібуючу дію на EL, що важливо особливо для поглинання фосфоліпідів LDL, хоча EL віддає перевагу HDL [28].
Ми показуємо подібні висновки у вагітних у порівнянні з чоловіками та невагітними жінками в інших дослідженнях, які, наприклад, виявили ЛПНЩ, що містить більше SM C34: 1, а не ЛПНЩ або ЛПВЩ [17, 29]. Цілком можливо, що зв'язок моделей ліпопротеїдів із серцево-судинними та іншими захворюваннями насправді може базуватися на складі фосфоліпідів у різних ліпопротеїнах.
Висновки
Ми вперше показали різний розподіл фосфоліпідів у ліпопротеїнах плазми крові вагітних жінок, схожих на розподіл чоловіків та невагітних жінок. Це вказує на те, що на функціональність ліпопротеїдів може впливати молекулярний видовий склад незалежно від стану вагітності. Потрібні додаткові дослідження, щоб краще зрозуміти окремий склад жирних кислот і фосфоліпідів різних ліпопротеїдів, щоб зрозуміти їх вплив на метаболізм ліпопротеїнів, здоров'я та захворювання.
- Роль P-глікопротеїну у фармакотерапії вагітних жінок Попова акушерство, гінекологія та
- Соління та морозиво, як божевільний комбо став знаковим для вагітних
- Безкоштовне повноцінне споживання дієти та вірування вагітних жінок із гестаційним діабетом у
- Нове дослідження говорить, що ЦЕ трапиться з вагітними жінками, якщо вони їдять банани New Idea Food
- РОЛЬ ГІНОВИХ ПОЛІМОРФІЗМІВ В ГЕНЕЗІ ГЕСТАЦІЙНИХ УСКЛАДНЕНЬ У ВАГІТНИХ ЖІН із ожирінням