Фолієва кислота, алкоголь та хвороби печінки
Анотація
Алкогольна хвороба печінки (АЛД), як правило, асоціюється з дефіцитом фолієвої кислоти, що є результатом зменшення споживання фолієвої кислоти з їжею, порушення всмоктування кишечника, зменшення поглинання та зберігання печінки та збільшення виведення сечової кислоти. Дефіцит фолієвої кислоти сприяє прогресуванню хвороби печінки за допомогою механізмів, які включають її вплив на метаболізм метіоніну з наслідками для синтезу та стабільності ДНК та епігенетичної регуляції експресії генів, що бере участь у шляхах ураження печінки. У цій роботі розглядається патогенез алкогольної хвороби печінки з особливим акцентом на індуковані етанолом зміни метаболізму метіоніну, які можуть діяти у взаємодії з дефіцитом фолатів для зменшення антиоксидантного захисту, а також стабільності ДНК, регулюючи епігенетичні механізми експресії відповідних генів. Ми також розглядаємо наявні дані про можливе лікування алкогольної хвороби печінки на основі виправлення порушень метаболізму метіоніну та регулювання метилювання відповідних генних експресій.
1. Хронічний алкоголізм та захворювання печінки
2. Дефіцит фолієвої кислоти при хронічному алкоголізмі: частота, причини та потенційний вплив на печінку
Захворюваність на дефіцит фолатів при хронічному алкоголізмі
Причини дефіциту фолатів при хронічному алкоголізмі та АЛД
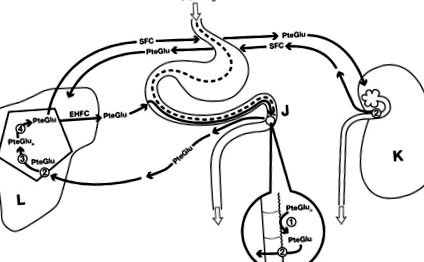
На додаток до дефіциту дієти [15], існує щонайменше чотири встановлені причини дефіциту фолієвої кислоти при хронічному алкоголізмі, які перераховані та обговорені нижче. Ці причини пов'язані з різними механізмами гомеостазу фолієвої кислоти, що проілюстровано на рисунку 1. Сюди входить перетравлювання харчових фолієвих речовин птероїлполіглутамата (PteGlun) до їх форми моноглутамату (PteGlu) за допомогою кишкової глутаматкарбоксипептидази II (GCPII) з подальшим перенесенням PteGlu через ворітну вену до печінки, де він транспортується через базолатеральні мембрани гепатоцитів. внутрішньоклітинне повторне поліглутамілацію та зберігання як PteGlun. Після подальшого внутрішньопечінкового гідролізу накопичувального PteGlun до метильованого PteGlu, фолат надходить як до ентерогепатичного циклу фолатів (EHFC) з повторним поглинанням 99%, так і до системної циркуляції фолатів (SFC) для транспортування до всіх клітин організму. Поточна регуляторна ділянка - нирка, де близько 90% метильованого PteGlu реабсорбується проксимальними канальцевими епітеліальними клітинами, а решта 10% виводиться із сечею щодня.
Дієтичний фолат переважно у формі птероїлполіглутамата (PteGlun), який потім гідролізується на межі кишечника (J) специфічною гамма-карбоксипептидазою (1), отримуючи птероімоноглутаміловий фолат (PteGlu), який метилюється, а потім транспортується через мембрани ентероцитів. редукований фолієвий носій (2) до ворітної вени. Подальший транспорт через мембрани гепатоцитів у печінці (L) сприяє зменшеному переноснику фолієвої кислоти (2), можливо разом із фолат-зв'язуючим білком або протонно-зв'язаним транспортером фолатів. У печінці PteGlu повторно поліглутамується внутрішньоклітинною фолілполіглутаматтететазою (3) до PteGlun для зберігання, а потім вивільняється назад у PteGlu за допомогою окремої гамма-глутаміл-гідролази (4) і транспортується як до ентерогепатичної циркуляції фолатів (EHFC), так і до системної циркуляції фолатів (SFC) для транспортування до всіх клітин організму. Екскреція сечі регулюється в нирках (К) шляхом повторного всмоктування приблизно на 90% за рахунок зменшеного носія фолієвої речовини на канальцевих клітинах нирок (2). Хоча менше 1% фолієвої кислоти виводиться з калом з EHFC, приблизно 10% пулу SFC щодня виводиться нирками, що вимагає заміни харчовим фолатом.
Знижене всмоктування фолієвої кислоти тонкою кишкою
Аномальне поглинання печінки та низький рівень зберігання фолієвої кислоти
Збільшення виведення фолієвої кислоти з сечею
Втрата фолієвої кислоти в сечі зафіксована у хворих на хронічний алкоголізм [36], щурів, що харчуються етанолом [37], та у мавп, що годують етанолом. Виведення фолієвої кислоти з сечею регулюється реабсорбцією клітин нирковими канальцями за допомогою як FBP, так і RFC на мембранах проксимальних трубчастих клітин кисті [39]. Однак тривала експозиція етанолу в мікросвині моделі ALD не впливала на транспорт фолієвої кислоти за допомогою ізольованих ниркових трубчастих мембран кисті або на експресію канальцевих RFC нирок [26]. Більш недавнє дослідження in vitro людських проксимальних ниркових канальцевих клітин виявило зменшення транспорту 5-MTHF у відповідь на короткочасну експозицію етанолу, тоді як субхронічне вплив етанолу у щурів збільшувало вираження FBP та RFC ниркових канальців [40]. Ці дослідження дозволяють припустити, що підвищена екскреція фолієвої кислоти в сечі спричинена гострим впливом етанолу з подальшою адаптацією до хронічного алкоголізму.
Вплив гострого впливу етанолу на рівень фолієвої кислоти
На додаток до цих причин дефіциту фолієвої кислоти при хронічному алкоголізмі, гострий прийом алкоголю, мабуть, негайно впливає на рівень фолієвої кислоти в сироватці крові та поглинання фолатів у тканинах. В експерименті, призначеному для вимірювання гострої дії алкоголю на метаболізм фолатів у добровольців, рівень фолієвої кислоти в сироватці крові впав протягом восьми годин після перорального або внутрішньовенного введення етанолу, швидко повертаючись до норми після припинення впливу алкоголю [41]. В іншому експерименті на людях гематологічна реакція на добавки фолієвої кислоти неодноразово переривалась прийомом етанолу у хворого на хронічну анемію та дефіцит фолієвої кислоти [42]. Механізми цих явищ залишаються незрозумілими, хоча можуть бути пов'язані з впливом гострого етанолу на перерозподіл циркулюючої фолієвої кислоти в ентерогепатичний цикл [35] або на збільшення екскреції фолієвої сечі [40]. Інші показали, що ацетальдегід, початковий метаболіт алкоголю, викликає окисне руйнування 5-MTHF in vitro [43].
3. Вітамінозалежний метаболізм метіоніну в стані здоров’я, алкоголізмі та АЛД
Вживання алкоголю впливає на описані шляхи метаболізму метіоніну на різних рівнях, а дефіцит фолієвої кислоти може сприяти захворюванню печінки, обмежуючи його вплив як субстрату метаболізму печінкового метіоніну. Наприклад, рівні транскриптів MS, BHMT, метіонін-аденозил-трансферази (MAT1A) та CβS були знижені в біопсіях печінки у хворих на цироз печінки, з аналогічними результатами в окремому дослідженні біопсій пацієнтів з алкогольним стеатогепатитом [50, 51]. При ALD рівні SAM, як правило, знижуються за рахунок зниження активності цих ферментів, тим самим збільшуючи активність MTHFR для збільшення ендогенного 5-MTHF і, отже, гарантування рівня SAM [45].
Хронічні алкоголіки, як правило, мають знижений рівень вітаміну В6, що пов’язано з витісненням вітаміну з білкового носія ацетальдегідом з подальшою деградацією фосфатазами [52]. Оскільки вітамін В6 є кофактором для двох транссульфуруючих ферментів (рис. 2), прямим наслідком дефіциту вітаміну В6 є порушення шляху транссульфуції з накопиченням гомоцистеїну. Дослідження 81 пацієнта з АЛД із розвиненим цирозом показало підвищення рівня гомоцистеїну та цистатіоніну в плазмі порівняно з 55 здоровими суб'єктами, що можна було пояснити ефектом зниження рівня вітаміну В6 на їх регуляторні ферменти (рис. 2) [53]. Подальше наше дослідження встановило значимість співвідношення α-амінобутират/цистатіонін, яке можна вважати маркером активності цистатіонази, що залежить від вітаміну В6. Ми порівняли 40 алкоголіків з клінічними ознаками захворювання печінки, які також пройшли біопсію печінки, з 26 алкоголіками без захворювань печінки та 28 здоровими суб'єктами. Співвідношення α-амінобутират/цистатіонін корелювало з тяжкістю фіброзу і було предиктором наявності ALD [10], демонструючи тим самим центральну роль дефіциту вітаміну B6 у прогресуванні ALD.
4. Потенційні наслідки дефіциту фолатів при розвитку АЛД
5. Вплив дефіциту фолієвої кислоти та алкоголізму на стабільність ДНК у зв'язку з прогресуванням ALD та ризиком раку
Дослідження за допомогою моделі ALD, що харчується етанолом, продемонструвало посилення розривів ланцюгів гепатоцелюлярної ДНК та апоптозу у зв'язку із зниженням рівня SAM та зниженням співвідношення dTMP до dUMP при збільшенні гепатоцелюлярної проліферації [61]. Подальше наше дослідження на фолієво-дефіцитній етанолової мікросвині асоціювало розвиток ALD із зниженим вмістом фолієвої кислоти в печінці та SAM, збільшенням окислення ДНК та розривами ланцюгів, а також глобальним гіпометилюванням ДНК, що узгоджується із комбінованим впливом на синтез ДНК та здатність метилювання [48]. . Інше дослідження пов’язувало низький рівень SAM із нестабільністю ДНК шляхом виявлення зниженої експресії MAT1A та рівнів SAM разом з розривами ланцюгів ДНК у всьому шлунку на моделі ALD щурів, що годували етанолом [62].
Підводячи підсумок, змінений метаболізм фолієвої кислоти та метіоніну, який пов’язаний із хронічним прийомом алкоголю, пов’язаний із посиленням прогресування АЛД та ризиком деяких видів раку, зокрема раку товстої кишки та HCC. Механізми цього спостереження включають дисбаланс та стабільність нуклеотидних ДНК, що виникають внаслідок відволікання субстрату TS 5,10-MTHF на шлях MTHFR, який може бути регульованим через дефіцит SAM, що виникає при відносному дефіциті фолатів. Ці механізми узгоджуються з клінічним спостереженням підвищеного ризику раку у алкоголіків із дефіцитом фолієвої кислоти, а також із збільшенням пошкодження ДНК із розривами ланцюгів, окисленням та апоптозом, що спостерігаються при експериментальній ALD у поєднанні зі зниженням рівня SAM. Як обговорюється нижче, зменшення SAM забезпечує додатковий ризик HCC шляхом стимулювання гіпометилювання ДНК.
6. Взаємодія фолатів та алкоголю в метилюванні ДНК та гістонів та ризики гіпометилювання ДНК
Епігенетична регуляція експресії генів включає ремоделювання хроматину шляхом додавання метильних груп до ДНК та/або посттрансляційної модифікації амінокислотних залишків гістону. Модифікація залишків амінокислот гістону шляхом метилювання та/або ацетилювання може змінити конформацію гістону, щоб забезпечити більшу експресію ДНК та/або навпаки. У ALD метилювання при H3K4, H3K36 та H3K79, як правило, призводить до активації генів, але гени можуть замовчуватися метилюванням на залишках гістонів H3K9, H327 та H4K20 [63]. Наприклад, підвищений рівень H3K4 був пов’язаний із посиленням активації генів, що беруть участь в окислювальному стресі, у хронічних щурів, що харчуються етанолом [64], тоді як дослідження первинних гепатоцитів щурів, що зазнали етанолу, виявили зниження метилювання H3K9 у поєднанні з декількома регульованими генами та посилення метилювання H3K4 у взаємодії з декількома регульованими генами [65]. Метилювання ДНК регулюється специфічними метилтрансферазами DNMT 1, 2, 3A та 3B [63], на одну або більше з яких може впливати метаболіт етанолу ацетальдегід [66].
Метилювання ДНК та гістону тісно пов’язане з метаболізмом метіоніну в печінці, оскільки рівень субстрату SAM є критичним як субстрат для метилтрансфераз, тоді як продукт S-аденозилгомоцистеїн (SAH) є потужним інгібітором тих самих реакцій [44]. Експериментальні умови, що призводять до низького рівня SAM, такі як дієти з дефіцитом метіоніну та холіну або делеція MAT1A, пов’язані з гіпометилюванням ДНК та розвитком цирозу із підвищеним ризиком гепатоцелюлярної карциноми (HCC) [62, 67, 68]. Дієта з дефіцитом фолієвої кислоти та метилу призвела до гіпометилювання ДНК у декількох тканинах у моделі щурів, що харчуються етанолом, разом із посиленою активністю DNMT1 для печінки [69]. Подальше дослідження з тієї ж групи пов’язувало дієту з дефіцитом метилу зі зниженим співвідношенням SAM та SAM/SAH, а також глобальним гіпометилюванням ДНК та незворотними пре-злоякісними вогнищами печінки [70]. У той час як експресія MAT1A та рівень SAM знижуються у пацієнтів з ALD [51], у миші з дефіцитом MAT1A розвивається стеатогепатит через 8 місяців, а HCC - через 18 місяців [71]. Інше дослідження продемонструвало профілактичний ефект SAM на розвиток HCC у щурів, яким вводили передракові клітини печінки [72].
У нашій нещодавній роботі оцінено вплив харчування етанолом на епігенетичну регуляцію вибраних генів на мишачій моделі ALD, яка гетерозиготна щодо CβS (рис. 2). Оскільки CβS регулює транссульфурацію гомоцистеїну, можна очікувати, що його дефіцит підвищує рівень гомоцистеїну [73], в свою чергу збільшуючи інгібітор метилази SAH через зворотний шлях SAHH (рис. 2). Оскільки вплив етанолу зменшує експресію та активність РС [51, 74], комбінація етанолу та гетерозиготності CβS, як можна передбачити, максимізує гомоцистеїн та, в другу чергу, SAH, одночасно із зменшенням виробництва SAM. Підсумовуючи наші результати, внутрішньошлункове годування етанолом гетерозиготних мишей CbS прискорило гістопатологію ALD, одночасно мінімізуючи коефіцієнт метилювання SAM/SAH. Імуногістохімічне фарбування виявило зниження кількості залишку гістону H3K9, тоді як імунопреципітація хроматину антитілом до H3K9 показала підвищену експресію генів, що мають відношення до стеатозу та апоптозу [75].
Підсумовуючи цей розділ, нові докази пов'язують індуковану етанолом зміну метаболізму печінкового гомоцистеїну, зокрема зменшення субстрату SAM-метилтрансферази або збільшення його інгібітора SAH, із зміненою експресією генів, що мають відношення до ALD. Індукція ДНКгіпометилювання дієтою з дефіцитом метилу пов’язана з ризиком HCC, а годування етанолом генетично зміненої моделі миші зміненого метаболізму метіоніну призвело до селективної експресії генів, пов’язаної з аберрантним метилюванням гістону.
7. Вплив добавок метильної групи при алкогольній хворобі печінки
Дослідження на моделях тварин
Клінічні дослідження
Підсумовуючи цей розділ, є безліч доказів того, що донори метилу SAM та бетаїн захищають при розробці експериментальних ALD на моделях тварин. Однак ефективність SAM як способу лікування встановленого ALD не була остаточно доведена в клінічних випробуваннях. Здається імовірним, що ефективність SAM вимагає його утримання та метаболізму інтактними гепатоцитами, що застосовуватиметься для профілактики захворювань, але не при наявності пошкоджених гепатоцитів за наявності ALD.
Короткий зміст та висновки
Цей огляд описав частоту дефіциту фолієвої кислоти при хронічному алкоголізмі та задокументував докази її зв’язку зі зміненим метаболізмом печінкового метіоніну в патогенезі АЛД. На додаток до дієтичної недостатності, механізми дефіциту фолатів при хронічному алкоголізмі включають кишкову мальабсорбцію, зменшення транспорту та зберігання печінки та знижену реабсорбцію нирок. Кілька механізмів зміненого метаболізму метіоніну як причини ALD включають дефект синтезу та стабільності ДНК та знижену здатність метилювання експресії генів, пов'язаних з пошкодженням печінки. Крім того, як знижена стабільність ДНК, так і посилене гіпометилювання ДНК пов’язані з підвищеним ризиком гепатоцелюлярного раку. Хоча як донори метилу SAM, так і бетаїн продемонстрували свою ефективність у профілактиці ALD та його патогенетичних механізмів на моделях тварин, докази їх ефективності при лікуванні клінічно встановленого ALD не продемонстровані.
Подяка
Автори підтримуються грантами Національних інститутів охорони здоров'я США грантів K08 DK084111 VM та R03AA020577 CHH
Скорочення
| ALD | алкогольна хвороба печінки |
| BHMT | бетаїн гомоцистеїн метилтрансфераза |
| CβS | цистатіонін-β-синтаза |
| dTMP | дезокситимідин монфосфат |
| смітник | дезоксиуридин монофосфат |
| EHFC | ентерогепатичний фолатний цикл |
| FBP | фолат-зв’язуючий білок |
| FPGS | фолілполіглутаматсинтетаза |
| GCPII | глутамат карбоксипептидаза II |
| GSH | глутатіон |
| LPS | ліпополісахарид |
| MAT1A | метіонін аденозилтрансфераза 1А |
| РС | метіонінсинтази |
| 5,10-MTHF | метилентетрагідрофолат |
| 5-MTHF | метилтетрагідрофолат |
| PCFT | протонний фолатний транспортер |
| PEMT | фосфатидилетаноламін трансфераза |
| PteGlu | птероїлмоноглутамат |
| PteGlun | птероїлполіглутамати |
| RFC | відновлений фолієвий носій |
| SAH | S-аденозилгомоцистеїн |
| СЕМ | S-аденозилметионін |
| SFC | системна циркуляція фолатів |
| TNFa | фактор некрозу пухлини альфа |
| TS | тимідинсинтаза |
Виноски
Конфлікт інтересів
Автори не мають конфлікту інтересів для розголошення.
- Жирова хвороба печінки тихий вбивця Нараяна Здоров'я
- Жирні кислоти сприяють розвитку жирової хвороби печінки через порушення регуляції 3-меркаптопірувату
- Жирова хвороба печінки зростає - Розваги та життя - Страудсбург, Пенсільванія
- ХВОРОБА ЖИРНОЇ ПЕЧЕНІ
- Чорний шоколад корисний для пацієнтів із захворюваннями печінки - індуїст