Фізичні вправи та обмеження калорій змінюють імунну систему мишей, підданих дієті з високим вмістом жиру
1 Департамент біофізики, Федеральний університет Сан-Паулу, 04023-062 Сан-Паулу, Іспанія, Бразилія
2 Школа мистецтв, наук і гуманітарних наук, Університет Сан-Паулу, Avenue Arlindo Bettio 1000, 03828-000 Сан-Паулу, SP, Бразилія
3 Відділ імунології, Лабораторія трансплантаційної імунобіології, Інститут біомедичних наук, Університет Сан-Паулу, 05508-900 Сан-Паулу, Іспанія, Бразилія
4 Департамент харчування, Школа харчування, Федеральний університет Пелотаса, 96010-610 Пелотас, РС, Бразилія
Анотація
1. Вступ
Хронічне запалення низького ступеня тяжкості пов’язане з резистентністю до інсуліну, діабетом 2 типу та кількома типами раку [1, 2]. Ці шкідливі умови також пов’язані з ожирінням [3]. У міру збільшення розмірів вісцеральних та підшкірних адипоцитів моноцити та CD4 + і CD8 + Т-клітини мігрують у жирову тканину (AT) [4], ініціюючи вивільнення прозапальних медіаторів (наприклад, IL-1
, IL-6, RANTES, MCP-1 та IL-18), що викликають місцеву інсулінорезистентність [5]. Таким чином, розширені АТ та їх популяції резидентних імунних клітин складають головне мікросередовище, в якому проводяться запальні цитокіни та виділяються в організмі [6].
Фізична активність та обмеження калорій (CR) - це нефармакологічні стратегії, рекомендовані для зменшення ожиріння [7]. Хоча сприятливі ефекти фізичних вправ добре описані в скелетних м’язах та печінці, те саме не стосується AT [7–9]. Крім того, існує мало інформації про вплив обох стратегій зниження ваги на популяції імунних клітин, що мешкають у AT. Щодо CR, хоча його значення у зменшенні маси тіла є безперечним, споживання здорової дієти вимагає таких помітних змін у способі життя, що багато людей не в змозі виконати одну з них.
Таким чином, важливо дослідити, чи здатні фізичні вправи та КР сприяти здоровому способу життя, зберігаючи дієту з високим вмістом жиру (СН). Метою цього дослідження було дослідити вплив фізичних вправ або CR на імунні клітини AT у мишей із ожирінням, індукованих дієтою.
2. Матеріали та методи
2.1. Тварини
, 5 мишей на групу) (у віці 8–12 тижнів; 23–26 г) були отримані з Догляду за тваринами при Федеральному університеті Сан-Паулу (UNIFESP). Усі тварини були розміщені в стандартних індивідуальних клітинах і мали доступ до води та їжі. Щоб вивчити зміни в популяціях судинних клітин строми в жировій тканині в умовах ожиріння, спричиненого дієтою, ми розділили мишей C57BL/6 на чотири групи і годували їх або стандартною дієтою чау (6% жиру, Nuvilab mod. CR-1) або дієта з високим вмістом жиру (D12451, 45% Ккал жиру, Дієти дослідження). На 16 тижні мишей додатково розподіляли на такі групи: (1) контрольна група, яка годувала нормальну чау з низьким вмістом жиру (LF); (2) контрольна група, яка харчувалася дієтою з високим вмістом жиру (СН); (3) група з обмеженим харчуванням, яка харчується 30% дієтою з високим вмістом жиру (HFREST); та (4) група фізичних вправ, що харчувалася дієтою з високим вмістом жиру, яка брала участь у 60-хвилинному плаванні (HFEX). Споживання їжі контролювали щодня. Виходячи з кількості споживаної дієтичної чау-їжі з високим вмістом жиру та використання композиції макроелементів як еталону, ми розрахували споживання енергії. Обмеження на 30% калорій було розроблено з урахуванням споживання СН.
Всі процедури були попередньо переглянуті та затверджені внутрішнім етичним комітетом установи.
2.2. Протокол вправ
Тварини HFEX піддавалися плаванню в системі плавання, пристосованій для мишей, водою, нагрітою до 30 ° C. 300-літровий бак мав 10 смуг руху та був оснащений повітряними насосами, які підтримували мишей у постійному русі. Плавання починалося з 15 хвилин у перший тиждень і поступово збільшувалось, поки миші не могли плавати 60 хвилин на день. На цей момент мишей HFEX піддавали плавальним заняттям 5 разів на тиждень протягом 6 тижнів. Як фізичні вправи, так і групи обмежень у харчуванні піддавались відповідному втручанню протягом 6 тижнів.
Мишей знеболювали кетаміном/ксилазином для забору крові через ретроорбітальне венозне сплетення, а потім гинули при вивиху шийки матки. Кров центрифугували при 1000 g протягом 10 хвилин. Сироватку виймали і зберігали при -80 ° C для подальшого аналізу. Ми відібрали по 1 г зразка пахового жиру з кожної групи та піддали зразку ферментативному розкладу. Всіх тварин зважували щотижня до кінця експериментів.
2.3. Виділення судинної фракції строми (Sfv) та проточної цитометрії
Після жертвоприношення миші пахову пахову жирову тканину (ІАТ) екстрагували, зважували та піддавали ферментативній деградації, як описано раніше [10]. Після виділення клітин IAT SFV додавали 200 мкл промивного буфера FCS (1x PBS, 2% SFC) і розчин центрифугували протягом 5 хвилин. Після того як супернатант викинули, гранулу ресуспендували в FCS і центрифугували протягом 5 хвилин при 600 g. Клітини фарбували анти-CD8 (Caltag-FITC-Medsystems, Букінгем, Великобританія), анти-CD4 (blue-Pacific-BioLegend), анти-F4/80 (PerCP-Bioscience) та анти-NK.1 (PE -Bioscience) антитіла. Стромальні клітини отримували за допомогою FACS у проточному цитометрі Canto II (BD, Becton Dickinson, NJ, USA). Аналіз даних був завершений за допомогою програми FlowJo 8.7.4. (Tree Star Inc., Ashland, OR, США).
2.4. Аналіз цитокінів у сироватці крові
Зразки сироватки зберігали при -80 ° C. Панель, яка використовувалась для імунологічного дослідження Milliplex Mouse на цитокіни/хемокіни, включала такі цитокіни: MCP-1, RANTES, TNF-alpha (фактор некрозу пухлини), IL-6 та IL1-. Тестування проводили відповідно до процедур, раніше описаних виробником (панель цитокінів/хемокінів Milliplex Mouse).
2.5. Тест на толерантність до глюкози
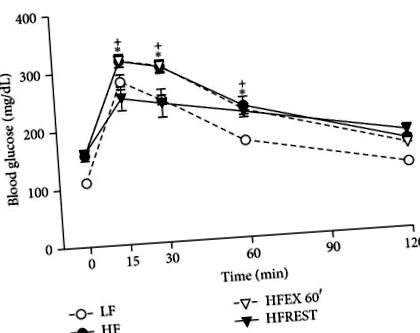
Тест на толерантність до глюкози (ГТТ) проводили у тварин, які голодували протягом 12 годин. Щоб уникнути стресу, між тестами був інтервал у 7 днів. Глікемію вимірювали за допомогою глюкометра (Accu-Chek Advantage), вимірюючи краплі крові, отримані з хвостової вени. Для GTT внутрішньочеревно вводили 1 г глюкози на кг ваги (БТ). Рівні глюкози визначали на початковому рівні, через 0, 15, 30, 60 та 120 хв після ін'єкції глюкози.
2.6. Статистичний аналіз
Дані були представлені як середнє значення
стандартна помилка в описовому тексті та графіці. Всі експерименти порівнювали за допомогою одностороннього ANOVA з подальшим тестом Тукі. Істотні відмінності були визначені, коли
значення було менше 0,05 (
). Графіка розроблена в Prism 5.0.
3. Результати
Тварини, які піддавались високочастотному харчуванню, споживали більше калорій порівняно з мишами із групи дієти з низьким рівнем жиру (рис. 1 (а)). Більше споживання калорій супроводжувалось збільшенням загальної маси тіла миші (рис. 1 (b)). Плавання у поєднанні з високочастотною дієтою змогло зменшити масу тіла миші, подібну до тієї, що спостерігалась у тварин, яким вводили обмеження калорій (рис. 1 (b)). Не було різниці в паховій жировій тканині (IAT) та коричневій жировій тканині (BAT) між дресированими тваринами та тваринами, які зазнали обмеження калорій (рис. 1 (c) та 1 (d)); проте дресировані тварини надавали більше НДНТ, ніж тварини з групи НЧ (рис. 1 (d)).
Відомо, що ожиріння пов’язане із системним запаленням низького ступеня. Тому ми досліджували ефекти ВЧ-дієти, фізичних вправ та обмеження дієти в наших досліджуваних групах, оцінюючи рівні сироватки кількох прозапальних цитокінів. Ми спостерігали підвищений рівень ІЛ-1 у групі з ВЧ-дієтою та зниження цього цитокіну в обох групах втручання (фізичне навантаження та обмеження калорій) (рис. 2 (а)). TNF-
на рівні сироватки крові не впливали зміни в дієті та фізичних навантаженнях, досліджені в цьому дослідженні (Рисунок 2 (b)).
), дієта з високим вмістом жиру (СН,
), дієта з високим вмістом жиру з фізичними вправами 60 ′ (HFEX 60 ′,
), а також дієта з високим вмістом жиру з 30% обмеженням їжі (HFREST,
, (c) IL-6, (d) RANTES та (e) MCP-1. Середній
На додаток до виконання як про-, так і протизапальної функції, IL-6 також відіграє важливу роль як у ожирінні, так і у фізичних вправах. Хоча ВЧ-дієта не змінювала рівні ІЛ-6, фізичні вправи збільшували свої рівні (рис. 2 (в)). Зменшення маси тіла не могло спричинити зміни рівня IL-6, оскільки відмінностей у групи обмеження калорійності не спостерігалося (Рисунок 2 (c)).
У тварин, підданих плаванню, значно підвищений рівень RANTES у сироватці крові (регулюється при активації, експресуються та секретуються нормальні Т-клітини). Збільшення маси тіла та ІАТ, що спостерігається у тварин, які піддавались ВЧ-дієті, не призвело до змін рівня RANTES, хоча очікується інфільтрація АТ-лімфоцитів під час ожиріння. Тим не менше, фізичні вправи підвищували рівень RANTES у сироватці крові, тоді як обмеження калорій не змінювало своїх рівнів (рис. 2 (d)). Більше того, MCP-1 (моноцитарний хемоаттрактантний білок-1) був знижений вправою і на нього не впливало обмеження калорій (рис. 2 (е)).
Оскільки імунні клітини, що мешкають в АТ із ожирінням, активно секретують прозапальні цитокіни та хемокіни, ми оцінили вплив ВЧ-дієти та обох втручань на популяції лейкоцитів АТ. Ми спостерігали зменшення CD4 + і CD8 + Т-лімфоцитів у AT у тварин, яким проводили обидва втручання, порівняно з тваринами, які споживають ВЧ-дієту (рис. 3 (a) та 3 (b)). Оскільки клітини CD8 + були більш редукованими, ніж клітини CD4 +, спостерігалося збільшення співвідношення CD4 +/CD8 + (рис. 3 (е)). На природний маркер клітин-кілерів (NK1.1) впливало лише обмеження калорій (рис. 3 (в)). Крім того, ми спостерігали, що як фізичні вправи, так і обмеження калорій змогли повернути назад збільшену інфільтрацію макрофагів, що спостерігається у групі, що діє на СН (Рисунок 3 (d)).
Щодо тесту на толерантність до глюкози, було помічено, що лише обмеження калорій змогло покращити цей параметр у порівнянні з групою СН (Рисунок 4).
, HFEX 60 ′ проти HFREST;
4. Обговорення
Імунні клітини знаходяться в нежирній і ожиріній жировій тканині, але мають різні характеристики в кожному стані. У міру збільшення розмірів адипоцитів ці імунні клітини змінюються з точки зору кількості та функціональності. Більше того, такі зміни в імунних клітинах активно сприяють встановленню місцевого та системного запалення низького ступеня [11]. Регулярні фізичні вправи є важливою нефармакологічною стратегією лікування ожиріння, оскільки захищають від збільшення маси тіла та врівноважують кілька шкідливих наслідків завдяки протизапальній дії [12]. Зазвичай для боротьби з ожирінням пропонується вправа з фізичними вправами з модифікацією дієти; поєднання обох втручань працює краще, ніж лише фізичні вправи [13–15]. Однак мало відомо про переваги фізичних вправ, коли не призначаються модифікації дієти.
Оскільки наші результати продемонстрували, що хронічні фізичні вправи здатні врівноважити кілька імунних змін, спричинених СН (або сприяють різним змінам), виявляється, що це втручання є корисним навіть при дотриманні дієти з високим вмістом жиру. Раніше було продемонстровано, що розширення AT зменшує кількість резидентних NK-клітин. NK-клітини виробляють значну кількість гамма-інтерферону (IFN-
), сприяючи запальному стану при AT. Дослідження також показали, що зменшення присутності запальних клітин в АТ покращує толерантність до глюкози у мишей з дефіцитом IFN [16]. IFN- також здатний інгібувати сигнальний шлях Їжака, який бере участь у диференціації адипоцитів [17]. Здатність фізичних вправ сприяти збільшенню кількості NK-клітин в AT також може відображати інший тип інфільтрації клітин, такий як NKT, який, схоже, виконує захисну роль. Відсутність змін у кількості NK-клітин підтверджується двома попередніми дослідженнями, які повідомляли, що втрата NK-клітин має незначний або зовсім не впливає на метаболічні параметри після 45-процентної ВЧ дієти протягом 26 тижнів або 60% тієї ж дієти протягом 12 тижнів [ 18, 19].
Відповідно до попередніх результатів [20, 21] ми спостерігали підвищену частоту макрофагів у АТ із ожирінням. Макрофаги реагують на стимулятори TLR, виробляючи помітну кількість прозапальних цитокінів (наприклад, IL-12, TNF, IL-1 та IL-6), посилюючи запальну реакцію AT [22]. Крім того, ці імунні медіатори беруть участь в інсулінорезистентності та цукровому діабеті 2 типу у організмів із ожирінням [23]. Таким чином, наші дані щодо макрофагів та жирової тканини тварин із ВЧ-дієтою відповідали попереднім дослідженням, які показали, що спостерігається підвищена інфільтрація макрофагів у AT. Хоча ми не оцінювали профіль макрофагів (наприклад, M1 та M2) в AT, ми перевірили, що збільшення кількості макрофагів та MCP-1, важливої молекули у вербуванні цих клітин [24], сприяне HF, було зворотним вправою.
У цьому дослідженні за збільшенням інфільтрації макрофагів через ВЧ спостерігалося збільшення кількості CD8 + Т-клітин в АТ. І навпаки, зменшення макрофагів, що сприяє фізичним вправам та обмеженню калорій, супроводжувалось зменшенням кількості CD8 + Т-клітин. Адаптивні Т-клітини також пов'язані з інфільтрацією макрофагів у AT [25]. CD8 + Т-клітини збільшуються в АТ у людей та тварин, які піддаються дієті з високим вмістом жиру, у 3-4 рази і виробляють велику кількість цитокінів та хемокінів. Нішимура та ін. [25] повідомляв, що нейтралізація CD8 + Т-клітин зменшила інфільтрацію макрофагів та резистентність до інсуліну у мишей, які отримували дієту з високим вмістом жиру. Адоптивний передача CD8 + Т-клітин мишам з дефіцитом цієї популяції клітин посилює запалення в АТ. Разом ці дані свідчать про те, що CD8 + Т-клітини активуються в АТ мишей, що страждають ожирінням, і що ці лімфоцити індукують активацію і міграцію макрофагів до AT.
CD4 + Т-клітини також відіграють ключову роль у прогресуванні ожиріння і пов'язані із запаленням через секрецію цитокінів. У мишей Rag-1 KO відновлення CD4 + Т-клітин зменшило приріст маси тіла, розмір адипоцитів, толерантність до глюкози та сигналізацію про інсулін [26, 27]. У цьому сенсі спокусливо припустити, що збільшення CD4 + Т-клітин завдяки ВЧ-дієті може компенсувати посилене запалення при AT. Зменшення цих клітин, викликане фізичними вправами та обмеженням калорій, свідчить про те, що поліпшення запалення в АТ викликає зменшення CD4 + Т-клітин.
У крові, як і в більшості тканин, співвідношення CD4 +/CD8 + Т-клітин, як правило, перевищує 2 до 1. Споживання ВЧ викликало зменшення цього співвідношення в AT. Важливо зазначити, що лише обмеження калорій змогло відновити цифри CD4 + і CD8 + до рівнів, що спостерігаються в групі НЧ, і це може бути пов'язано з різними реакціями, що спостерігаються в тесті на толерантність до глюкози.
Оскільки імунні клітини, що знаходяться в жировій тканині, є важливим джерелом прозапальних цитокінів та хемокінів при ожирінні, ми вирішили дослідити, чи впливає ВЧ дієта та втручання на цитокіни. Харчова дієта знижувала MCP-1 та збільшувала RANTES у сироватці порівняно з контролем. RANTES є потужним хемоаттрактантом для декількох типів клітин [28], включаючи NK-клітини [29]; його збільшення в сироватці крові контрольних тварин могло бути пов'язано з більшою кількістю NK-клітин у цих тварин.
Крім того, ефекти обмежень у харчуванні на рівні MCP-1, RANTES та IL-6 були різними в порівнянні з ефектами, що спостерігались у тренованій групі. Ці спостереження свідчать про те, що фізичні вправи та обмеження калорій, які, як вважають, можуть досягти однієї і тієї ж мети, діють за різними механізмами [30]. Інший приклад цього твердження - зменшення споживання їжі, що сприяє фізичним вправам. Відповідно до попередніх досліджень [31, 32], такий ефект може бути пов'язаний із впливом фізичних вправ на чутливість до лептину на центральну нервову систему. Дресировані тварини також представили підвищення рівня НДТ порівняно з групою НЧ, і спокусливо припустити, що зміна термогенезу може вплинути на зменшення маси тіла у дресированих тварин. Отже, наші результати свідчать про те, що ефект хронічних вправ не обмежувався витратою калорій завдяки практиці вправ.
Також слід обговорити кілька обмежень. Оскільки зміни, які ми спостерігали в рівнях циркулюючих цитокінів, не були суворо пов’язані з місцевою кількістю резидентних імунних клітин, важливо зазначити, що відсутність експериментів з виявлення цитокінів жирової тканини є обмеженням нашого дослідження. Також зауважте, що інтенсивність вправ є важливим фактором для адаптації. Таким чином, інші різні інтенсивності від тієї, яку ми оцінювали, можуть спричинити відмінні імунні зміни від тих, що спостерігаються в цьому документі, і це слід розглядати як обмеження нашої конструкції.
5. Висновки
Наші дані демонструють, що як фізичні вправи, так і обмеження калорій змогли врівноважити шкідливі ефекти, спричинені ВЧ-дієтою. Втручання спричинили зменшення маси тіла та жирових відкладень. Однак ці скорочення не могли пояснити всіх результатів, оскільки наслідки обмеження дієти та фізичних вправ були однаковими. Вправа впливає на вроджений імунітет (тобто NK1.1), тоді як обмеження дієти впливає на адаптивний імунітет (тобто співвідношення CD4 +/CD8 +). Обидва втручання по-різному впливали на рівень цитокінів та хемокінів.
Конфлікт інтересів
Автори заявляють, що у них немає конкуруючих інтересів.
Подяка
Це дослідження було підтримане грантами FAPESP (2011/03528-0).
Список літератури
- Їжа для роздумів Найкращі дієтичні поради для сильної імунної системи
- Помірні фізичні вправи рятують стероїдогенез та сперматогенез у щурів, що потрапляють у їжу
- Вплив середземноморської дієти з високим вмістом жиру на вагу тіла та об'єм талії є визначеним
- Вплив харчових нановолокна целюлози та фізичних вправ на ожиріння та мікробіоти кишечника у мишей, яких годували
- Мікобіоти та мікробіоти травного тракту та вплив на імунну систему - ScienceDirect