Капсульна ендоскопія товстої кишки, що веде до діагностики шлунково-кишкової стромальної пухлини (GIST) після відмови колоноскопії
А. Стемат
2-а гастроентерологічна кафедра внутрішньої медицини, Університетська лікарня, Медичний університет імені Кароля Давіли, Бухарест, вулиця Splaiul Independentei 169, сектор 5, Бухарест, Румунія
А. М. Філімон
Кафедра судинної хірургії, Університетська лікарня, Медичний університет імені Кароля Давіли, Бухарест, Національний інститут патології V Babes, Бухарест, Румунія
М. Томеску
Кафедра загальної хірургії, Університетська лікарня, Медичний університет імені Кароля Давіли Бухарест, Бухарест, Румунія
Л. Негреану
2-а гастроентерологічна кафедра внутрішньої медицини, Університетська лікарня, Медичний університет імені Кароля Давіли, Бухарест, вулиця Splaiul Independentei 169, сектор 5, Бухарест, Румунія
Анотація
Передумови
Шлунково-кишкові стромальні пухлини є підтипом пухлин мезенхіми. За останні роки було досягнуто значного прогресу в їх діагностиці та лікуванні, що призвело до значного поліпшення їх прогнозу. Ендоскопія залишається одним з основних методів діагностики. У рідкісних випадках невдачі колоноскопії доступні різні підходи: різні ендоскопи, комп’ютерна томографія, колонографія, капсульна ендоскопія, використання ентероскопа.
Презентація справи
Ми представляємо випадок із 75-річним кавказьким чоловіком, якого прийняли через біль у животі, діарею та втрату ваги. Дві спроби колоноскопії не вдалися в іншому центрі, і було прийнято рішення про використання ендоскопії капсули товстої кишки. Цей іспит виявив підслизову масу, розташовану в сигмовидної кишці. Було проведено хірургічне втручання та видалена стромальна пухлина шлунково-кишкового тракту, що вторглася в місцеву область. Це перше зображення шлунково-кишкової стромальної пухлини товстої кишки, побачене при капсульній ендоскопії.
Висновок
Капсула товстої кишки є корисним діагностичним інструментом у вибраних пацієнтів після відмови колоноскопії або протипоказань.
Передумови
Шлунково-кишкові стромальні пухлини є підтипом пухлин мезенхіми. Навіть якщо вони представляють лише 1% пухлин травлення, вони за останні роки досягли популярності завдяки кращому розумінню їх патогенезу та прогресу в діагностиці завдяки новим та вдосконаленим засобам візуалізації. Крім того, був досягнутий значний прогрес із цілеспрямованим молекулярним лікуванням, що призвело до значного поліпшення їх прогнозу.
Найпоширенішими локалізаціями ГІСТ є шлунок (50–60%) та тонкий кишечник (30–40%), і лише менше 5–10% розвивається в товстій кишці, прямій кишці та 1% у стравоході [1, 2]. Подібні пухлини можуть виникати в сальнику, брижі, заочеревині, підшлунковій залозі, печінці, жовчному міхурі та сечовому міхурі. Ці пухлини називаються позашлунково-кишковими стромальними пухлинами (EGIST) [3, 4].
Ендоскопія, ехоендоскопія та комп’ютерна томографія є середніми методами діагностики. Ми представляємо випадок з пацієнтом із сигмовидною кишкою, що знаходиться в ГІСТ, де діагноз був встановлений за допомогою капсульної ендоскопії після невдалого обстеження колоноскопії.
Презентація справи
75-річний кавказець подав до нашого відділення періодичні болі в животі в лівому нижньому квадранті, втрату ваги та прогресуючу астенію. Випорожнення були періодично діарейними, без видимої крові. Симптоми почалися кількома місяцями раніше, і вони поступово наростали. У нього не було істотної історії хвороби.
Клінічне обстеження показало блідого пацієнта з болем внизу живота внизу живота, відсутністю пальпувальних мас, відсутністю асциту та периферичних набряків. Аналізи крові були в межах норми, крім легкої залізодефіцитної анемії (гемоглобін 10,2 г/дл, сироваткове залізо 33 мкг/дл) та запальний синдром (позитивний С — реактивний білок, висока швидкість осідання еритроцитів 42 мм/год).
У попередньому місяці пацієнта госпіталізували в інше відділення, де було проведено верхню ендоскопію, яка не виявила пошкоджень, та дві спроби колоноскопії, які не пройшли сигмовидної кишки. Йому зробили барієву клізму, і у нього діагностували дивертикульоз. Його симптоми трактували як напад дивертикуліту. Він отримував проти діареї, спазмолітики та фторхінолон з частковим та тимчасовим зменшенням симптомів.
Його направили до нашого підрозділу для отримання другої думки. Оскільки у нього було дві помилки колоноскопії, і оскільки ми проводили постійне дослідження з використанням відеокапсули Pillcam Colon2 для пацієнтів, які не можуть або не бажають проходити колоноскопію, ми вирішили використовувати відеокапсулу Pillcam Colon2 від Give Imaging для дослідження товстої кишки. На той час використання ендоскопії капсули товстої кишки не було стандартною медичною допомогою в нашому інституті, але ми вважали, що це найкраща альтернатива для нашого пацієнта. Останнім часом, згідно з чинними вказівками Європейського товариства ендоскопії шлунково-кишкового тракту на капсульні ендоскопії, CCE є можливим та безпечним для візуалізації слизової оболонки товстої кишки у пацієнтів з неповною колоноскопією та без стенозу. [8].
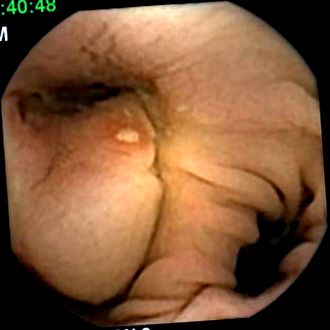
Після огляду його іригографії барію не було підозр на наявність стенозу товстої кишки. За допомогою капсули було проведено повне дослідження товстої кишки, яке показало множинні дивертикули без ознак запалення навколишньої слизової. Однак ми помітили підслизову масу діаметром приблизно 3 см, розташовану в сигмовидної кишці. Рис. 1 .
Виразкова підслизова маса в сигмовидної кишці
КТ черевної порожнини та малого тазу показало множинні дивертикули товстої кишки та м’яку тканину діаметром 5 см з некротичним центром із збільшеною товщиною сигмовидної стінки. Чіткого розмежування маси та сечового міхура не було видно, також було помічено важливе ущільнення перисигмоїдного жиру. Хоча перидивертикулярний абсцес був можливим, огляд аспекту КТ, підтвердженого зображеннями капсул, діагноз пухлини з некротизуючим центром, ймовірно, GIST, був більш вірогідним, оскільки цей вид некрозу є досить специфічним і раніше описаним у GIST [5] . Хворому зробили операцію з повною резекцією пухлини. Лімфатичні вузли, обстежені під час операції, не були задіяні.
Звіт про гістопатологічне дослідження виявив сигмовидний ГІСТ з розміром пухлини більше 5 см, з клітинами веретена, CD117 позитивним і частотою мітози понад 5/50 HPF, і оскільки пацієнт не мав значних супутніх захворювань, ми вважали його для ад'ювантної терапії. Пацієнт розпочав лікування іматиніб-мезилатом з хорошим розвитком через 6 місяців.
Обговорення
Клінічні особливості GIST є різними, пов’язаними з наявністю маси, перфорацією або непрохідністю. Виступ може бути з болем у животі або дискомфортом, гострою або хронічною кровотечею або анорексією [1]. Деякі пацієнти залишаються безсимптомними, а деякі ГІСТ виявляються шляхом випадкових імажистичних досліджень або при розтині.
Специфічні морфологічні та імуногістохімічні особливості встановлюють певний діагноз GIST: вони утворені веретеноподібними або епітеліоїдними клітинами, які експресують CD117 та мутації в KIT або PDGFRα (фактор росту альфа, що походить від тромбоцитів). Приблизно 80% також експресують CD34. Менше 5% є негативними для c-KIT [6].
Ендоскопія - один з основних методів діагностики. Хоча коефіцієнт повноти колоноскопії дорівнює 97% у експертних центрах, у змінної частки (4–20%) пацієнтів буде проведена неповна колоноскопія [7].
Після неповного колоноскопічного обстеження можна випробувати різні підходи: колоноскоп зі змінною жорсткістю, використання гастроскопа, одно- або двобалонну ентероскопію (доступна не у всіх центрах). Зміна центру або ендоскопіста є альтернативою. Однак перша невдала колоноскопія частіше асоціюється з нижчим рівнем успіху в майбутньому, особливо при зупинці в сигмоподібній [7]. Рентгенологічні методи, як подвійна контрастна барієва клізма або КТ-колонографія, також є корисними інструментами обстеження. Нещодавно ендоскопія капсули товстої кишки розглядалася як можлива альтернатива для таких пацієнтів. Чинний настанова Європейського товариства з ендоскопії шлунково-кишкового тракту на ендоскопію капсул враховує використання КЕЦ після відмови або відмови від колоноскопії. Відповідно до цих вказівок, CCE є здійсненним та безпечним, і видається точним при застосуванні у осіб із середнім ризиком та у пацієнтів з високим ризиком, для яких колоноскопія недоречна або неможлива. Для цих пацієнтів використання ХГВ може бути альтернативою [8].
- Нога Шарко - причини, діагностика, лікування та багато іншого
- Китайська найкраща трав'яна капсула для схуднення, натуральні таблетки для схуднення Lipo - Китай для схуднення, схуднення
- Китайський виробник для екстракту кактуса Hoodia Gordonii для екстракту для схуднення - Китай схуднути, схуднути
- Набір для очищення товстого кишечника з вугіллям та травами
- Біль у грудях та головний біль, діагностика та багато іншого