Електрохімічна поведінка та електроосадження наноструктурованого родію з низькотемпературних розплавів, що містять карбамід та ацетамід
Світлана Кочетова
Інститут загальної та неорганічної хімії імені Вернадського, пр. Палладіна, 32/34, м. Київ, 03142 Україна
Анастасія Савчук
Інститут загальної та неорганічної хімії імені Вернадського, пр. Палладіна, 32/34, Київ, 03142 Україна
Дмитро Шахнін
Інститут загальної та неорганічної хімії імені Вернадського, пр. Палладіна, 32/34, Київ, 03142 Україна
Віктор Малишев
Інститут загальної та неорганічної хімії імені Вернадського, пр. Палладіна, 32/34, м. Київ, 03142 Україна
Анотація
Досліджено електрохімічну поведінку родію при низькотемпературних розплавах карбамід-хлориду та ацетамід-хлориду. Було встановлено, що під час анодного розчинення родію в хлоридних розплавах, що містять карбамід та ацетамід, утворюються змішані комплекси [Rh (NH3) 4Cl2] + квазіоктаедричної симетрії D4h. Досліджено склад та структуру зароджуваних комплексних іонів. Під час електрохімічного відновлення комплексів [Rh (NH3) 4Cl2] + був здійснений синтез наночастинок Rh, а також нанопокриттів Fe, Cu та Mo.
Передумови
Наночастинки та матеріали на їх основі мають унікальні електричні, хімічні, магнітні, оптичні, каталітичні та інші властивості. Ось чому таким дослідженням приділяється значна увага [Бичкова [1], Гусєв та Ремпель [2], Білоглазкіна та ін. [3]]. У зв'язку з широким спектром застосувань нанокомпозитів у сучасних технологіях та матеріалознавстві розробляються методи їх синтезу [Оленін та Лісічкін [4]]. Велике значення у вирішенні цієї проблеми мають методи електрохімічного відновлення комплексів металів у низькотемпературних розплавах. Розробка методів синтезу наночастинок металів у низькотемпературних іонно-органічних розплавах із застосуванням складних сполук сприяє створенню нових технологій їх отримання.
Ця робота присвячена електрохімічному синтезу складних сполук, що містять родій, в іонно-органічних розплавах на основі сечовини та ацетаміду, ретельному дослідженню їх властивостей та структури за допомогою спектроскопічних методів та реалізації катодного осадження наноструктурованих покриттів родію на різні металеві підкладки.
Методи
Для визначення електрохімічних властивостей розплавів розчинників та вивчення електрохімічної поведінки резусу в розплавах, що містять карбамід та ацетамід, був обраний метод циклічної вольтамперометрії з використанням потенціостату ПІ-50-1.1. В якості анода була використана досліджувана металева пластина, а допоміжним електродом був платиновий стрижень. В якості електрода порівняння використовували напівклітину Ag/Ag +. Дослідження проводили в інтервалі температур 80–130 ° С в умовах аргону.
Для визначення стану іонів металів у розплавах після електрохімічного розчинення, а також для визначення структури та складу комплексів, що утворюються з компонентами розплаву, використовувались наступні спектроскопічні методи: електронна абсорбційна спектроскопія (EAS) під час електролізу (з Specord UV/VIS), інфрачервона спектроскопія швидко затверділих після електролізних розплавів (із Specord M-80) та газова хроматографія (з LCM-80).
Отриманий склад металевого осаду визначали методом рентгенофазового аналізу (з апаратом ДРОН-3), а структуру осаду методами просвічувальної електронної мікроскопії (з JEOL-100) та скануючої електронної мікроскопії (з REM-101).
Результати і обговорення
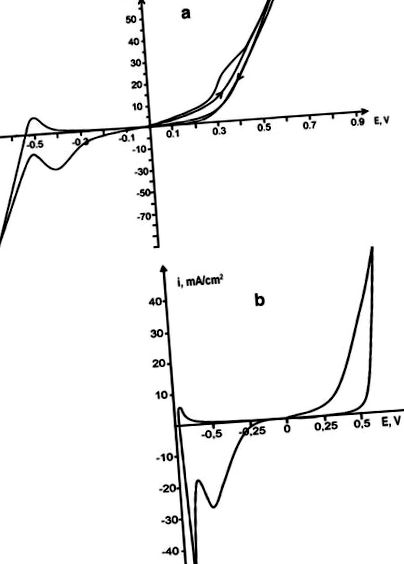
Анодне розчинення родію проводили в окремому розплаві сечовини та в евтектичному розплаві сечовини-NH4Cl (16,8 мовляв.%) (Т = 130 ° С). В окремій розплавленій сечовині розчинення металу ускладнюється пасивацією, і через слабку електропровідність розплаву збільшення катодного та анодного струмів погано виражається. Додавання NH4Cl до сечовини збільшує електропровідність розплаву, що веде до поляризаційних кривих, що чітко відображають всі процеси електродів. У розплаві карбамід-хлориду спочатку електрохімічне розчинення родію відбувається без обмежень; однак вже під час другого циклу відбувається пасивація анода, що проявляється появою плеча на анодній частині циклічної вольтамперограми (рис. 1, а). Втрати маси родієвого анода у розчині сечовини-хлориду зростають порівняно з окремою сечовиною, а інтенсивність забарвлення розплаву зростає і досягає глибокого жовто-коричневого кольору. Електрохімічне розчинення родію супроводжується утворенням іонів Rh (III).
Циклічні вольтамперограми родієвого електрода проти платинового стрижня в розплаві сечовини-NH4Cl (a), V p = 0,1 В/с, і ацетамід-NH4Cl (b), Vp = 0,1 В/с
Анодне розчинення родію також проводили в ацетамідному розплаві при 108 ° С і в ацетамідно-NH4Cl-розплаві при 80 ° С. Криві поляризації в розплаві ацетаміду розмиті, тому електродні процеси не можуть бути правильно інтерпретовані. Додавання хлориду амонію до ацетаміду з утворенням ацетаміду-NH4Cl (22,3 мол.%) Розплаву евтектичного складу [Туманова та співавт. [5]] дозволили отримати поляризаційні криві, які чітко показують електрохімічні процеси розчинення анода родію та відновлення його іонів. Родій розчиняється в ацетамід-хлоридному розплаві без пасивації (рис. 1, б). Швидкість його розчинення (4,7 ∙ 10 −5) більша, ніж у розчині сечовини-хлориду, тоді як питома провідність розчину сечовини-амонію хлориду (0,06 Ом -1 см -1) вище, ніж у ацетамід-хлориду (0,015 Ом) −1 см −1) [Туманова та співавт. [6]]. Цей результат можна пояснити відсутністю пасидації електродів під час електророзчинення в ацетамід-хлоридному розплаві. Після розчинення родій переноситься в розплав у вигляді іонів Rh (III).
Найбільш стабільним ступенем окиснення родію є Rh (III) з електронною конфігурацією [Kr] (4d) 6. Для комплексних сполук Rh (III), що характеризуються утворенням октаедричної конфігурації, основним станом для октаедричних комплексів Rh (III) є 1 A1g (t2g) 6, а синглетно збуджений стан - 1 T1g і 1 T2g, що стосується конфігурації ( t2g) 5 (наприклад).
Під час анодного розчинення Rh у розчині сечовини-хлориду в електронних спектрах з'являються смуги 28000 см -1 і 37000 см -1, а в ацетамід-хлоридному розплаві - 28000 см -1 і 36000 см -1 (рис. 2) . В ІЧ-спектрах швидко охолоджуваних зразків встановлено наявність коливань ν (Rh-N) при 480 см -1 і ν (Rh-Cl) при 330 см -1. Відповідно до літературних даних [Печінка [7], Волков та Яцимирський [8], Накамото [9]], це характерно для утворення в карбаміді та ацетаміді, що містять розплави квазіоктаедричних комплексів [Rh (NH3) 4Cl2] + симетрії D4h.
Електронні спектри комплексних іонів Rh (III) у хлоридно-ацетамідних (1) та сечовинно-хлоридних (2) плавляться при 120 ° C
Отримані такі спектроскопічні параметри для комплексів [Rh (NH3) 4Cl2] + у хлоридно-сечовинно-хлоридному та хлоридно-ацетамідному розплавах: 10 Dq = 31000 (30650) см -1; B = 562 (500) см -1; b = 0,78 (0,70). Сила поля лігандів у змішаних комплексах [Rh (NH3) 4Cl2] + слабша, ніж у чистих аміачних комплексах [Rh (NH3) 6] 3+, де 10 Dq = 33200 см −1 [Galus [10]], що ще раз підтверджує утворення в цих розплавах під час анодного розчинення родію змішаних комплексів [Rh (NH3) 4Cl2] + .
Комплексне з'єднання [Rh (NH3) 4Cl2] + у досліджуваних розплавах є електроактивним, і його відновлення спостерігається в катодній частині циклограм як максимум, показаний на рис. 1а, б. Визначення кінетичних параметрів процесу відновлення Rh (III) проводили звичайним методом. Основні критерії дифузійного контролю та оборотності процесу розраховували за рівняннями, наведеними в монографії Галуса [10]. Криві поляризації реєстрували в широкому діапазоні швидкостей поляризації: 0,05, 0,1, 0,2, 0,5 та 1 В/с. Залежність ip/V 1/2 від V 1/2 (рис. 3) прямолінійна і паралельна осі х, що показує, що процес протікає в режимі дифузії, але оскільки існує залежність ip від V 1/2 . Коефіцієнт дифузії іонів родію в хлоридно-сечовинному та хлоридно-ацетамідному розплавах визначається відповідною їх провідністю, а діапазон його значень знаходиться в межах 8,4 ∙ 10 −6 см 2/с для цих систем. Відновлення іонів родію відбувається незворотно в режимі дифузії в один крок до вільного металу. Мікрофотографія отриманих родієвих відкладень показана на рис.4 .
Залежність i p/V 1/2 від V 1/2 для катода родію проти платинового стрижня в розплавленій суміші сечовина-NH4Cl
Мікрофотографія наночастинок родію (10–22 нм), отриманих на катоді платини в розплавленій суміші сечовина-NH4Cl (JEOL-100)
Розмір частинок резус-осаду знаходиться в межах 10–22 нм, але значна частина їх агрегується. Середній розмір кристалітів родію оцінювали за фізичним розширенням піків і становить близько 5 нм. Це свідчить про утворення нанокомпозитів родію на поверхні металевих Fe, Cu та Mo у досліджуваних розплавах. Родієві покриття, отримані з розплавів на основі сечовини та ацетаміду з розчинним родієвим анодом, є однорідними, сірого кольору та товщиною 6,1 мкм (рис. 5). Під час осадження резус-покриття отримували 0,05–0,7 г металу залежно від часу електролізу. Таким чином, поточна врожайність становила 85–90%.
Поява резус-нанокомпозитів на поверхні Fe (a, b), Cu (c, d) і Mo (e, f) після електролізу в (1) карбамід- та (2) ацетамід-хлоридному розплаві з розчинним резус-анодом (отриманий за допомогою мікроскопа REM-101)
Висновки
Таким чином, електрохімічну поведінку родію вивчали в розплавах на основі сечовини та ацетаміду. Анодне розчинення металу в цих електролітах супроводжується пасивацією з утворенням Rh (III) комплексів, які в режимі дифузії відновлюються в один крок до металу. Здійснено синтез резус-наночастинок та нанопокриттів на поверхні Fe, Cu та Mo.
Подяка
Автори даної статті визнають підтримку всіх співробітників університету «Україна» у проведенні наукових досліджень та написанні цієї статті.
Фінансування
Автори даної статті не використовували жодних зовнішніх джерел фінансування на додаток до регулярного фінансування наукових досліджень, наданих Національною академією наук України.
Внески авторів
Автори даної статті внесли однаковий внесок у проведення наукових досліджень та написання цієї статті. Усі автори прочитали та схвалили остаточний рукопис.
Конкуруючі інтереси
Автори заявляють, що у них немає конкуруючих інтересів.
Примітка видавця
Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- ГОДИННИК 3111 TC SNP взаємодіє з емоційною поведінкою у харчуванні для схуднення в Середземномор’ї
- Вправа для схуднення домашніх тварин - New Horizons Veterinary Behaviour Solutions - Park Forest, IL
- Глобальний аналіз поведінки споживачів на ринку управління вагою та добробуту за країнами,
- Знайти найкраще) Top Fat Burner для чоловіків 28-денна втрата ваги - табір Комо
- Дієтичні таблетки Glam D огляд Dorfschmiede Freienseen