Експериментальний гіпертиреоз зменшує експресію генів і рівень сироватки адипокінів при ожирінні
1 кафедра внутрішньої медицини, Медична школа Ботукату, Університет штату Сан-Паулу, 18618-000 Ботукату, Іспанія, Бразилія
2 Департамент спорту, Центр фізичного виховання та спорту, Федеральний університет Еспіріту-Санту (UFES), 29075-910 Віторія, ES, Бразилія
Анотація
1. Вступ
Гормони щитовидної залози впливають на енергетичний метаболізм [1] і виконують центральну роль у регуляції метаболізму жирової тканини [2]. Порушення цих гормонів пов'язані зі зміною маси тіла та витрат енергії [3]. Хоча добре відомо, що гіпертиреоз призводить до втрати ваги, а гіпотиреоз пов'язаний із збільшенням ваги, зміни функції щитовидної залози суперечливо обговорюються при ожирінні [4].
Гормони щитовидної залози беруть участь у регуляції жирової тканини, тоді як гормони, що виробляються жировою тканиною, такі як резистин, адипонектин і лептин, беруть участь у регуляції енергетичного балансу [18]; однак взаємозв'язок між цими гормонами при ожирінні є суперечливим і навряд чи розглядається. У цьому контексті метою нашого дослідження було проаналізувати вплив супрафізіологічної дози Т3 на експресію гена та концентрацію лептину, резистину та адипонектину у тварин із ожирінням.
2. Матеріали та методи
2.1. Тварини та експериментальний протокол
У цьому дослідженні брали участь чоловіки Вістар щури, вагою приблизно 150 г, надані Центром тварин для експериментальної лабораторії клінічної медицини при Державному університеті Пауліста “Жуліо де Мескіта Фільо” в Ботукату, Сан-Паулу, Бразилія. Спочатку тварин поділяли на дві групи: контрольних (С) - годували комерційним чау-хоу ad libitum - та ожирілих (ОВ) - годували гіперкалорійною дієтою, як описано раніше [19], з метою викликати ожиріння. Після індукції ожиріння тварин з ОВ рандомізували на дві групи: ожиріння (ОВ,
), а ожирілим тваринам вводили супрафізіологічну дозу Т3 (ОТ,) у концентрації 25 μг/100 г маси тіла (БТ) [20]. Т3 вводили підшкірними ін’єкціями один раз на день протягом останніх 2 тижнів [21, 22]. Відповідні обсяги фізіологічного розчину вводили підшкірним ін’єкціям групам ОВ та С. Тварин утримували в окремих клітках при контрольованій температурі навколишнього середовища (22–26 ° C) та освітленні (12 год цикл світло-темнота). Дієтичне споживання контролювали щодня, а вагу оцінювали щотижня. Експериментальний протокол був затверджений Комісією з етики в експериментах на тваринах при Медичній школі Ботукату - ЮНЕСП, і дотримувався «Керівних принципів по догляду та використанню експериментальних тварин».
2.2. Загальний жир в організмі
Загальний жир в організмі вимірювали як суму епідидимальних, заочеревинних та вісцеральних жирових відкладень [23]. Ця точка даних була використана для підтвердження ожиріння у тварин. Крім того, розраховували індекс ожиріння (загальний жир у тілі, поділений на кінцеву масу тіла, помножений на 100, адаптований за Бустані та ін. [24]).
2.3. Біохімічний аналіз сироватки
Тварин голодували протягом 12-15 годин, знеболювали пентобарбіталом натрію, 50 мг/кг/в/в, і жертвували декапітацією. Кров збирали в сухі пробірки і центрифугували при 3000 об/хв протягом 10 хвилин. Сироватку зберігали при -80 ° C. Концентрації глюкози та триацилгліцерину в сироватці крові визначали за допомогою специфічних наборів (CELM, Сан-Паулу, Бразилія). Вільні жирні кислоти (ВЖК) визначали за допомогою комерційного набору (WAKO, WAKO Pure Chemical Industries Ltd., Осака, Японія). Дозування аналізували за допомогою автоматизованого колориметричного ферментного методу (Technicon, RA-XT System, Global Medical Instrumentation, Minessota, США).
2.4. Гормональні вимірювання
У всіх тварин вимірювали концентрації інсуліну, лептину, резистину, адипонектину, вільного Т3, вільного Т4 та ТТГ у сироватці крові. Вимірювання проводили за допомогою імунологічного аналізу, вимірюваного за допомогою зчитувача мікропланшетів (Spectra Max 190 — Molecular Devices, Саннівейл, Каліфорнія, США). Комерційні набори використовувались для вимірювання лептину, інсуліну, адипонектину (ELISA kit-Millipore, St. Charles, MO, USA), резистину (ELISA kit-B-Bridge International Inc., Mountain View, CA, USA) та щитовидної залози гормони (комплект ІФА-USCN Life Science & Technology Company, Ухань, Китай).
2.5. Експресія генів
Цільну РНК екстрагували із заочеревинної жирової тканини за допомогою реагенту Trizol (Invitrogen, Сан-Паулу, Бразилія), відповідно до інструкцій виробника. Система синтезу першої нитки SuperScript II для RT-PCR (Invitrogen, Сан-Паулу, Бразилія) був використаний для синтезу 20 μL комплементарної ДНК (кДНК) з 1000 нг цілої РНК. Рівні мРНК лептину (аналіз Rn 00565158_mL - Applied Biosystems), резистину (аналіз Rn 00595224_mL - Applied Biosystems) та адипонектину (аналіз Rn 00595250_mL - Applied Biosystems) визначали методом ПЛР у реальному часі. Кількісні вимірювання проводились за допомогою комерційного набору TaqMan qPCR (Applied Biosystems), згідно з інструкціями виробника, в системі виявлення Applied Biosystems StepOne Plus. Умови циклізації були такими: активація ферменту при 50 ° С протягом 2 хв, денатурація при 95 ° С протягом 10 хв, продукти кДНК посилювались протягом 40 циклів денатурації при 95 ° С протягом 15 с і відпал/розширення при 60 ° С протягом 1 хв. Експресія гена визначалася кількісно щодо значень групи С після нормалізації за допомогою внутрішнього контролю (циклофілін-аналіз Rn 00690933_mL — Applied Biosystems) методом
, як описано раніше [25].
2.6. Статистичний аналіз
Зміни маси тіла оцінювали за довірчим інтервалом 95%. Експресія генів, біохімія та дані про гормони аналізували за допомогою дисперсійного аналізу (ANOVA), доповненого тестом Бонферроні. Дані виражаються як середнє значення ± стандартне відхилення. Було прийнято рівень значущості 5%.
3. Результати
3.1. Еволюція маси тіла
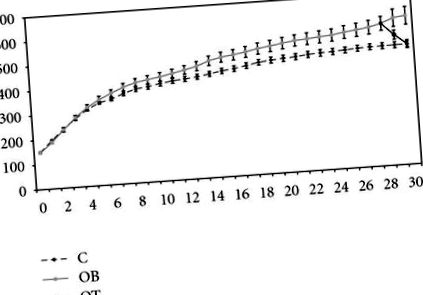
На початку дослідження всі тварини мали подібну ЧД. До 13 тижня тварини з ОВ були важчими за групу С. Після 30 тижнів експерименту ЧД групи ОВ (604 г ± 36 г) була статистично вищою, ніж у групи С (488 г ± 11 г). BW групи OB + T3 (489 г ± 16 г) був значно нижчим, ніж група OB, але не суттєво відрізнявся від групи C (Рисунок 1).
), і страждають ожирінням з 25 μг T3/100 г ЧБ (поза,
3.2. Загальний жир в організмі
Гіперкалорійна дієта збільшила жирові відкладення та індекс ожиріння. Введення Т3 зменшило заочеревинні, вісцеральні та епідидимальні жирові відкладення. Подібним чином при введенні Т3 зменшували загальний жир і індекс ожиріння (табл.
г T3/100 г ЧБ. Дані виражаються як середнє значення ± стандартне відхилення. Використовували ANOVA, доповнений тестом Бонферроні. Використання одних і тих самих букв означає
; різні букви представляють
3.3. Біохімічний аналіз
У таблиці 2 представлені значення глюкози, TG та FFA. Гіперкалорійна дієта не змінила біохімічних показників у порівнянні з групою С. Відмічалось збільшення рівня глюкози та FFA, але статистичної різниці рівнів TG у групі ОТ не спостерігалося порівняно з групою ОВ.
г T3/100 г ЧБ. Дані виражаються як середнє значення ± стандартне відхилення. Використовували ANOVA, доповнений тестом Бонферроні. Використання одних і тих самих букв означає
; різні букви представляють
3.4. Гормональні вимірювання
Гіперкалорійна дієта не змінила профіль щитовидної залози; однак спостерігалося підвищення рівня лептину та резистину та зменшення концентрації адипонектину в сироватці крові. У групі ОТ рівні Т3 були підвищені, проте концентрації вільного Т4 і ТТГ у сироватці крові були зменшені (табл. 3). Введення Т3 знизило рівні адипокінів у сироватці крові, оцінило лептин (рис. 2 (а)), резистин (рис. 2 (б)) та адипонектин (рис. 2 (в)).
г T3/100 г ЧБ. Дані виражаються як середнє значення ± стандартне відхилення. Використовували ANOVA, доповнений тестом Бонферроні. Використання одних і тих самих букв означає
; різні букви представляють
); ВЗ: ожиріння з 25 μг T3/100 г ЧБ (
). Дані виражаються як середнє значення ± стандартне відхилення. Використовували ANOVA, доповнений тестом Бонферроні. Використання одних і тих самих букв означає
; різні букви представляють
3.5. Експресія генів
За допомогою ПЛР у реальному часі експресію генів аналізували, використовуючи 6 тварин на групу. Зразки нормалізували за допомогою внутрішнього контролю (циклофілін), а С-групу - на 1. Експресія генів лептину (рис. 3 (а)) та резистину (рис. 3 (б)) була збільшена в групі ОВ, але зменшилась у групі ЗЗ. Порівняно з групою С, експресія гена адипонектину (рис. 3 (в)) знижувалася за рахунок гіперкалорійної дієти. Порівняно з групою OB, введення Т3 знижувало рівень експресії адипонектину.
); ВЗ: ожиріння з 25 μг T3/100 г ЧБ (
). Дані виражаються як середнє значення ± стандартне відхилення. Використовували ANOVA, доповнений тестом Бонферроні. Використання одних і тих самих букв означає
; різні букви представляють
4. Обговорення
Ожиріння - це стан, який за останні роки досяг рівня епідемії [6]. Це складне захворювання, де спосіб життя взаємодіє з генетичною сприйнятливістю, виробляючи фенотип ожиріння. На сьогоднішній день суттєве зростання показників ожиріння, як видається, зумовлене способом життя населення, особливо через невідповідний режим харчування та відсутність фізичної активності [4]. Спосіб життя широко визнаний як відіграючи центральну роль в етіології хронічних захворювань [26]. Крім того, ожиріння пов'язане з кількома хронічними захворюваннями, включаючи ішемічну хворобу артерій, гіпертонію, цукровий діабет 2 типу та деякі форми раку [5].
Однорідна поведінка тварин не забезпечується в експериментальних дослідженнях, навіть коли вони утримуються в лабораторних умовах. У цьому контексті щури, які отримують нормокалорійний або гіперкалорійний раціон на моделях ожиріння, спричиненого дієтою, можуть представляти різні реакції із загальними характеристиками [27]. Таким чином, можуть траплятися помилки класифікації, такі як тварини, піддані нормокалорійній дієті, можуть бути класифіковані як контролі, коли насправді вони виявляють реакції, подібні до тварин, які ожиріли через гіперкалорійну дієту, або навпаки. З цієї причини стає необхідним встановити критерій, який би дозволив розділити тварин на контроль або ожиріння. Дослідження в нашій лабораторії показало, що найкращим показником ожиріння є ожиріння тіла, але цей показник отримують після евтаназії тварини [27]. Однак BW, оцінений in vivo, представляє хорошу кореляцію з індексом ожиріння [27]. У цьому контексті контрольна та ожиріла групи були сформовані шляхом застосування BW як критерію класифікації дослідження.
Введення супрафізіологічних доз Т3 збільшувало сироваткову концентрацію Т3 [28]. У ОТ тварин рівень вільного Т4 і ТТГ був знижений порівняно з ОВ тваринами, що не дивно, оскільки екзогенний Т3 пригнічує ендогенну секрецію ТТГ і Т4 щитовидною залозою [29], що свідчить про ефективність лікування.
Гіперкалорійні дієти викликають посилений приріст ваги та ожиріння. Споживання дієт, багатих жиром, не збільшує окислення ліпідів у тій же пропорції, що призводить до підвищення маси тіла за рахунок відкладення триацилгліцерину в жировій тканині [30, 31]. Надофізіологічні дози Т3 зменшували вагу ОВ тварин та знижували індекс ожиріння (рис. 1, табл. 1). Гормони та цитокіни індукують різну метаболічну реакцію в різних жирових відкладах [32], і це дослідження показує схожу мобілізацію всіх жирових відкладень у групі ОТ (Таблиця 1).
Гормони щитовидної залози регулюють метаболізм ліпідів [33], а їх надлишок, серед інших ефектів, збільшує ліполіз, плазматичну концентрацію проміжних ліпідів та перекисне окислення ліпідів [34]. Концентрації вільних жирних кислот використовуються для позначення мобілізації жиру [35]. У цьому дослідженні введення Т3 піднімає ліполіз у групі ОТ, але не змінює рівні ТГ (Таблиця 2). Ці дані узгоджуються з іншими повідомленнями про рівень ТГ, на який гормон щитовидної залози не впливає [36].
Надлишок тиреоїдних гормонів збільшує рівень глюкози в плазмі [37]. Введення Т3 призвело до значного зменшення рівня інсуліну в плазмі крові у тварин, яких лікували (дані не наведені). Тим не менше, точний вплив гормонів щитовидної залози на чутливість до інсуліну та метаболізм глюкози залишається суперечливим [38]. Однак одним важливим фактором, який слід виділити в цьому дослідженні, є те, що гормони щитовидної залози спричиняють втрату ваги способом, пов'язаним із підвищенням стійкості до інсуліну (дані не наведені) [39].
Лептин може впливати на взаємодію між генами та факторами навколишнього середовища. Дієти, багаті жиром, підвищують рівень лептину, можуть по-різному впливати на склад тіла навіть при подібних дієтах. Однак підвищення рівня лептину краще пояснюється збільшенням жиру в організмі [31]. Експериментальні дослідження показують, що чутливість до лептину можна контролювати за допомогою гормональних та харчових факторів [40]. У літературі видно чітку позитивну кореляцію між жировою тканиною та експресією лептину. Індуковане дієтою ожиріння підвищує експресію генів лептину [41, 42]. Однак ефекти Т3 на експресію гена лептину дають суперечливі результати; незважаючи на дані in vitro, які показують, що Т3 викликає дозозалежний підйом експресії лептину [43], наші дані показують, що після гіпертиреозу in vivo експресія генів лептину знизилася. Відповідно, Pinkney et al. [2] та Zabrocka et al. [28] спостерігали зменшення експресії лептину у відповідь на лікування Т3.
Фізіологічна роль адипонектину ще не з’ясована до кінця. Експериментальні дані свідчать про те, що адипонектин підвищує чутливість до інсуліну і може мати антиатерогенні та протизапальні властивості [44]. Добре встановлено, що рівні адипонектину обернено пропорційні ступеню ожиріння [45], а втрата ваги підвищує ендогенне вироблення адипонектину [46]. Тут ми демонструємо, що група ОВ знизила рівень адипонектину в сироватці порівняно з групою С, а введення Т3, що цікаво, навіть зменшуючи масу жиру в організмі, показало нижчі рівні адипонектину (рис. 2 (в) та 3 (в) ). Підтверджуючи ці дані Cabanelas et al. [47] показують знижену експресію гена адипонектину в пахових експлантатах нормальних щурів; також нещодавно ми продемонстрували, що рівень адипонектину знижується у щурів із ожирінням з обмеженим вмістом калорій [48]. Однак, на відміну від них, експериментальне дослідження щурів з гіпертиреозом показало важливе підвищення рівня адипонектину в сироватці крові [49]. Наші дані показують, що супрафізіологічні дози Т3 змінюють експресію адипонектину при ожирінні, припускаючи, що Т3 викликає небажані ефекти на жирову тканину.
Резистин шкодить гомеостазу глюкози та дії інсуліну у мишей [50, 51]. Таким чином, резистин може виконувати посередницьку роль між ожирінням та резистентністю до інсуліну у гризунів, хоча ця роль досі залишається під питанням у людей [52]. У цьому дослідженні гіперкалорійна дієта підвищує рівень резистину в сироватці крові, тоді як лікування Т3 знижує його. Значне зменшення сироваткового резистину в групі ОТ підтверджує перше дослідження, проведене на людях, в якому пацієнти з гіпертиреозом виявляли низькі концентрації резистину в сироватці крові [53]. Однак ці початкові висновки контрастують з подальшими дослідженнями, які повідомляють про високий рівень резистину у пацієнтів з гіпертиреозом [54, 55], показуючи розбіжність даних. Проте експресія гена резистину майже не виявляється у щурів з гіпертиреозом [56]. Наші результати показують, що введення супрафізіологічних доз Т3 знижує експресію резистину до рівнів групи С (рис. 3 (b)).
5. Висновок
Екзогенне лікування Т3 ефективно підвищує рівень вільного Т3 у сироватці крові та зменшує концентрацію вільного Т4 та ТТГ. Введення Т3 сприяє зниженню ваги та зменшенню ожиріння. Після введення Т3 спостерігалося зниження концентрації лептину, резистину та адипонектину в сироватці крові, а також зменшення експресії генів. Наші дані демонструють, що Т3 діє, прямо чи опосередковано, на адипокіни, отримані з жирової тканини, які можуть впливати на гомеостаз усього тіла. Цей звіт надає нові уявлення про взаємозв'язок між Т3 та адипокінами в моделі ожиріння.
Подяка
Автори дякують Сандрі Фабіо, Хосе Джорджете, Маріу Бруно та Суелі Кларі за їх технічну допомогу. Вони вдячні Діжон Х.С. Кампосу та Рікардо Л. Даматоту за їхній внесок у евтаназію тварин. Вони також дякують FAPESP за фінансову підтримку (процеси: 06/58177-0 та 07/50041-4). Цей рукопис було вичитано та відредаговано носіями англійської мови, що мають відповідний досвід у коректурі BioMed. Усі автори заявляють, що не існує конфлікту інтересів.
Список літератури
- Морфологія кишечника та експресія генів при ожирінні Короткий огляд та перспективи - ScienceDirect
- Вплив метаболізму інсулін-глюкоза в порівнянні з ожирінням на експресію гена жирового оментину в
- Індуковане дієтою ожиріння та зміни експресії печінкових генів у мишей з дефіцитом C57BL6J та ICAM-1
- Вправи, але не дієта, спричинена зниженням ваги, зменшують експресію запальних генів скелетних м’язів у
- Депо, що залежить від депо, вплив дексаметазону на експресію генів у людському сальнику та черевній порожнині