Експериментальна система in vivo для вивчення розвантаження цукрової флоеми у дозріванні виноградних ягід під час стресового дефіциту
ЧЖЕН-ПІНГ ВАНГ
1 AGRO Montpellier, UMR 1083 ‘Sciences pour l’Oenologie et la Viticulture’, 2 місце P.Viala, F ‐ 34060 Montpellier Cedex 1, Франція
2 Китайський університет Нінся, Іньчуань, 750021 Нінся, Китай
ОЛЕАН ДЕЛОЙР
1 AGRO Montpellier, UMR 1083 ‘Sciences pour l’Oenologie et la Viticulture’, 2 місце P.Viala, F ‐ 34060 Montpellier Cedex 1, Франція
ОЛЕЙН КАРБОННЕ
1 AGRO Montpellier, UMR 1083 ‘Sciences pour l’Oenologie et la Viticulture’, 2 місце P.Viala, F ‐ 34060 Montpellier Cedex 1, Франція
БРИЖІТ ФЕДЕРСПІЕЛЬ
1 AGRO Montpellier, UMR 1083 ‘Sciences pour l’Oenologie et la Viticulture’, 2 місце P.Viala, F ‐ 34060 Montpellier Cedex 1, Франція
ФРАНШУА ЛОПЕЗ
1 AGRO Montpellier, UMR 1083 ‘Sciences pour l’Oenologie et la Viticulture’, 2 місце P.Viala, F ‐ 34060 Montpellier Cedex 1, Франція
Пов’язані дані
Анотація
ВСТУП
В останні два десятиліття, після початкового сплеску інтересу до механізму навантаження флоеми в листі, ряд вчених звернули свою увагу на райони опускання рослини та на вивчення шляху та механізмів розвантаження флоеми. В даний час загальновизнано, що області занурення рослин справляють значний вплив при визначенні закономірності розподілу фотоасимілятів у рослинах (Хо, 1988; Патрік, 1990, 1997). Вивантаження флоеми було визначено як серію транспортних етапів, які розчинені речовини здійснюють від просвіту елемента сита до місць утилізації в клітинах реципієнта (Oparka, 1990). Необхідно дослідити механізми розвантаження флоеми, щоб можна було визначити вплив факторів зовнішнього середовища на накопичення цукру в органах раковини.
Після транспортування на флоті на великі відстані вихід фотоасимілятів з елементів сита є першим кроком у складній серії кроків на короткі відстані в органах раковини (Oparka, 1990). Деякі методики були описані для конкретного дослідження розвантаження флоеми. Наприклад, метод «порожня насіннєва оболонка» або «порожня яйцеклітина» був використаний для вивчення розвантаження флоеми в насіннєвих оболонках (Thorne and Rainbird, 1983; Wolswinkel and Ammerlaan, 1983; Gifford and Thorne, 1986). «Техніка розвантажувальної пастки» була використана для вивчення розвантаження флоеми у вирощуванні бульб картоплі (Oparka та Prior, 1987) та яблуках (Lü et al., 1999). Ці методи мають недоліки ампутації флоеми та пошкодження тканини органу раковини, що ускладнює пошук підходящої позиції для наближення до точки розвантаження флоеми. `` Техніка тканинного диска '' була використана для вивчення розвантаження фотоасимілятів та накопичення та метаболізму цукру в томатах (Damon et al., 1988), полуниці (Ofosu-Anim та Yamaki, 1994) та виноградних ягід (Findlay et al., 1987). Цей метод також може травмувати флоему та навколишні тканини і не дає відтворюваних результатів.
Також для вивчення розвантаження флоеми застосовували методику ізотопного індикатора (Thorne and Rainbird, 1983; Wolswinkel and Ammerlaan, 1983; Xia, 1999). Цей метод може не тільки змінити середовище вирощування рослини, але й метод громіздкий, витратний і вимагає наявності висококваліфікованого персоналу. Тому ми вважали важливим знайти нову техніку, яка допоможе кількісно визначити розвантаження цукрової флоеми у ягодах винограду (Vitis vinifera L.).
Виноградні ягоди демонструють подвійний сигмовидний характер розвитку, з двома чіткими фазами росту, розділеними фазою відставання (Coombe, 1992; Robinson and Davies, 2000). Фаза дозрівання у процесі дозрівання виноградних ягід настає під час другого періоду росту і є результатом розширення, не розмножуючись, клітин перикарпа (Ojeda et al., 2001). Верезон після фази відставання визначається як початок дозрівання ягід та накопичення цукру. Цей етап характеризується розм’якшенням ягід і накопиченням антоціанів у червоних сортах винограду (Coombe, 1992). Накопичення цукру відбувається під час фази дозрівання і починається відразу після розм'якшення.
У цій роботі описаний новий метод, який використовує ягідну чашку в експериментальній системі in vivo для вивчення розвантаження цукрової флоеми у дозріванні виноградних ягід. Цей метод також може бути використаний для вивчення впливу різних внутрішніх та зовнішніх факторів на накопичення цукру в виноградних ягодах.
МАТЕРІАЛИ І МЕТОДИ
Рослинний матеріал та умови зростання
Всі експерименти проводились на 12-річних лозах Сири (Vitis vinifera L.), прищеплених на підщепи фекалів, дресированих на лірі (офіційна назва типу тренувальної системи виноградної лози), висаджених у горщики об'ємом 70 л в експериментальній програмі Ecotron система (AGRO-Монпельє, Франція). Ряди лоз були розташовані в орієнтації північ-південь. Садовий субстрат являв собою суміш перліту та піску (9: 1 за обсягом). Запліднення та зрошення забезпечувалась система краплинного зрошення. Стан води у рослинах контролювався потенціалом води перед листям (Ψb) (Scholander et al., 1965; Carbonneau, 1998). Ψb контрольних лоз становив 0 ≥ Ψb ≥ –0 · 2 МПа та –0 · 5 ≥ Ψb ≥ –0 · 6 МПа для виноградних лоз.
Підготовка експериментальної системи in vivo з ягідної чашки
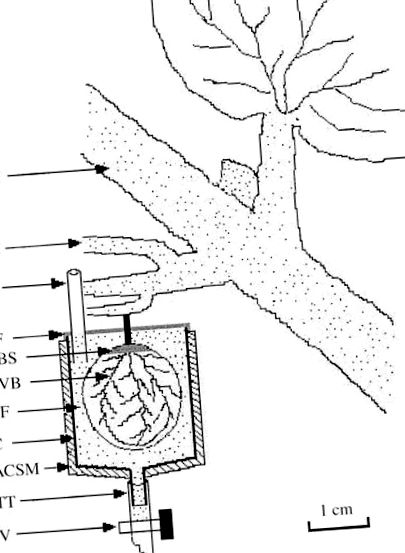
Експеримент проводився між сезоном та дозріванням. Добре розвинені первинні стебла з гронами винограду були обрані з десяти окремих лоз; одна третина ягід була відрізана для полегшення встановлення ягідної чашки. Чашечки ягід були встановлені в центрі виноградних гронок, а для ягоди була обрана ягода близько до стебла. Чашки чашки в конфігурації ягідної чашки готували шляхом вирізання 20-міліметрових поліпропіленових шприців на висоту 2 см від вихідного носика шприца; загальна ємність чашки становила 10 мл. Вихідний носик шприца був з'єднаний з тефлоновою трубкою (ТТ на рис. 1), оснащеною клапаном (V на рис. 1), щоб забезпечити спорожнення чашки. Чашку заповнювали буфером за допомогою ін'єкційної труби (ІР на рис. 1). Поверхня чашки була покрита губчастим матеріалом з алюмінієвим покриттям (ACSM на рис. 1) для захисту ягідної чашки від світла та підтримки температури 24–30 ° C.
Рис. 1. Експериментальна установка системи «ягода-чашка» для вивчення розвантаження цукрової флоеми. ACSM, матеріал губки з алюмінієвим покриттям; BF, буферний розчин; С, чашка; ДВБ, спинний судинний пучок; FPS, плодоношення первинного стебла; ГХ, грона винограду; IP, інжекційна труба; V, клапан; ПФ, Парафільм; RBS, залишок шкірки ягід; ТТ, тефлонова трубка.
Невеликий хрестоподібний розріз (довжиною 2 мм) був зроблений скальпелем на залишку стиляра, який є кінцевою точкою сполучення спинних судинних пучків. Розріз робився таким чином, щоб не пошкодити тканину пульпи. Потім шкірку ягід пінцетом та ножицями повністю очистили від залишків стиля. Для визначення буфера, який найбільше нагадує природний рН та іонну силу виноградних ягід, оцінювали різні буферні розчини. Остаточно вибраний буфер складався з 5 мМ 2 (N-морфоліно) етансульфонової кислоти (MES), 2 мМ CaCl2, 100 мМ d-манітолу та 0,2% (мас./Об.) Полівінілпіролідону (PVP), рН 5,5, інакше називається "стандартним буфером MES". Цей буферний розчин додавали у підготовлену чашку, а потім негайно очищену ягоду. Потім верхню частину ягодної чашки герметизували парафільмом (PF на рис. 1). При необхідності буферний розчин можна доливати через інжекційну трубу (IP на рис. 1). Щоб змінити буферні розчини, клапан на тефлоновій трубці відкрили і весь вміст злили у пробірку. Після закриття клапана свіжий буфер подавали через інжекційну трубу. Буферний розчин можна замінити максимум за 30 с.
Визначення експериментального часу збору
Щоб визначити, наскільки швидко буферний розчин насичувався цукром, підготували 18 ягідних чашок і розділили на шість груп по три. Буферний розчин трьох ягідних чашок у першій групі зливали у пробірки через 10 хв, а через 20, 30, 40, 50 та 60 хв для другої-шостої груп відповідно. Потім 18 зразків заморожували при –80 ° C перед аналізом.
Визначення кінетики витікання цукрів in vivo
Для визначення кінетики витікання цукру в очищеній ягоді in vivo буферний розчин кожні 20 хв замінювали свіжим буферним розчином. Кожен злитий буферний розчин становив одну пробу. Для будь-якої даної ягідної чашки максимальна кількість змін буфера становила сім, що складало в цілому сім зразків для кожної ягідної чашки протягом експериментального періоду 140 хв. Оскільки в цьому експерименті було підготовлено три чашки ягід, загальна кількість зразків становила 21. Зразки (тобто злиті буферні розчини) заморожували при –80 ° C перед аналізом. Цей експеримент повторювали тричі
Приготування та лікування інгібіторів метаболізму
Відхилення у відсотках вивантаження цукру-флоеми обчислювали, використовуючи такий вираз:
де ΔS - зміна у відсотках вивантаження флоеми цукру; S0 - кількість вивантаженої флоеми цукру протягом перших 30 хв, а Sn - кількість вивантаженої флоеми цукру після n буферних зборів.
Аналіз цукру
Зібрані зразки розморожували при кімнатній температурі (20 ° С) і доводили дистильованою водою до 10 мл. Для визначення концентрацій сахарози, глюкози та дфруктози методом ферментативного набору (Boehringer Mannheim, Дармштадт, Німеччина) за допомогою спектрофотометра використовували 50 мкл аліквоти.
Щоб простежити за зростанням ягід, ми зважили зразки 50 ягід від населення (кілька повторень). Кількість вивантаження цукрової флоеми виражали у вазі на грам свіжої ягоди. Ми не можемо зважити ягоди, що використовуються для `` чашки ягід '', тому ми виміряли їх діаметр і зважили ягоди у населення з подібним діаметром (існує кореляція між діаметром ягід і масою свіжості; R 2 = 0 · 98).
Вплив водної напруги на розвантаження цукру флоемом
РЕЗУЛЬТАТИ І ОБГОВОРЕННЯ
Експериментальна система для вивчення розвантаження цукрової флоеми у дозріванні виноградних ягід
Щоб надійно дослідити вивантаження цукру флоемою в виноградних ягодах, важливо створити експериментальну систему, яка не завдає шкоди ні флоемі, ні м’якоті. Важливо також зменшити відстань між флоемою та буферним розчином (Thorne, 1985; Ho, 1988).
У зрілих ягід шкіру можна легко видалити, оголюючи таким чином спинні судинні пучки. Тому місця вивантаження флоеми цукру легко доступні за допомогою буфера, який може модулювати потік цукру у флоемі. Крім того, незавантажені фотоасиміляти можна легко транспортувати в буферний розчин у чашці ягоди. Конструкція ягідної чашки (рис. 1) така, що операції збору та зміни буферного розчину виконуються легко і швидко.
Визначення експериментального часу збору
Накопичення цукру в буферному розчині збільшувалось протягом 50 хв, після чого розчин насичувався, про що свідчить вирівнювання кривої концентрації цукру (рис. 2). Таким чином, для отримання надійних результатів час вибору складав 20 або 30 хв залежно від індивідуального експерименту.
Рис.2. Вміст буферного цукру як функція часу відбору проб. Буферний розчин ягодної чашки насичується через 50 хв. Наведені результати є середніми значеннями (n = 3 повторюваних ягідних чашок) відтоку цукру (мкг г –1 ягоди) з очищеної ягоди в буферний розчин.
Кінетика витікання цукрів з виноградної ягоди in vivo
Було показано, що глюкоза та фруктоза були основними цукрами в розвантажувальному розчині флоеми. Раніше також було показано, що цукор, вивантажений з флоеми, накопичується у вакуолі через апопластичну систему (Gifford and Thorne, 1986; Dreier et al., 1998). У цьому дослідженні було виявлено дві різні фази у ході витоку: швидкий спад протягом перших 60 хв, який у деяких прогонах виявляв ознаки стабілізації через 60 хв (рис. 3). Перша фаза (0–60 хв) характеризується апопластичним продуванням, а друга фаза (60–160 хв) - рівновагою вмісту цукру між апопластом та буферним розчином. Кінець апопластичної продувки також супроводжувався тимчасовим збільшенням витоку цукру. Оскільки друга частина графіку (після стрілки), показана на рис. 3, представляє розвантаження флоеми щодо фотосинтезу (взаємозв'язок поглинач - джерело), то в подальших експериментах після апопластичної продувки протягом 60 хв (три зміни буфера визначали кінетику витоку), кожен через 20 хв).
Рис.3. Витік сахарози, глюкози та фруктози з очищеної ягоди протягом 160 хв. Протягом перших 60 хв (стрілка) зниження витоку цукру відповідає апопластичному продуванню. Після цього витік цукру являє собою розвантаження цукрової флоеми виноградної ягоди. Наведені результати є середніми значеннями (n = 3 повторюваних ягідних чашок) відтоку цукру (мкг г –1 ягоди) з очищеної ягоди в буферний розчин.
Вплив NaF та PCMB на цукрове розвантаження виноградної ягоди
Фторид натрію (NaF) є інгібітором фосфатази дихального транспорту електронів. Включення 7,5 м м NaF у буферний розчин суттєво гальмує вивантаження флоеми цукру у ягодах винограду (рис. 4). Ці результати також показують, що NaF може швидко діяти на флоему, щоб інгібувати вироблення енергії, і що він продовжує надавати цей інгібуючий ефект протягом 60 хв після того, як його видалили з буферного розчину MES. Ці висновки підтверджують спостереження, що розвантаження цукрової флоеми - це процес, який вимагає енергії для дозрівання виноградних ягід (Торн, 1985; Ся, 1999).
Рис.4. Вплив NaF та PCMB на розвантаження цукру у виноградних ягодах. ΔS - відхилення у відсотках вивантаження флоеми цукру. Проби відбирали між 1000 і 1300 год. Стрілки вказують, де NaF і PCMB були включені в буферний розчин. Цей графік показує, що NaF та PCMB швидко діють, гальмуючи розвантаження цукру флоемом. Показані результати є середніми значеннями (n = 3 повторюваних ягідних чашок).
PCMB - це сполука, яка модифікує цистеїнові групи. Він розчинний у ліпідах і модифікує тіолові групи як на поверхні, так і в плазматичній мембрані кореневої тканини (Wilkinson and Duncan, 1993), він раніше використовувався для інгібування ферментної активності (Wilkinson and Duncan, 1993; Wu et al., 2000 ).
Малюнок 4 показує, що PCMB 2,5 м м суттєво пригнічує розвантаження цукрової флоеми в ягоді винограду і що він продовжує надавати цей інгібуючий ефект протягом 60 хв після того, як він був вилучений з буферного розчину MES. Ці результати демонструють, що розвантаження цукру флоемом - це процес, який включає транспортер цукру та втручання ферментів (Fillon et al., 1999; Patrick and Offler, 1996). Інгібування транспортера цукру, продукованого PCMB, не було скасовано зануренням у свіжий буферний розчин MES на 60 хв.
Вплив водного стресу на розвантаження цукру флоемом
Водний стрес може впливати на швидкість фотосинтезу рослин, провідність устьиць, вміст абсцизової кислоти та осмотичний потенціал; це також може впливати на транслокацію фотоасимілятів (Rodrigues et al., 1993; Winkel and Rambal, 1993; Clifford, 1998; Flexas et al., 1998, 1999; Yakushiji, 1998; Escalona et al., 1999; Kobashi, 2000; Peterlunger et al. співавт., 2000). Під час дозрівання помірний водний стрес затримує ріст вторинного пагона, не помітно впливаючи на фотосинтетичну активність (Carbonneau and Deloire, 2001), сприяючи перерозподілу цукру в ягодах та багаторічних органах. Однак сильний водний стрес насправді може перешкоджати накопиченню цукру в виноградних ягодах. Розвантаження цукрової флоеми - це перший крок накопичення цукру в органі раковини (Торн, 1985; Опарка, 1990; Патрік, 1990, 1997). Малюнок Рисунок 5 5 показує, що ягоди виноградних лоз, які зазнали водної напруги (еквівалентно приблизно Ψb ≈ –0,5 МПа), накопичували менше цукру, ніж контрольні лози (Ψb ≈ –0,2 МПа); цей ефект спостерігався головним чином після 1300 год. Для будь-якого даного об’єму ягід концентрація цукру у винограді, який зазнає водного стресу, менша, ніж у контролі. Цей висновок узгоджується з попередніми спостереженнями, що стосуються впливу водного стресу на фотосинтез винограду (дані не наведені), і додатково демонструє придатність системи ягідних чашок для вивчення впливу факторів навколишнього середовища або хімічного гальмування на накопичення цукру в процесі дозрівання виноградних ягід.
Рис.5. Вплив водної напруги на вивантаження цукру в виноградних ягодах через 82 дні після синтезу. Водне напруження, яке застосовується до виноградної лози, перешкоджає розвантаженню цукрової флоеми в ягоді винограду протягом дня, переважно через 1300 год. у зв'язку зі значним зниженням активності фотосинтезу. Показані результати є середніми значеннями (n = 3 повторюваних ягідних чашок) відтоку цукру (мкг г –1 ягоди) з очищеної ягоди в буферний розчин.
ВИСНОВОК
Експериментальна система in vivo з ягідним чашкою є корисною методикою для вивчення розвантаження цукрової флоеми та накопичення цукру в дозріваючих виноградних ягодах. Вміст цукру в буферному розчині є реальною мірою вивантаження флоеми після 60-хвилинного апопластичного продування. Після цього буферний розчин насичується цукром лише приблизно прибл. 50 хв. Таким чином, оптимальним періодом часу між змінами буфера було прийнято 20 або 30 хв (залежно від типу експерименту). Ця експериментальна система може бути використана не тільки для вивчення механізму розвантаження цукрової флоеми, але також для вивчення впливу факторів навколишнього середовища або хімічного гальмування на накопичення цукру в дозріваючих виноградних ягодах. Показано, що розвантаження цукрової флоеми в дозрілих виноградних ягодах відбувається через апопластичну мережу, і що для цього процесу необхідний транспортер цукру, втручання ферментів та джерело енергії. В даний час ця техніка з ягідними чашками використовується для дослідження вивантаження цукру як щодо гідричного стану виноградної лози (водопостачання), так і щодо перехоплення сонячного світла (потреба у воді).
ПОДЯКИ
Автори дякують Мері Келлі (Faculté de Pharmacie, Монпельє, Франція) за допомогу з англійською мовою в цьому рукописі та за коректуру тексту. Ми також дякуємо Крістіану Бедесу за технічну допомогу у винограднику.
Додатковий матеріал
Примітки
Отримано: 31 січня 2003 р .; Повернуто на доопрацювання: 28 квітня 2003 р .; Прийнято: 10 червня 2003 р. Опубліковано в електронному вигляді: 7 серпня 2003 р
- Біомеханічне дослідження зручності завантаження та вивантаження білизни в сушарку для одягу
- Ягоди, мариновані в бальзамічному оцті Beacon Health System
- Підключення кабелів та пристроїв до модулів та ввімкнення системного шасі
- Дослідження атомно-силової мікроскопії адсорбованої вологи на частинках лактози - ScienceDirect
- Упередженість уваги до винагороди та покарання за надмірну вагу та ожиріння Дослідження TRAILS