Докази трансгенераційного метаболічного програмування у дрозофіли
Джессіка Л. Бюшер
1 кафедра педіатрії, і
Лора П. Муссельман
2 Кафедра внутрішньої медицини, Медична школа Вашингтонського університету, Сент-Луїс, Міссурі 63110, США
Крістіна А. Вільсон
1 кафедра педіатрії, і
Tieming Lang
1 кафедра педіатрії, і
Медлен Келехер
1 кафедра педіатрії, і
Томас Дж. Баранський
2 Кафедра внутрішньої медицини, Медична школа Вашингтонського університету, Сент-Луїс, Міссурі 63110, США
Дженніфер Г. Дункан
1 кафедра педіатрії, і
РЕЗЮМЕ
Світові епідеміологічні дослідження неодноразово демонстрували зв'язок між внутрішньоутробним харчовим середовищем, вагою при народженні та сприйнятливістю до захворювань дорослих, включаючи ожиріння, серцево-судинні захворювання та діабет 2 типу. Незважаючи на прогрес у модельних системах ссавців, молекулярні механізми, що лежать в основі цього явища, незрозумілі, але можуть включати такі механізми програмування, як епігенетика. Тут ми описуємо нову систему оцінки механізмів метаболічного програмування за допомогою простої, генетично відстежуваної моделі дрозофіли. Ми вивчили вплив надлишкової калорійності матері на потомство і виявили, що дієта матері з високим вмістом цукру змінює склад тіла потомства личинок протягом принаймні двох поколінь, збільшує фенотип, подібний до ожиріння, при неоптимальних (висококалорійних) умовах годування у дорослого потомства, і модифікує експресію метаболічних генів. Наші дані вказують на те, що механізми харчового програмування можуть бути дуже збереженими, і підтримують використання дрозофіли як моделі для оцінки основного генетичного та епігенетичного внеску у це явище.
ВСТУП
Такі епідеміологічні спостереження були підтверджені на моделях ссавців, проте мало відомо про молекулярні механізми, що лежать в основі цього явища (Mitchell et al., 2009; Rajia et al., 2010; Simmons et al., 2001; Tamashiro et al., 2009) . Модельовані генетично організми, такі як Drosophila melanogaster, пропонують унікальні можливості для вивчення впливу харчування на обмін речовин. Дрозофіли мають ключові метаболічні системи органів і мають багато збережених метаболічних функцій з хребетними, включаючи аналогічний інсулін, інсуліноподібний фактор росту та мішень сигнальних шляхів рапаміцину (TOR), а також регулюють циркулюючий цукор, накопичення енергії та мобілізацію енергії (Baker and Thummel, 2007; Schlegel and Stainier, 2007). Нещодавні досягнення дрозофіли дали уявлення про складний взаємозв'язок між харчовим середовищем, експресією генів та метаболізмом (Birse et al., 2010; Bujold et al., 2010; Fujikawa et al., 2009; Horner et al., 2009; Musselman et al., 2011; Ruaud et al., 2011; Sieber and Thummel, 2009). Однак не повідомляється про наслідки харчування для поколінь. Тут ми описуємо нову модель трансгенераційної дрозофіли, в якій потомство від материнських мух, що зазнали надмірної калорійності, демонструє порушений метаболічний гомеостаз, який пов'язаний із транскрипційними змінами метаболічних регуляторів.
РЕЗУЛЬТАТИ
Дієта з високим вмістом цукру викликає ожиріння у дорослих жіночих мух
Для того, щоб встановити модель дрозофіли для вивчення трансгенераційних ефектів надлишку калорій, ми спочатку вивчили вплив висококалорійної дієти на склад тіла у незайманих w 1118 жіночих мух. Протягом 24 годин після еклозії w 1118 самок-мух незайманих дрозофіл поміщали на напіввизначену їжу, яку додавали або 0,15 моль/л сахарози [контроль низького вмісту цукру (LS)], або 1 моль/л сахарози [високий рівень цукру (HS)] протягом 7 днів і згодом були обстежені на зміну складу тіла. Це напіввизначене харчове середовище було раніше описано (Backhaus et al., 1984) і спочатку було розроблено з метою оцінки харчових та метаболічних змін дрозофіли, уникаючи при цьому частої мінливості між партіями харчових продуктів, що містять патоку та кукурудзяну муку . Таким чином, дієти, які ми вибрали, використовують цю напіввизначену їжу як основу з більш ніж у шість разів більшою кількістю сахарози в дієті ГС. Показано, що дієта ГС викликає ожиріння та резистентність до інсуліну у личинок дрозофіли (Musselman et al., 2011; Pasco and Léopold, 2012). Крім того, нещодавно повідомлялося, що у дорослих мух, культивованих на їжі ГС протягом 3 тижнів, розвиваються дефекти обміну речовин та кардіоміопатія (Na et al., 2013). Однак вплив дієти ГС на мух матері, що розмножуються, не вивчався.
ПЕРЕКЛАДНИЙ ВПЛИВ
Клінічне питання
Кілька епідеміологічних досліджень пов'язують неоптимальне внутрішньоутробне живильне середовище зі схильністю до метаболічних та серцево-судинних захворювань у дорослому віці. Ця концепція виникла в роботі Девіда Баркера, що демонструє вплив недоїдання матері на ризик метаболічних захворювань у нащадків, але зараз очевидно, що ожиріння матері та діабет також схильні до ожиріння у дітей та розвитку діабету. На жаль, ожиріння матері сьогодні є надзвичайно поширеним явищем, і рівень ожиріння зростає у дітей з тривожними показниками. Постулюється, що неоптимальне допологове середовище може спричинити події перепрограмування метаболізму, які роблять потомство більш сприйнятливим до ожиріння та метаболічних захворювань (наприклад, діабет 2 типу). Розуміння механізмів, що лежать в основі цього типу програмування, дозволить нам терапевтично втручатися на попередніх етапах, щоб запобігти цим серйозним захворюванням.
Результати
Щоб зрозуміти основні механізми, що лежать в основі харчового програмування, автори встановили нову модель трансгенераційних дрозофіл, яка сприяє детальному вивченню шляхів, що впливають на змінений метаболізм. Використовуючи цю модель, вони показують, що материнська дієта з високим вмістом цукру призводить до збільшення зберігання вуглеводів, а також до зменшення зберігання холестерину у розвитку нащадків. Так само було виявлено, що дорослі нащадки накопичують підвищений рівень тригліцеридів, коли їм загрожують дієти з високим вмістом цукру. Крім того, автори демонструють, що експресія багатьох генів, що беруть участь у метаболізмі, змінюється у нащадків, матері яких харчувалися дієтою з високим вмістом цукру. Нарешті, автори спостерігали подібні зміни у нащадків другого покоління, припускаючи, що ожиріння може успадковуватися через кілька поколінь.
Наслідки та майбутні напрямки
Ці результати сильно підтверджують думку про те, що материнська дієта впливає на обмін речовин у нащадків. Нащадки дрозофіли, які харчуються з високим вмістом цукру, схильні до накопичення зайвого жиру, що вказує на те, що вони, як і люди, схильні до ожиріння. Змінена експресія метаболічних генів дає підказки щодо деяких шляхів, що беруть участь у опосередкуванні цих змін, тим самим відкриваючи шлях для подальшого дослідження потенційних кандидатів, яких можна використати для розробки нових терапевтичних стратегій. Створення простої та експериментально відстежуваної моделі мух дозволить швидко з’ясувати механізми та шляхи, що беруть участь у програмуванні обміну речовин, які потім можна було б легко перевести в системи ссавців.
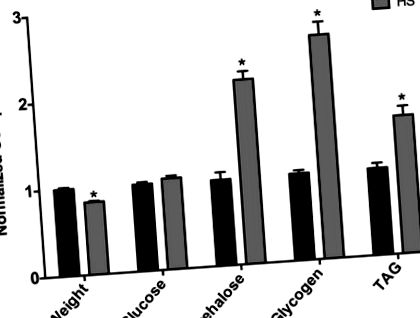
Ми виявили, що незаймані жінки, які піддавались дієті ГС протягом 7 днів у зрілому віці, важили менше, ніж у жінок, що годувались LS (рис. 1). Це зменшення ваги, ймовірно, відображає фізіологічні зміни, що призводять до збільшення захворюваності та смертності, пов’язаних з більш тривалим харчуванням за допомогою ВГ-дієти, як це раніше спостерігали лабораторії Баранського та Кагана (дані не наведені) (Na et al., 2013). Зокрема, Na et al. відзначили, що мухи, які годувались лише 3 тижні на дієті ГС, мали підвищену серцеву аритмію, а мухи, що харчувались ГС, мали загальну тривалість життя (Na et al., 2013). Таким чином, зниження ваги у незайманих самок, ймовірно, відображає ранню захворюваність, пов’язану з дієтою. Жінки, які харчувались дієтою ГС протягом 7 днів, виявляли підвищений рівень трегалози у всьому тілі, тоді як глюкоза залишалася незмінною та збільшення глікогену (рис. 1). Крім того, триацилгліцерин (TAG) помітно підвищувався у мух, що годувались HS (рис. 1), що являло собою помітне збільшення відсотка жиру в організмі. Таким чином, 7-денна дієта при ГС викликає у самки мух фенотип, подібний до ожиріння.
wL3 чоловічі нащадки материнських мух, що харчуються HS, демонструють зміну експресії генів. (A, B) qRT-ПЛР-аналіз мРНК від нащадків самців мл3 для генів, що беруть участь у метаболізмі ліпідів (CG17191, Lip3, Fas, dACC, Cpt1, dFOXO) та метаболізмі вуглеводів [CG4797 (транспортер глюкози), PyK, Eno, Pgi, Tps1, Pdk, CG15400 (глюкоза-6-фосфатаза), DHR38]. Стовпчики представляють відносний вираз ± м.д., представлений як зміна в кратному порівнянні з контрольним значенням (= 1,0) у кожному випадку. Всі дані про експресію нормалізували до мРНК α-тубуліну 84B. n = 8–10 збірних зразків; * P Рис. 4B). Експресія передбачуваного транспортера цукру, CG4797, була зменшена у нащадків від материнських мух, яких годували HS. Гліколітичні гени також виявляли диференційну експресію у порівнянні з контрольними тваринами: CG17654 [енолаза (Eno)] була регульована, тоді як CG8251 [фосфоглюкозна ізомераза (Pgi)] та CG7070 [піруваткіназа (PyK)] були знижені. Tps1 [трегалоза-6-фосфатсинтаза 1 (CG4104)], яка бере участь у перетворенні глюкози в трегалозу, був незначно підвищений, але це не було статистично значущим. Нарешті, оцінка експресії генів для ефекторних ферментів глюконеогенезу показала тенденцію до регуляції CG15400 (глюкозо-6-фосфатази), яка каталізує завершальний етап у глюконеогенезі та глікогенолізі. Рівні CG10924 [передбачувана активність фосфоенолпіруват-карбоксикінази (PEPCK)] та CG5165 [фосфоглюкомутаза (PGM-1)] суттєво не відрізнялись у порівнянні з контролем, але експресія обох мала незначно знижена. Ми також оцінили інші ліпази (CG5932, краммер), інсуліноподібні пептиди дрозофіли (dILP) та гени Німана-Піка (NPC). Тільки NPC1b прагнув до зменшення личинок HS (P = 0,08).
Потомство личинок другого покоління має суттєві зміни у складі тіла після дієти ГС матері. wL3 загальний склад тіла чоловічих нащадків покоління F2 (A – C) [(A) глюкоза, (B) трегалоза, (C) TAG] та жінок (D – F) [(D) глюкоза, (E) трегалоза, (F ) TAG]. Етикетки на осі х позначають материнську дієту-F1 личинки та дієти дорослих-F2 личинку. Стовпчики представляють середній склад тіла, нормалізований до ваги і представлений у порівнянні з контролем (LS-LS-LS = 1,0) ± с.м .; n = 20–30 збірних зразків; * P Рис. 7). Зокрема, ми виявили, що у нащадків wL3 спостерігалося збільшення глюкози та трегалози у гемолімфі у всьому тілі, а також незначне зниження рівня глікогену та холестерину. Підвищений рівень глюкози та трегалози у всьому тілі зберігався у нащадків покоління F2. Незважаючи на відсутність дефектів TAG у популяції F1 wL3, потомство F2 wL3 також продемонструвало зміни у складі TAG. Крім того, на додаток до збільшення зберігання глікогену в умовах культури LS, дорослі чоловіки, що породжують материнських мух, що харчуються ВС, мабуть, схильні до ожиріння, коли їм загрожує дієта ГС. Зміни у складі як личинок, так і дорослого потомства також супроводжувалися зміною експресії генів метаболічних регуляторів. У сукупності ця робота підтримує використання дрозофіли як нової моделі для вивчення трансгенераційних ефектів харчування та закладає основу для подальших досліджень молекулярних механізмів, що лежать в основі метаболічного програмування.
Короткий зміст експериментальної конструкції та результатів. Самки-мухи незайманих саджали на дієту LS або HS протягом 7 днів, а потім схрещували з чоловічими мухами дикого типу (зі запасу їжі). Все потомство розвивалося на їжі LS. Потомство F1 обстежували як на стадії личинки, так і на дорослому, і вони мали змінений склад тіла та експресію метаболічних генів-мішеней. Нащадків незайманих жінок F1 збирали та схрещували з самцями, яких годували кормами. І у самців, і у самок личинок F2 відбулося зміна складу тіла. FAO, окислення жирних кислот.
Інші моделі тварин мають обмежені дані щодо впливу ожиріння матері або діабету на ранніх стадіях розвитку. Одне дослідження споживання материнської фруктози у вагітних щурів було пов’язане з підвищенням рівня глюкози та фруктози в крові у молодих жіночих нащадків (Vickers et al., 2011). Також існував зв'язок між споживанням материнської фруктози та зміною рівня лептину у нащадків, що свідчить про можливі нейроендокринні наслідки дієти з високим вмістом фруктози у матері. Додаткові дані на мишах вказують, що вплив транс-жирних кислот під час вагітності та лактації змінює гомеостаз глюкози та передачу сигналів інсуліну у новонароджених цуценят (Kavanagh et al., 2010). У людини існує безліч даних про те, що ожиріння матері пов’язане з ожирінням у потомства (Boerschmann et al., 2010; Fraser et al., 2010; Hochner et al., 2012), але ранні зміни в розвитку не вивчені. Наша модель дрозофіли дозволяє досліджувати метаболічні зміни в різних точках розвитку, і, отже, представляє можливість для відкриття механізмів, що змінюють метаболічні шляхи раннього розвитку, забезпечуючи основу для майбутніх цілеспрямованих досліджень в системах ссавців. Подальші дослідження можуть зосередитись на сигналізації інсуліну, а також на передачі сигналів TOR, які обидва були залучені до моделей висококалорійного годування у мух (Birse et al., 2010).
Наші дані підтверджують використання дрозофіли як нової моделі для вивчення трансгенераційних ефектів харчування та закладає основу для подальших досліджень молекулярних механізмів, що лежать в основі метаболічного програмування. Дійсно, змінена експресія генів у нащадків материнських мух, яких годують ВС, разом зі зміненим складом тіла у поколінні F2 дуже вказує на метаболічне програмування. Використовуючи генетично вивідну дрозофілу як модель метаболічного програмування, ми передбачаємо, що дослідження ролі специфічних метаболічних шляхів та регулюючої ролі епігенетичних змін у декількох поколіннях призведе до швидкого з'ясування механізмів програмування таким чином, що неможливо у вищих організмів.
МАТЕРІАЛИ І МЕТОДИ
Літати запаси
w 1118 Запаси дрозофіли були отримані з Блумінгтонського центру запасів дрозофіли та підтримувались при температурі 25 ° C на кормі для мух на основі патоки. Жіночих мух-дів збирали із запасів і поміщали протягом 24 годин після еклозії на їжу LS або HS протягом 7 днів (рис. 7). Харчовий вміст дієт LS та HS вказаний у таблиці 1. Вимірювання ваги та складу всього тіла були зібрані в групи з шести личинок та груп з восьми мух.
- Повна стаття Активи для забезпечення харчування Вплив на програмування, засноване на активах, в Нігері
- Вплив вечірньої їжі з квасолі на маркери метаболічного ризику та регулюючі апетит гормони на
- Вплив споживання цибулі на пару (ONIRO) на жир у організмі та метаболічні профілі при надмірній вазі
- Вплив відмови від куріння на збільшення ваги, швидкість метаболізму, споживання калорій та ліпіди в крові
- Дієтичні схеми та ризик метаболічного синдрому у корейських жінок