Дієта для новонароджених впливає на біоенергетику мітохондрій печінки у поросят, яких годують сумішами або жіночим молоком
Анотація
Передумови
Дієта для новонароджених впливає на багато фізіологічних систем і може змінити ризик розвитку метаболічних захворювань та ожиріння в подальшому житті. Менш добре вивчений вплив постнатальної дієти (наприклад, порівняння годування грудним молоком (ВМ) або молочною сумішшю) на біоенергетику мітохондрій. Такі наслідки можуть бути найглибшими у тканинах спленхічних клітин, які мали б ранній вплив на дієтичні фактори або фактори, що походять від кишечника.
Методи
Для вирішення цього питання ми вимірювали фенотипи біоенергетики мітохондрій клубової кістки та печінки у поросят чоловічої статі, які годувались HM або MF з 2-го по 21-й день. Тканину клубової кістки та печінки обробляли для мітохондріального дихання (лише субстрат [піруват, малат, глутамат], субстрат + АДФ та пост-олігоміцин, що витікає з протону; вимірюється методами Оробороса), мітохондріальна ДНК (mtDNA) та метаболічно відповідна експресія генів аналізи.
Результати
Жодних відмінностей між групами дієт не спостерігалося в показниках міохондріальної біоенергетики в клубовій тканині. На відміну від цього, залежність від ADP печінкової комплексу I-зв’язаної OXPHOS та ємності OXPHOS-комплексу I + II була значно вищою у тварин із МФ порівняно з поросятами, які годували НМ. Цікаво, що вміст транскриптів p53, Trap1 та Pparβ був вищим у MF-годуваних порівняно з HM-поросятами в печінці. Копії мітохондріальних ДНК (нормалізовані до ядерної ДНК) були подібними всередині тканини незалежно від постнатальної дієти і були
У 2–3 рази вище у тканинах печінки та клубової кишки.
Висновок
Хоча механізми залишаються ідентифікованими, дані вказують на те, що дієта для новонароджених може суттєво впливати на фенотипи біоенергетики мітохондрій печінки, навіть за відсутності зміни чисельності мтДНК. Оскільки пермеабілізоване мітохондріальне дихання печінки було посилене у поросят з МФ лише у присутності АДФ, це свідчить про те, що годування сумішшю призвело до більшого обороту АТФ. Особливі механізми та сигнали, пов’язані з різницею в біоенергетиці печінки, пов’язаною з дієтою новонароджених, ще потребують з'ясування.
Передумови
Доведено, що грудне вигодовування позитивно впливає на фізіологічні системи організму, включаючи імунну систему та метаболічно важливі тканини, такі як печінка, жирова клітина та когнітивні центри мозку [1, 2]. Недавні дослідження показали, що у немовлят, які годуються сумішшю з молока (ММ), швидше набирають вагу протягом перших тижнів життя порівняно з немовлятами, що перебувають на грудному вигодовуванні, і, схоже, це пов’язано із збільшенням ваги в подальшому житті [3,4,5]. Склад поживних речовин жіночого молока (ВМ) у порівнянні з молочними сумішами може зіграти значну роль у спостережуваних метаболічних результатах та зафіксованих різницях у здоров’ї при порівнянні цих двох новонароджених дієт [6,7,8,9,10,11]. Мітохондріальна функція та енергетичний гомеостаз впливають на всі ці системи, але роль дитячого харчування та програмування клітинної біоенергетики залишається в основному невивченою.
Зростає оцінка впливу дієти раннього віку на "програмування" фізіологічних систем з потенційними метаболічними наслідками в дитинстві чи дорослому віці. Більш важливим є те, що зростає консенсус щодо того, що харчові «ефекти програмування» зберігаються та впливають на ризик алергії, астми, ожиріння, діабету та серцево-судинних захворювань і в подальшому житті [1, 19,20,21,22,23,24]. Ми висунули гіпотезу, що дієта новонароджених (НМ та МФ) може різним чином впливати на дихання мітохондрій у тонкій кишці (клубовій кишці) та печінці. Для розв’язання нашої гіпотези ми використовували поросят, які годувались HM та MF в контрольованих експериментальних умовах, через нестабільну мінливість, пов’язану з свинями, що годуються свиноматками (наприклад, житло на фермі, контакт матері зі шкірою та годування груддю). Тканини відбирали у поросят, яких годували HM та MF, між постнатальним днем 2–21, щоб визначити субстратне та АДФ-дихання, а також номер копії ДНК мітохондрій. Наскільки нам відомо, це перше дослідження, яке характеризує вплив парадигм постнатального годування на функцію тканинних мітохондрій на більшій моделі тварин.
Методи
Вивчати дизайн
Обробка тканин для функціонального аналізу мітохондрій
Тварин голодували протягом 8 год до забору тканин. Для оцінки функції мітохондрій випадково вибрали підмножину поросят (HM, n = 8–11; MF, n = 8–11; див. окремі цифри). Ми відміряли 50 см від дистального кінця тонкої кишки, і на цьому знаку тканину вирізали як проксимальний зразок 15 см. Зразки клубової кишки та печінки для аналізу функції мітохондрій обробляли відразу після збору. Частина клубової кишки і печінки (~ 40 мг) негайно занурювали в крижаний буфер для консервації (BIOPS), що містить 10 мМ буфер Ca-EGTA, 20 мМ імідазолу, 20 мМ таурину, 50 мМ K-MES, 0,5 мМ дитиотрейтолу, 6,56 мМ MgCl2, 5,77 мМ АТФ та 15 мМ креатинфосфату (рН 7,1) [26] для аналізу мітохондріального дихання протягом 1–2 год збору тканин.
Зразки клубової кістки та печінки подрібнювали (0,1–0,2 мм) за допомогою дрібних і гострих щипців, перебуваючи на льоду, та хімічно проникали протягом 20 хв у буфер BIOPS, що містив 50 мкг/мл сапоніну при 4 ° C [27,28,29,30]. Зразки переносили в 2 мл буфера MIR05 (0,5 мМ EGTA, 3 мМ MgCl2, 60 мМ K-лактобіонату, 20 мМ таурину, 10 мМ KH2PO4, 20 мМ HEPES та 110 мМ сахарози та 1 мг/мл незамінних жирних кислот- вільний бичачий сироватковий альбумін (Sigma Aldrich, Сент-Луїс, Міссурі, США; партія SLBF5061V) з подальшим 10-хвилинним перемішуванням на шейкері для змивання решти сапоніну. Менше 10 мг клубової кишки та близько 3 мг печінки з вологою масою переносили в камеру респірометра Oxygraph-2 k (O2k) (Oroboros Instruments, Інсбрук, Австрія), що містить 2 мл буфера MIR05 [28, 31, 32].
Респірометрія з високою роздільною здатністю (HRR)
Перед кожним експериментом проводили калібрування фону на кожному поліграфічному датчику кисню O2k (POS). Це калібрування проводили в буфері MIR05 при насиченні повітрям. Нульові калібрування кисню та інструментальний фон проводили через рівні проміжки часу протягом усього періоду збору даних (∼ 12 місяців), використовуючи титрування дитионіту. Це забезпечило прийнятний інструментальний фон POS та стабільність у часі [26]. Температуру підтримували на рівні 37 ± 0,01 ° C за допомогою електронного Пельтьє під час усіх експериментів з респіметрією високої роздільної здатності (HRR). Концентрацію O2 в буфері MIR05 реєстрували з інтервалами від 2 до 4 с, з яких розраховували потоки O2 в пікомолярному діапазоні (DatLab версія 6; Oroboros Instruments, Інсбрук, Австрія) [31]. Після того, як зразки тканини були поміщені в камери O2k, була створена газова фаза. Близько 1 мл 99% O2 вводили в кожну камеру O2k, і контролювали рівновагу газової фази та концентрації OIR MIR05, поки в буфері MIR05 не було досягнуто концентрації O2 ∼ 400 мкМ; Вимірювання потоку O2 зазвичай проводили, коли концентрації O2 знаходились в межах 200-400 мкМ, щоб мінімізувати будь-які артефакти залежності від O2 та уникнути потенційних обмежень дифузії кисню в прониклих зразках тканин.
Номер копії ДНК мітохондрій
ДНК була вилучена з
25 мг замороженої тканини клубової кишки за допомогою набору швидких ДНК тканин QIAamp (QIAGEN, Germantown, MD) відповідно до протоколу виробника. Приблизно 500 мг печінки гомогенізували в PBS (Gibco, Thermo Fisher). ДНК витягували з еквівалента
25 мг печінки за допомогою набору швидких ДНК тканин QIAamp. Стандарти ДНК для кожної мішені були сформовані за допомогою праймерів, наведених у таблиці 2, для ампліфікації мітохондріальних генів ND1 (519 пар основ (bp) амплікон) і Cox1 (477 bp амплікон), а також ядерного гена β-актину (496 bp амплікон) за допомогою GoTaq Green Master Mix (Promega, Madison, WI). Продукти ПЛР розділяли на 1% агарозному гелі, а смужки ампліконів вирізали та екстрагували за допомогою набору для екстракції гелю QIAquick (QIAGEN, Germantown, MD). Концентрації визначали за допомогою спектрофотометра NanoDrop 1000 (NanoDrop, Wilmington, DE) та флуорометра Qubit 2.0, використовуючи dsDNA HS Assay Kit (Invitrogen). Кількість копії на мкл ДНК визначали за допомогою рівняння:
кількість копій/мкл = (кількість (нг/мкл) * 6,022 × 10 23 кількість/моль)/(довжина (bp) * 1 × 10 9 нг/g * 650 г/моль bp).
Стандарти серійно розводили в 10 разів від 1 X 10 8 копій/мкл до 1 X 10 3 копій/мкл, щоб побудувати 6-бальну стандартну криву. Для ПЛР у режимі реального часу нові праймери, розміщені в ампліконі для ND1, Cox1 та β-актину (табл. 2), були розроблені за допомогою Інструменту інтегрованої технології ДНК (IDT) PrimerQuest Tool (www.idtdna.com/Primerquest/Home/Index). ДНК (200 пг) використовували в реакції ПЛР 10 мкл, використовуючи Fast SYBR Green Master Mix (Applied Biosystems) на ПЛР-системі ViiA 7 у реальному часі (Applied Biosystems). Кількість копій мтДНК розраховували за стандартними кривими та нормалізували, використовуючи велику кількість ядерного гена β-актину. Всі наявні зразки поросят були використані для визначення номера копії ДНК мітохондрій (HM, n = 11; MF, n = 11 на тканину).
Експресія гена
РНК витягували з
30 мг замороженої тканини клубової кишки за допомогою RNeasy Plus Mini Kit (Qiagen) згідно з протоколом виробника. Для РНК печінки,
100 мг замороженої печінки гомогенізували за допомогою miRNeasy Mini Kit (Qiagen) та гомогенату, еквівалентно
30 мг печінки з кожного зразка використовували для екстракції РНК. Концентрацію визначали з використанням поглинання УФ. Один мкг загальної РНК був використаний для створення кДНК за допомогою набору синтезу кДНК iScript (Bio-Rad, Hercules, CA) відповідно до протоколу виробника. кДНК розбавляли і 10 нг кДНК використовували в реакції ПЛР, використовуючи Fast SYBR Green Master Mix (Applied Biosystems) на ПЛР-системі ViiA 7 у реальному часі (Applied Biosystems). Стандартна крива була сформована шляхом об'єднання нерозведеної кДНК з різних процедур для створення основного пулу. Головну суміш кДНК послідовно розводили в 5 разів у цілому чотири рази для довільної п'ятибальної стандартної кривої. Експресія РНК нормалізувалась для клубової кишки, використовуючи середнє геометричне з трьох опорних РНК (Rps16, Rpl27 та 18S), а для печінки - із середнім геометричним значенням двох (Rps16 та 18S) еталонних РНК, які не були змінені лікуванням. Всі наявні зразки поросят були використані для визначення експресії мітохондріального гена (HM, n = 11; MF, n = 11). Один зразок печінки поросята, що годували МФ, був вилучений через низьку якість РНК (RIN
6.5). Праймери були розроблені з використанням IDT’s PrimerQuest і перелічені в таблиці 3.
Статистичний аналіз
Всі дані представлені як середні значення ± SEM. Дані аналізували двостороннім t-критерієм та стор
Результати
Фенотипи мітохондріального дихання
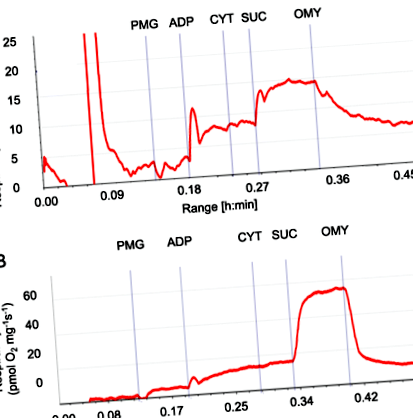
Сліди потоку кисню з використанням проникних зразків клубової кишки та печінки, отриманих від 21-денного порося, що годується НМ, показані на рис. 1. Цей протокол забезпечує оцінку „витоку дихання” (L), що підтримується в основному потоком електронів через комплекс I дихального ланцюга після додавання пірувату, малату та глутамату (ПМГ)-L). Протокол також забезпечує пропускну здатність OXPHOS (P) після ADP додається слідом за піруватом, малатом та глутаматом (PMG-P); P являє собою максимальну здатність комплексу I-зв’язаного ADP-зв’язаного OXPHOS через N-шлях, передача електрона відбувається комплексом I. Згодом додають сукцинат (SUC) для індукції складного II-зв’язаного дихання. Ми визначили внесок потоку електронів як від складного дихання I, так і від II, представляючи максимальну здатність до ADX-зв’язаної OXPHOS, яку вимірювали в клубовій кишці. Далі було додано OMY для оцінки дихання на витоки, коли були надані субстрати та АДФ, але АТФ-синтаза інгібувалась, вимірюючи витік протонів із комплексів I та II.
Ілюстративні дихальні потоки пермеабілізованої тканини клубової кишки у поросят віком 21 день. a клубової кишки і b вихідний слід зразка печінки з оксиграфа Oroboros показує відповіді на протокол титрування субстрат-інгібітор, як описано в розділі результатів
Ми оцінили вплив дієти новонароджених на дихання мітохондрій у пермеабілізованій клубовій кишці на 21 день (рис. 2а). Суттєвих відмінностей у пермеабілізованих експлантатах клубової кишки за всіх досліджуваних параметрів не спостерігалось: витікання дихальних шляхів ПМГ, ємність OXPHOS, пов’язана з комплексом I, виміряна після додавання ADP, здатність OXPHOS, пов’язана з комплексом I та II (CI + II P), виміряні після додавання сукцинату (SUC) та витоку, пов'язаного комплексом I та II (OMY). У печінці (рис. 2b), більша ємність комплексу I-пов'язаного OXPHOS та вища здатність комплексу I- та II-пов'язаного OXPHOS спостерігалися у поросят, що годували МФ, порівняно з поросятами, що годувались НМ.
Мітохондріальна ДНК
Номер копії мітохондріальної ДНК, нормалізований до числа копій ядерної ДНК, не суттєво відрізнявся на 21 день між групами дієти HM та MF в клубовій кишці або печінці (рис. 3). Примітно, що мтДНК була
У 2–3 рази вище у печінці порівняно з клубовою кишкою.
Номер копії мітохондріальної ДНК (mtDNA) у 21-денній клубовій кишці поросята та печінки. a День 21 мтДНК (n = 11/група дієти) клубової кишки та b день 21 мтДНК (n = 11/група дієти) печінки. Значення mtDNA нормалізуються до гена-мішені ядерної ДНК бета-актину. Дані представлені як середнє значення ± SEM. Дані аналізували двостороннім t-тестом, щоб визначити значимість між групами дієти. HM - Людське молоко; MF - формула на основі коров’ячого молока
Експресія відібраних генів, що мають відношення до метаболізму та біоенергетики мітохондрій
Ми вимірювали експресію генів для окремих транскриптів, що беруть участь у функції мітохондрій та метаболізмі з клубової кишки та печінки. У клубовій кишці не було помічено суттєвих відмінностей між групами дієт щодо убіхінол-цитохрому С-редуктази (Uqcr10), активованого пероксизомом проліфератором гамма-коактиватора 1-альфа (Pgc1α), цитохрому С (Cycs), сімейства білків теплового шоку A, Рясність транскрипції члена 9 (Hspa9), p53, ядерного дихального фактора 1 (Nrf1), асоційованого з рецептором TNF білка 1 (Trap1) та транскрипції мітохондрій фактора транскрипції A на день 21 (рис. 4а). Цікаво, що експресія активованого проліфератором клубової кишки бета (Pparβ) була значно нижчою у групі MF на 21 день щодо групи HM, тоді як експресія білка (Sco2) цитохрому С була значно вищою (рис. 4а). У печінці вміст транскриптів p53, Trap1 та Pparβ був вищим у MF-годуваних порівняно з HM-поросятами (рис. 4b).
Обговорення
Сучасне доказове дослідження, яке зосереджується на клубовій кишці та тканинах печінки, виявило нові висновки щодо дієти немовлят та функції мітохондрій тканин, і припускає, що окремі аспекти біоенергетики печінки змінюються неонатальною дієтою.
Висновок
Наші дані демонструють, що дієта новонароджених впливає на фенотипи біоенергетики мітохондрій печінки. Крім того, у присутності АДФ у дитинчат МФ у поросят було посилене дихання порівняно з поросятами, які годувались НМ, що свідчить про те, що годування сумішшю призвело до більш високого вродженого обороту АТФ у печінці. Потрібні майбутні дослідження, щоб зрозуміти, як виникають пов'язані з дієтою відмінності в диханні мітохондріальної тканини кишечника та чи є потенційні довгострокові наслідки щодо енергетичного гомеостазу, окисного стресу та інших результатів. Очевидно, що для оцінки цієї робочої моделі впливу дієти новонароджених на функцію мітохондрій потрібно провести більше роботи. Залишається визначити конкретні сигнали, отримані з дієти або мікробів, та/або сигнали господаря, які регулюють діяльність мітохондрій (та їх часовий зв’язок з періодом новонародженості), а також конкретні впливі на кишечник. Якщо вплив дієти для немовлят на біоенергетики, описані в цьому документі, рекапітулюється в тканинах людини, це матиме глибокі наслідки з точки зору розуміння фундаментальних молекулярних подій, що відрізняють фізіологічні реакції на штучне вигодовування та годування груддю.
Наявність даних та матеріалів
Усі згенеровані або проаналізовані дані включені до статті. Набори даних, використані та/або проаналізовані під час поточного дослідження, доступні у відповідного автора на обґрунтований запит.
- Рандомізоване дослідження ексклюзивного харчування на грудному молоці порівняно з недоношеними дієтами на надзвичайно недоношених дітях
- Дієта з обмеженим білком змінює концентрацію глікопротеїдів плазматичної мембрани в печінці щурів
- ПЛУН ПРО PURINA True Nature Natural Chicken; Консервований котячий корм для кошенят без печінки без зерна, 3 унції
- Royal Canin Veterinary Diet Calm Formula Суха їжа для собак - вдячний вихованець
- Сухий корм для котів Royal Canin Veterinary Diet Calm Formula 4