ДЕГРАДАЦІЯ ПОЛІАКРИЛОВОЇ КИСЛОТИ РЕАГЕНТОМ ФЕНТОНУ
J. Chil. Хім. Soc, 52, N ° 4 (2007), сторінки: 1314-1317
ДЕГРАДАЦІЯ ПОЛІАКРИЛОВОЇ КИСЛОТИ РЕАГЕНТОМ ФЕНТОНА
AÍDA NEIRA 1, MIGUEL TARRAGA 2 І ROSA CATALAN 2
1 Facultad de Ciencias, Університет дель Біо-Біо, Авда. Collao 1202, Консепсьйон, Чилі.
2 Facultad de Ciencias Químicas, Universidad de Concepción, Casilla 160-C, Concepción, Чилі
Поліакрилова кислота (ПАА) розкладається у водному середовищі за допомогою реагенту Фентона. При тривалому часі реакції, 17 годин при 60 ° C, полімер акрилової кислоти зазнає декарбоксилювання реагентом Фентона. В кінці процесу деградації полімерний продукт фізично змінився, перетворившись на аморфний гладкий матеріал. Він втратив початкову кристалічність.
Дані DSC вказують на деградацію полімеру із втратою маси летких продуктів як наслідок декарбоксилювання. Макрорадіальне утворення, яке експериментує з перехрещуванням реакцій, утворюючи більш стійку структуру, про це свідчить менший відсоток втрати ваги.
У той же час PAA з реагентом Фентона через 5 та 17 годин представляє екзотерму при 418 ° C та 416 ° C, відповідно. Це свідчить про деградацію летких продуктів та макроструктуру пухкого полімеру.
Ключові слова: Аналіз FTIR, Теплова поведінка, Фентон, Поліакрилова кислота.
ВСТУП
Радикальна полімеризація - один із найпоширеніших методів отримання акрилових полімерів 1-3. Синтез суперпоглиначів з акрилових мономерів виконується за допомогою радикальних ініціаторів, таких як амоній-персульфат, перманганат калію, реагент Фентона серед інших типів 4,5. Хімія Фентона покликана окислювати органічні субстрати залізом (II) та перекисом водню. У 1894 р. Була опублікована стаття 6 з окисленням винної кислоти перекисом водню у присутності Заліза (II). Механізм реакції - це ланцюговий механізм, в якому залізо (II) відновлюється. У 1999 р. Kremer 7 опублікував нове дослідження реакції іону заліза із перекисом водню. Це історія про механізм окислення заліза (II) та заліза (III) перекисом водню. Механізм Кремера із надлишком заліза (II), виділення кисню незначне. При перевищенні перекису водню реакція з Fe0 2+ викликає виділення кисню на початкових стадіях. Існує ймовірність того, що механізм заліза (II) з перекисом водню взагалі не включає вільних радикалів.
У 1932 р. Брей і Горін 8 з'єднали реакції Fe (II) і Fe (III). Вони запропонували виділення кисню з перевищенням перекису водню. Таким чином, вони запропонували, щоб іони заліза та ферилу приєднувались до перекису водню, але не до іонів заліза. Цей механізм пояснює розкладання перекису водню під час дуже швидкого окислення Fe (II) до Fe (III). Таким чином, суперечка триває з іншими 9,10. З метою пояснення ланцюгового механізму вільнорадикальних процесів розкладу перекису водню, що каталізується залізом (III), були опубліковані експериментальні результати. Кремер [11] надав додаткові аргументи про те, що гідроксильні радикали не важливі в хімії Фентона. Сополімеризація шляхом прищеплення акрилових мономерів до різноманітних природних та синтетичних полімерів, таких як целюлоза, бавовна та крохмаль, використовує згадані раніше радикальні ініціатори 12-13. Однак при дослідженні процесів полімеризації мало розглядалося питання деградації полімеру в основі реакції. Поліакрилова кислота (ПАА) є одним із полімерів, що найчастіше використовується для зміни властивостей природних полімерів, і ця макромолекула відчуває термічну та окислювальну деградацію 2 при тривалих реакційних процесах та високих температурах 14-16 .
J. Dong та співавт. 20 повідомляють про температурно-залежні зміни для смуг розтягування C = 0, пов'язаних із групою COOH полі (акрилової кислоти), в діапазоні 40 - 140 ° C. З підвищенням температури призводить до зменшення інтенсивності смуга поглинання, C = 0 зв'язок та інші. Ефект температури в ІК-області нижче 1500, напр. Також повідомляється про смуги 1451, 1248, 1178 та 902 cnr 1.
Для вивчення дії реагенту Фентона на ПАА реакцію проводили в умовах щеплення полімеризації акрилової кислоти до целюлозного волокна і отримували продукти реакції, які аналізували в різний час реакції водного розчину ПАА для умов рН, Fe +2 і H202, використовуваний при прищепленні його до природного полімеру.
ЕКСПЕРИМЕНТАЛЬНА
Приготування розчинів поліакрилової кислоти. Поліакрилова кислота (ПАК), яка використовується для приготування розчинів, має 1,250 кдалтон і aTg = 106 ° C. Приготовані водні розчини мають 10 мМ у Fe (II), 20 мМ у перекисі водню, рН = 4,0 при 70 ° С і при різній реакції разів. Продукти отримували навалом в атмосфері азоту.
Зразки поміщали при 105 ° С на 24 години. Після того, як їх помістили у вакуумну піч при температурі 40 ° C принаймні на один тиждень для видалення залишкової води, і зберігали у вакуумі перед спектральними вимірами.
Інфрачервона спектроскопія. Інфрачервоні спектри отримували Nicolet Magna 550. Порошки полімеру готували в гранулах KBr.
Термогравіметричний аналіз. Термічні вимірювання проводили за допомогою термобалансу Polymer Laboratories STA 625 та диференціального скануючого калориметра.
Електронна мікроскопія. Морфологію полімерів вивчали за допомогою інструменту SEM, AUTOSCAN U-1. Зразки попередньо обробляли золотом.
РЕЗУЛЬТАТИ І ОБГОВОРЕННЯ
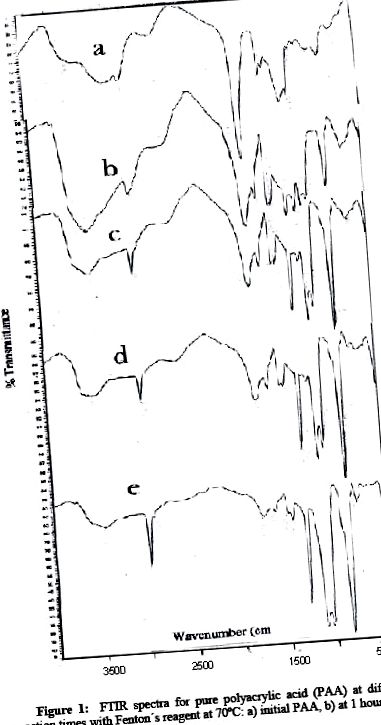
На фіг.1 представлена композиція інфрачервоного спектру при різному часі реакції для PAA. Як можна спостерігати в ІЧ-спектрах, середні та слабкі смуги PAA для 1714, 2960, 1260 та 804 v (см -1) змінюються під час тривалого часу реакції. Смуга v (см -1) 1715 см -1, характерна для карбонових груп, значно зменшується через 5 годин реакції, повністю зникаючи через 17 годин. Крім того, характерна для цієї функціональної групи широка смуга водневого зв’язку з гідроксилом при 3450 см -1 в помітно зменшується. Однак смуги, що відносяться до розтягування C-H (C sp 3) 2960 v (см 1), C = O від v (см -1) 1260 та коливання метилену при v (cm 1) 840, значно збільшуються. Обидві ситуації вказують на процес деградації PAA, який експериментально відповідає продукту меншої полярності та розчинності у водному середовищі, що вказує на те, що реагент Фентона не тільки утворює в цьому середовищі радикали як ініціатор реакції прищеплення, але також накопичується як декарбоксилант у бажаному продукті.
У таблиці 1 представлені термогравіметричні дані PAA та отримані продукти за різного часу реакції. Як можна спостерігати в таблиці 1, гомополімер та продукти реакції мають стадію процесу деградації. Спочатку ендотермічний процес, за яким слідує екзотермічний процес. Чітко видно, що теплові компоненти та стабільність продуктів реакції відрізняються від температур вихідних полімерів. При 500 ° С 85% ПАА розкладається, тоді як лише 75% продуктів реакції розкладається, що вказує на те, що продукти реакції з реагентом Фентона мають більшу термостійкість, ніж вихідний полімер.
На малюнку 2 представлена послідовність мікрофотографій цього процесу, з чого можна зробити висновок, що морфологія полімерного матеріалу суттєво змінилася за тривалий час реакції, ставши аморфним, гладким матеріалом, який втратив кристалічну характеристику вихідного полімеру ПАА. Ці дані погоджуються з втратою функціональних можливостей, показаних у послідовності інфрачервоних спектрів.
На малюнку 3 представлені чисті та кристалічні мікрофотографії PAA
Було обговорено багато механізмів деградації вуглеводів 21. При окисленні амілопектину кукурудзяного крохмалю деполімеризація супроводжувалася швидким і значним окисленням кінцевих одиниць з утворенням мурашиної кислоти, щавлевої кислоти та діоксиду вуглецю. Цей результат підтвердив теорію, що H202 переважно атакує відновні кінцеві одиниці та вже окислені ділянки, наприклад оксогрупи. Целюлоза поводиться подібним чином, і деполімеризація переходить до деградації до С02, мурашиної кислоти, щавлевої кислоти та D-арабінової кислоти 22 .
Деградація йоржа 23 окислення солі альдонової кислоти до наступної нижчої альдози та COr Деградація іржі, як правило, відома скороченням вуглецевого ланцюга цукрів. Процедура проста, розчинна сіль альдонової кислоти нагрівається H202 у присутності Fe (Ac) 3 приблизно при 40 ° C. Використання іонообмінних смол значно покращило це і робить метод широко використовуваним. У літературі існує суттєва розбіжність щодо температури та природи утворення ангідридів у ПАА, полі (акрилова кислота) 24-26. Дж. Дж. Маурер та співавт. 1 при тепловій характеристиці полі (акрилової кислоти) максимальне виділення води внаслідок утворення ангідриду та виділення діоксиду вуглецю внаслідок розкладання ангідриду відбулося при 170 та 230 ° C відповідно.
Реакція деградації PAA з реагентом Фентона узгоджується з іншими окислювальними механізмами, що спостерігаються в процесах деградації карбонових кислот за допомогою радикального механізму, відомого як деградація Раффа. З доступних методів або укорочення вуглецевого ланцюга цукрів 27, деградація Йоржа є одним із найбільш доцільних методів 28-29 . A розчинна сіль альдонової кислоти обробляється перекисом водню у присутності ацетату заліза (III) приблизно при 40 ° C. D-глюконат кальцію дає 25% виходу D-арабінози. За відсутності перекису водню, потрапляння сонячного світла також утворює D-арабінозу 30. Йорж зауважив, що сіль заліза, що залишилася після видалення D-арабінози, мала значну знижувальну силу, пов'язану з присутністю гексулозонових кислот 31. Kuen 32 показав, що гази з фентонної реагентно-вуглеводної системи майже повністю складаються з вуглекислого газу. Експерименти Стірлінга 33 з D-глюкозою та реагентом Фентона підтримують ідею повільної взаємодії іонів заліза і продукту, навіть після повної втрати вихідної пероксиду. Гілберт та ін. огляд 34 фоторедукція ß-цетокарбонових кислот. Вони пропонують комплекс між групою карбокси-Fe (III). Цей комплекс стабілізується кислотним декарбоксилюванням з отриманням Fe (II).
Потім, на першій стадії, іони Fe +3 будуть одержуватися окисленням реагенту Фентона в присутності H202 в кислому середовищі, яке утворює внутрішній комплекс з карбоксильними іонами полімеру, як зазначено на діаграмі 1. Цей комплекс швидко експериментує процес окисного відновлення іонів Fe +2, утворюючи карбонові радикали, які стабілізуються внаслідок втрати вуглекислого ангідриду. Утворений новий радикал буде експериментувати з новим процесом внутрішньомолекулярного відновлення з сусідніми іонами Fe-III, утворюючи вид, який має тенденцію стабілізувати кислотно-основні процеси з розчинником.
Дані DSC вказують на деградацію полімеру із втратою маси летких продуктів як наслідок декарбоксилювання та макрорадикального утворення, що експериментує з перехрещуванням реакцій, утворюючи більш стабільну структуру сітки, що вказується на менший відсоток втрати ваги (рис.4).
Дані DSC для ПАА та продуктів реакції через 5 та 17 годин представлені на малюнку 4. Вода усувається зі структури ПАА при температурах нижче 100 ° C з Tg приблизно 105 ° C. При 246,3 ° C чистий PAA переживає ендотермічну реакцію через 5 і 17 годин, реакції проявляються відповідно при 276,1 ° C і 275,0 ° C, що вказує на більш термостійкі структури.
У той же час продукти реакції переживали екзотермічний процес при 418,2 ° C та 416,9 ° C, відповідно, вказуючи на деградацію летких продуктів і вихід з макроструктури. Цей процес не спостерігається для чистого акрилового полімеру. Інші значущі дані щодо стабільності продуктів реакції спостерігались у відсотках втрати ваги, оскільки PAA представляв 85% втрати ваги вище 500 ° C. Навпаки, втрата ваги продуктів реакції нижче 75%, що вказує на більш стабільну теплову структуру, ймовірно, за рахунок утворення структури сітчастого типу через утворення зв’язків між макрорадикалами.
ВИСНОВКИ
| ? | Встановлено, що PAA зазнає деградації з реагентом Фентона в умовах, що використовуються для прищеплення целюлозного волокна. |
| ? | DSC-аналіз і ентальпія плавлення для всіх реагентних підкладок ПАА вказують на те, що при великих термінах реакції в полімері є значні зміни, що вказує на зміни в його структурі. |
| ? | За тривалого часу реакції полімеру акрилової кислоти було виявлено, що він декарбоксилізується до кислотного рН за допомогою реагенту Фентона, в результаті чого утворюється полімер зі структурою, що має більшу термостійкість. |
ПОДЯКИ
Подяка висловлюється Proyect N ° 020404 3/R, Науковий керівник, Університет Біобіо, Консепсьон.
БІБЛІОГРАФІЯ
1. Дж. Дж. Маурер, Д. Юстас, К. Т. Раткліф, Макромолекули, 20, 196-202, (1987). [Посилання]
2. Гюльтен Гюрдаг, Гамзе ГюКлу, Саадет Озгумус, J. Appl. Polym Sci, 80, 2267-2272 (2001). [Посилання]
3. Рамазан С .; мустафа Ю., Мехмет С., J. Appl. Polym Sci, 75, 766 (2000). [Посилання]
4. Ларс-Аке Лінден та Ян Ф. Рабек, Журнал прикладної полімерної науки, 50, 1331-1341 (1993). [Посилання]
5. Біжи Кенг, Джеремі Томкінсон, Журнал Wood Science, 48, 222-226 (2002) [Посилання]
6. Х. Дж. Х Фентон. J. Chem., 899 (1894) [Посилання]
7. М. Л. Кремер., Фіз. Хімія, фіз., 3595 (1999) [Посилання]
8. В.Ц. Брей, М.Х. Горін., J. Am. Хім. Соц., 2114 (1932) [Посилання]
9. P.A.MacFaul, D.D.M.Wayner, K.U. Ingold, Відповідно до Хім. Рек., 31, 159 [Посилання]
10. С.Гольдштейн, Д.Мейєрштейн, Відповідно до Хім. Рек., 31, 547 (1999) [Посилання]
11. М.Л.Кремер J Jnorg. Biochem., 78, 255 (2000) [Посилання]
12. Чарльз Р. Ян, Юфен Сю та Денцзін Ван, Інд. Інж. Хім. Рез., 35, 4037-4042 (1996) [Посилання]
13. Аревіндакшан, В. Г. Кумар, J. Appl. Polym Sci, 84, 528 (2002) [Посилання]
14. Цзянь Дун, Юсіхіро Озакі та Кенічі Накашима, Макромолекули, 50, 1117 (1997) [Посилання]
15. Умемура, Шуйчі, Кавал, Японське товариство досліджень деревини, 48, 25-31 (2002) [Посилання]
16. Айзенберг Т. Якояма та Емма Самбалідо, J. Appl. Polym Sci, 7, 1717-1728 (1969) [Посилання]
17. Пол, П. Тейлор, J. Chem Soc, Perkin Trans., 2, 511-518 (1996). [Посилання]
18. до н. Е. Гілберт, Г. Р. Ходжес, Дж. Р. Лінсей С., П. Макфол, П. Тейлор, J. Chem. Соц. Перкін Транс, 2, 519-524 (1996). [Посилання]
19. Н. Танака, Х. Кітано, Н. Ісе, J. Phys.Chem., 94, 6290 (1990) [Посилання]
20. Накашима, 1997, Макромолекули, 30, 1111-1117 (1997) [Посилання]
21. H.L.Isbell, H.L.Frush., Вуглевод. Черво., 161, 181 (1987) [Посилання]
22. Юриш, Дж. Йентген Кунстсайде у. Зеллволле, 23, 266 (1941) [Посилання]
23. Стефан Й.Х.Ф. Мистецтво. Ервін Дж. М., Момбарг, Герман ван Беккум, Роджер А. Шелдон. Синтез, 597 (1997) [Посилання]
24. А. Айзенберг, Йокогама, Е. Дж. Самбалідо, Дж. Полім. Sci., Chem, A-I, 7, 1717 (1969) [Посилання]
25. М. CMcGaugh, S.J. Коттл, Дж. Полім. Наук., 5, 817 (1967) [Посилання]
26. H.G.Girard, P., Mongol, Хебд. Сеанси акад. Сер., C279,597 (1974) [Посилання]
27. Дж. Муді, Досягнення у вуглеводної хімії., 19, 149-179 (1964) [Посилання]
28. Ратленд Е. Фішер. Бер., 33, 2142 (1900) [Посилання]
29. О. Йорж Бер., 32, 550 (1899) [Посилання]
30. О. Йорж Бер., 31, 1573 (1895) [Посилання]
31. О. Йорж Бер., 32, 2270 (1899) [Посилання]
32. Ф.М. Куен, Біохім. Z., 215, 12 (1929) [Посилання]
33. Дж. Д. Стерлінг, Біохім J., 24, 1048 (1834) [Посилання]
34. до н. Е. Гілберт, Г.Р. Ходжес, Р. Лінсей, П. Мак Помилка, П. Тейлор, J.Chem. Соц. Перкін Транс 2, 519 (1996 [Посилання]
Це також контенідо де еста ревіста, крім того, що є ідентифікаційним, так само, як і Licencia Creative Commons
- Циркулюючий саліцилова кислота та метаболічний профіль після 1-річного втручання у харчування та поведінку
- Лимонна кислота
- Застосування лимонної кислоти на користь шкіри Skinsei
- CLA може допомогти цій жирній кислоті вам схуднути досвід життя
- ГХ – МС АНАЛІЗ І РІВНИЙ РІВНИК ЖИРНОЇ КИСЛОТИ АРХЕОЛОГІЧНИХ ПОРТШЕРДІВ ЗАХІДНОГО ВЕЛИКОГО БАСЕЙНУ