Дефіцит коричневого жирового YY1 активізує експресію секретованих білків, пов’язаних із витратами енергії, та запобігає ожирінню, спричиненому дієтою
Франциско Вердегер
кафедра біології раку, Інститут раку Дани-Фарбер, Гарвардська медична школа, Бостон, штат Массачусетс, США
b Відділ клітинної біології Гарвардської медичної школи, Бостон, штат Массачусетс, США
Меган С. Сустек
кафедра біології раку, Інститут раку Дани-Фарбер, Гарвардська медична школа, Бостон, штат Массачусетс, США
b Відділ клітинної біології Гарвардської медичної школи, Бостон, штат Массачусетс, США
Максиміліан Хеттінг
кафедра біології раку, Інститут раку Дани-Фарбер, Гарвардська медична школа, Бостон, штат Массачусетс, США
b Відділ клітинної біології Гарвардської медичної школи, Бостон, штат Массачусетс, США
c Медичний факультет Ахенського університету RWTH, Аахен, Німеччина
Шарон М. Блетлер
кафедра біології раку, Інститут раку Дани-Фарбер, Гарвардська медична школа, Бостон, штат Массачусетс, США
b Відділ клітинної біології Гарвардської медичної школи, Бостон, штат Массачусетс, США
Девін Макдональд
кафедра біології раку, Інститут раку Дани-Фарбер, Гарвардська медична школа, Бостон, штат Массачусетс, США
b Відділ клітинної біології Гарвардської медичної школи, Бостон, штат Массачусетс, США
Джоєва Дж. Барроу
кафедра біології раку, Інститут раку Дани-Фарбер, Гарвардська медична школа, Бостон, штат Массачусетс, США
b Відділ клітинної біології Гарвардської медичної школи, Бостон, штат Массачусетс, США
Пер Пугсервер
кафедра біології раку, Інститут раку Дани-Фарбер, Гарвардська медична школа, Бостон, штат Массачусетс, США
b Відділ клітинної біології Гарвардської медичної школи, Бостон, штат Массачусетс, США
Анотація
ВСТУП
Нещодавно було показано, що системні фактори регулюють термогенез коричневої та бежевої жирової тканини, включаючи фактор росту фібробластів 21 (FGF21) (26), морфогенетичний білок кісток 4 (BMP4) (27), BMP7 (28), BMP8b (29), FGF19 (30), фактор диференціації росту 5 (GDF5) (31), натрійуретичні пептиди (32), простагландини (33, 34), фактор росту судинного ендотелію (VEGF) (35), β-аміноізомасляна кислота (BAIBA) (36), метеориноподібний (14) та іризин (37). Ці фактори беруть участь у контролі витрат енергії та маси тіла за допомогою модуляції НДТ або бежевого жиру. У цьому контексті, чи можуть фактори, що секретуються НДТ, сприяти витраті енергії або компенсувати дефектний термогенез НДТ через активацію інших термогенних тканин, включаючи бежеву або білу жирову тканину, недостатньо зрозуміло.
Тут ми повідомляємо, що втрата YY1 в НДТ призводить до сильного придушення експресії мітохондріальних та термогенних генів. Незважаючи на знижену термогенну функцію BAT, миші з дефіцитом YY1 захищені від ожиріння, спричиненого дієтою, і мають активовану термогенну бежеву та білу жирову тканину. Ми показуємо, що YY1 має антагоністичний контроль генів BAT, оскільки він активує гени, пов'язані з адаптивним термогенезом, шляхом активації канонічного термогенного шляху, але пригнічує низку секретованих білків, включаючи FGF21, BMP8b та GDF15, які активують енергію всього тіла витрати.
МАТЕРІАЛИ І МЕТОДИ
Експерименти на тваринах.
Всі експерименти та протоколи були схвалені інституційними комітетами з догляду та використання тварин Інституту раку Дани Фарбер або Медичного центру дияконесси Бет Ізраїль. Мишей YY1-Ucp1Cre та YY1-AdipoCre генерували племінними тваринами, у яких містився флоксирований алель YY1 (38), з трансгенними мишами, що експресують Ucp1 Cre (39) або адипонектин Cre рекомбіназу, відповідно (40). Для експериментів з мишами дикого типу миші C57BL/6 віком 8 тижнів були придбані у Taconic Farms. Мишей підтримували на стандартній чау-дієті або 60% дієті з високим вмістом жиру (HFD) (дослідницькі дієти) з 12-годинними циклами. Для експериментів з холодним опроміненням мишей поміщали в інкубатори з температурою 4 ° C або 30 ° C у зазначені моменти часу, а температуру тіла вимірювали ректальним зондом. Для метаболічних досліджень витрати енергії аналізували за допомогою комплексної лабораторної системи моніторингу тварин (Columbus Instruments). Мишей акліматизували протягом 24 годин до того, як проводили вимірювання. Вимірювання магнітно-резонансної томографії (МРТ) цілих мишей проводили на приладі CITI-сканування.
Експресія генів та Вестерн-блот-аналіз.
Загальну РНК з культивованих клітин або тканин очищали, використовуючи TRIzol (Invitrogen) для синтезу кДНК (набір високої ємності ABI). Відносну експресію мРНК визначали кількісно за допомогою кількісної ПЛР (qPCR) із використанням зеленого барвника SYBR (ABI) та специфічних праймерів (дані не наведені). Для вестерн-блоттингу цілоклітинні лізати готували з буфером для аналізу радіоімунопреципітації (RIPA), відокремлювали SDS-PAGE і переносили в мембрани Immobilon-P (Millipore). Для виявлення циркулюючого GDF15 використовували 1 мкл плазми для SDS-PAGE. Були використані такі антитіла: анти-YY1 (Санта-Крус), анти-UCP1 (Abcam), анти-NDUFA9 (Abcam), антисукцинатдегідрогеназа (анти-SDHA) (Abcam), антиаконітаза (Abcam), анти-GDF15 (Abcam), анти-MTCO1 (Abcam), анти-UQCRC2 (Abcam), pCREB (клітинна сигналізація), загальний CREB (клітинна сигналізація) та антитубулін (Millipore).
Коімунопреципітації.
Пул міжлопаткової коричневої жирової тканини від 5 мишей гомогенізували за допомогою моторизованого товкача в 4 мл ядерного ізоляційного буфера (10 мМ HEPES, рН 7,9, 10 мМ KCl, 1,5 мМ MgCl2, 0,5 мМ дитиотреїтолу [DTT], повноцінні інгібітори протеази [ Roche]) та інкубували на льоду протягом 10 хв. Ядра гранулювали центрифугуванням при 3200 × g протягом 5 хв і промивали в 4 мл того ж буфера перед центрифугуванням при 3200 × g протягом 5 хв. Потім ядерні таблетки ресуспендували в 600 мкл імунопреципітаційного буфера (0,1% NP-40, 150 мМ NaCl, 20 мМ HEPES, 1 мМ ЕДТА, повні інгібітори протеази [Roche]). Двісті мікрограмів білка інкубували з 3 мкг антитіла YY1 (sc1703; Santa Cruz Biotechnology, Inc.) або кролячого IgG для контролю протягом ночі при 4 ° C з обертанням. Імунокомплекси осаджували магнітними білковими гранулами G (DynaBeads; Invitrogen) під час 1-годинного обертання при 4 ° C. Потім зразки промивали 5 разів у буфері для імунопреципітації. Нарешті зразки кип'ятили, а супернатанти запускали на SDS-PAGE, включаючи вхідні зразки для виявлення вестерн-блот, використовуючи антитіло PGC-1α (Santa Cruz), антитіло YY1 (Santa Cruz Biotechnology, Inc.) та ламін B1 (Abcam).
Лінію клітин бурого жиру De2.3 обробляли диметилсульфоксидом (DMSO) або 10 мкМ форсколіном при 10 мкМ протягом 4 год. Ядра безпосередньо виділяли інкубацією гранул клітин з буфером ядерної ізоляції. Той самий протокол застосовувався для коричневої жирової тканини для коімунопреципітації комплексу YY1 – PGC-1α.
Гістологічний аналіз.
Свіжозібрані тканини фіксували на ніч у 4% параформальдегіді. Вбудовування, секціонування парафіну та фарбування гематоксиліном та еозином були проведені центральним центром досліджень патології Дани Фарбер/Гарвард.
Окислення жирної кислоти та глутаміну.
Коричневу жирову тканину гомогенізували в холодному буфері STE (0,25 М сахарози, 10 мМ трис-HCl, 1 мМ EDTA) і центрифугували при 420 × g протягом 10 хв. Супернатант додавали до 370 мкл реакційної суміші, що містить кінцеву концентрацію 100 мМ сахарози, 10 мМ трис-HCl, 5 мМ KH2PO4, 0,2 мМ ЕДТА, 80 мМ KCl, 1 мМ MgCl2, 2 мМ л-карнітину, 0,1 мМ малат, 0,05 мМ коферменту А, 2 мМ АТФ, 1 мМ DTT, і бичачий сироватковий альбумін (BSA) -пальмітатний розчин (0,7% BSA, 500 мкМ олеїнової кислоти, 0,4 мкКі [14 C] олеїнової кислоти або [14 C] глутаміну) . Зразки інкубували при 37 ° С протягом 1 год, і реакцію зупиняли додаванням 200 мкл 1 М хлорної кислоти. Далі, насичений 2-фенілетиламіном папір ватману поміщали під ковпачок трубки для того, щоб захопити радіоактивно мічений CO2 під час інкубації протягом ночі. Нарешті, папір ватману помістили в сцинтиляційну рідину, а кількість радіоактивних речовин вимірювали в сцинтиляційному лічильнику.
Споживання кисню.
Пряме дихання тканин ex vivo проводили за допомогою електрода Кларка (Strathkelvin Instruments). Свіжоізольовану тканину подрібнювали в дихальному буфері (1,5 мМ пірувату, 25 мМ глюкози, 2% BSA) і поміщали в електродні камери. Норма споживання O2 нормалізувалася до маси тканини.
Для прямого дихання мітохондрій з коричневої жирової тканини мітохондрії виділяли в буфер STE (0,25 М сахарози, 5 мМ Трис, 2 мМ ЕДТА) і центрифугували протягом 10 хв при 8500 × g. Гранулу ресуспендували в буфері STE і знову двічі центрифугували при 8500 × g. Гранульовані мітохондрії ресуспендували в 0,5 мл буфера STE і вимірювали загальну концентрацію білка. Респірометрію проводили за допомогою платформи XF24-3 від Seahorse Biosciences, як описано раніше (19).
Первинна культура клітин адипоцитів.
Фракцію стромальних судин (SVF) коричневої жирової тканини 6-тижневих мишей виділяли шляхом перетравлення колагенази з подальшим двома альтернативними етапами фільтрації (з використанням сито 100 та 40 мкМ) та центрифугуванням протягом 5 хв при 500 × g. Потім клітини висівали і диференціювали після злиття з адипогенним коктейлем (0,5 мМ 3-ізобутил-1-метилксантин [IBMX], 1 мкМ дексаметазону, 1 мкМ розиглітазону, 0,02 мкМ інсуліну, 1 нМ Т3) протягом 48 год. Клітини підтримували в 0,02 мкМ інсуліну і 1 нМ Т3 і збирали через 6-8 днів після диференціації.
Коричневу жирову тканину розтинали, розрізали на невеликі шматочки і зшивали 1% -ним сольовим розчином, забуференним формальдегідом-фосфатом (PBS), протягом 10 хв; Потім реакцію гасили 0,125 М гліцином. Потім БАТ гомогенізували в ізоляційному буфері (250 мМ сахарози, 5 мМ трис, 2 мМ ЕДТА) з використанням моторизованого товкача з подальшим виділенням хроматину в буфері, що містить 50 мМ HEPES, 140 мМ NaCl, 1 мМ ЕДТА, 1% Тритон Х-100, 0,1%, Na-дезоксихолат, 0,1% SDS та повні інгібітори протеази (Roche). Зразки обробляли ультразвуком у біогенері Diagenode протягом 5 циклів по 5 хв з робочим циклом 30 с «увімкнення» та 30 с «вимкнення». Зразки імунопреципітували специфічними антитілами до YY1 (Санта-Крус) та H3K27me3 (Abcam), а ДНК виділяли для аналізу qPCR, як описано раніше (25).
Виявлення плазматичного норадреналіну.
Тридцять мікролітрів плазми використовували для вимірювання плазматичного норадреналіну методом імуноферментного аналізу (ELISA) (Rocky Mountain Diagnostics) відповідно до рекомендацій виробника.
Аналізи збагачення масивів та наборів генів.
Вилучена РНК з НДТ або пахової підшкірної білої жирової тканини (IWAT) була використана для проведення генних масивів за допомогою миші 430A 2.0 GeneChip в ядрі мікрочипів Інституту раку Дани Фарбер. Для генерації файлів експресії генів (GCT), файли CEL використовувались як вхідні дані для генерування шаблону гена (http://genepattern.broadinstitute.org/) Expression File Creator, використовуючи надійне середнє багаторівневе (RMA) та нормалізацію квантилів. Для аналізу збагачення наборів генів (GSEA) файли GCT використовувались як вхідні дані за допомогою програмного забезпечення GSEA 2.0 (http://www.broadinstitute.org/gsea) із використанням параметрів за замовчуванням (41).
Номер приєднання даних мікрочипів.
Номер приєднання Omnibus Expression для даних генетичної експресії, що повідомляється, - це номер супер серії. > GSE68443.
РЕЗУЛЬТАТИ
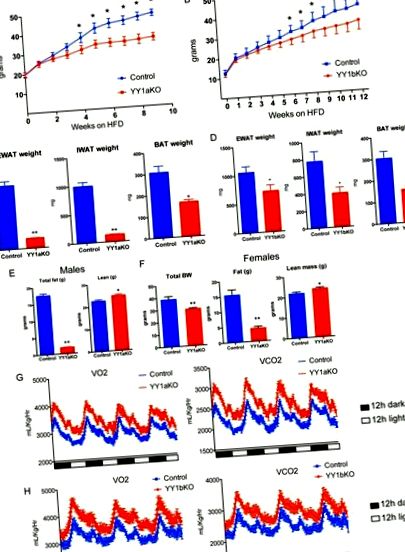
Генетична делеція YY1 в жировій тканині призводить до захисту від ожиріння, спричиненого дієтою.
Підрум’янення підшкірної білої жирової тканини у мишей YY1 KO, які харчувались жирною дієтою. (А) Експресія генів IWAT від YY1bKO порівняно з контрольними мишами, які харчувалися дієтою з високим вмістом жиру. (B) Аналіз експресії набору генів (GSEA) IWAT від YY1bKO порівняно з контрольними мишами, що вказує на збільшення катаболічних шляхів. (C) Вестерн-блот-аналіз мітохондріальних білків в IWAT від YY1bKO проти контрольних мишей на дієті з високим вмістом жиру. (D) Фарбування H&E поперечних перерізів IWAT від YY1bKO порівняно з контрольними мишами, які харчувались жирною дієтою. (E) Споживання кисню ex vivo гомогенатів IWAT від YY1bKO порівняно з контрольними мишами, виміряними електродом Кларка. (F) Швидкість окислення жирних кислот, виміряна вивільненням 14 СО2 з гомогенатів IWAT, інкубованих з олеїновою кислотою, міченою 14 C, у YY1bKO та контрольних мишах. Дані представлені як середні значення ± SEM. *, P Рис. 5A та Fig. 1C та andD), D), ми провели GSEA з вісцеральної жирової тканини мишей дикого типу та YYaKO. Цікаво, що експресія декількох представників сімейства SLC25 ядерно кодованих мітохондріальних носіїв була збільшена в EWAT від мишей YY1aKO (рис. 5B). Кодоване ядром сімейство SLC25 бере участь у багаторазовому імпорті розчинених речовин в мітохондрії. Цікаво, що носії імпорту амінокислот (Slc25a22 та Slc25a44), нуклеотидів (Slc25a33) та карбоксилатів (Slc25a10) були підвищені в EWAT мишей YY1aKO, які годували раціоном з високим вмістом жиру, як показано qPCR на рис. 5C. Крім того, основні зміни в транскриптах мРНК, пов’язані з споживанням поживних речовин (Glut4 та Fabp3) та використанням енергії мітохондрій (Ppar-α, Acot2, Cpt1b та Elovl3), були збільшені у мишей YY1aKO як у дієтичному, так і в холодному харчуванні -експоновані групи (рис. 5C та і D D).
Секретовані фактори, пов’язані з витратами енергії, збільшуються в коричневому жирі мишей YY1-Ucp1 KO.
У сукупності ці результати показують, що серед генів з підвищеною експресією гени, що кодують секретовані білки в BAT від мишей-мутантів YY1, Bmpb8 та Gdf15, є прямими репресивними мішенями YY1, підтримуючи H3K27me3 у своїх промоторах. Ці дані свідчать про те, що функція репресії YY1 на промоторах Bmp8b та Gdf15 може послаблюватися під час підвищення енергетичних потреб. Крім того, дефіцит YY1 у НДТ спричинив збільшення експресії генів секретованих білків, включаючи експресію генів FGF21, Нейромедіну В, Несфатину та Angptl6; однак ці гени не є прямими мішенями YY1 і контролюються під дією інших тканин.
ОБГОВОРЕННЯ
Модель. YY1 завербує PGC-1α та індукує класичний термогенез, активуючи мітохондріальні та канонічні термогенні гени в коричневому жирі. Однак YY1 відіграє безпосередню супресорну роль у контролі альтернативних термогенних генів, включаючи Bmp8b та Gdf15, і має непрямий контроль над генами Fgf21, Angptl6, Нейромедин B та Несфатин, пов'язані з витратами енергії. При надмірному споживанні калорій та втраті YY1 ці фактори виділяються з НДТ, підвищують термогенез бежевих та білих жирових клітин та захищають від ожиріння, спричиненого дієтою.
Підводячи підсумок, ми виявили антагоністичну функцію фактора транскрипції YY1 у НДТ через активацію термогенних генів та придушення генів, що кодують секретовані фактори, пов'язані з витратами енергії. Націлювання на компоненти цього шляху може бути терапевтично корисним для лікування ожиріння або супутніх метаболічних захворювань.
ПОДЯКИ
Ми дякуємо членам лабораторії Puigserver за поради та плідні обговорення, а також спеціалістам BIDMC з досліджень тварин за догляд за мишами. Ми вдячні Лінусу Т. Цаю та Евану Д. Розену за те, що вони надали нам лінію миші Ucp1-Cre.
Ці дослідження були підтримані NIH/NIDDK RO1DK081418 (P.P.) та стипендіями докторантури: EMBO Long-Term (F.V.), NIH-1F32DK105679-01 (M.S.S.) та DFG, Німецький дослідницький фонд HA 7246/1-1 (M.H.).
Ф.В. розробив і виконав усі експерименти і написав рукопис. М.С. допомагав збирати мишачі органи та переглядав рукопис. М.Х. сприяли експериментам, проведеним під час огляду. S.M.B. переглянув рукопис і надав концептуальні поради та реактиви. Д.М. допомагали в експериментах з генотипування мишей та споживання тканини киснем у тканинах. Дж. Б. переглянув рукопис і надав концептуальні поради та реактиви. П.П. задумав дослідження, надав концептуальні поради, наглянув проект, написав і переглянув рукопис.
Заява про фінансування
Фінансисти не мали жодної ролі в розробці досліджень, зборі та інтерпретації даних, а також у прийнятті рішення про подання роботи на публікацію.
- Гострі наслідки прийому комерційного термогенного напою на зміни витрат енергії та
- Кращі амінокислотні добавки для енергетичних м’язів; Фітнес
- 10 найздоровіших енергетичних батончиків
- Антицелюлітні компресійні гетри; Одяг Energy Fit
- Бурий ведмідь відловлений після третьої втечі з середовища існування дикої природи, 2-го року Fox News