Циркулюючі екзосомні miR-150-5p та miR-99b-5p як діагностичні біомаркери для колоректального раку
Я цзин Чжао
1 Школа медицини та наук про життя, Університет Цзинаня, Академія медичних наук Шаньдун, Цзінань, Китай
2 Відділ клінічної лабораторії, Ракова лікарня та інститут Шаньдуна, Перший медичний університет Шаньдуна та Академія медичних наук Шаньдун, Цзінань, Китай
Пісня Сінго
3 Ключова лабораторія радіаційної онкології провінції Шаньдун, Онкологічна лікарня та інститут Шаньдуна, Перший медичний університет Шаньдуна та Академія медичних наук Шаньдун, Цзінань, Китай
Лімін Ніу
1 Школа медицини та наук про життя, Університет Цзинаня, Академія медичних наук Шаньдун, Цзінань, Китай
2 Відділ клінічної лабораторії, Ракова лікарня та інститут Шаньдуна, Перший медичний університет Шаньдуна та Академія медичних наук Шаньдун, Цзінань, Китай
Юйонг Тан
1 Школа медицини та наук про життя, Університет Цзинаня, Академія медичних наук Шаньдун, Цзінань, Китай
2 Відділ клінічної лабораторії, Ракова лікарня та інститут Шаньдуна, Перший медичний університет Шаньдуна та Академія медичних наук Шаньдун, Цзінань, Китай
Пісня Сяньранга
2 Відділ клінічної лабораторії, Ракова лікарня та інститут Шаньдуна, Перший медичний університет Шаньдуна та Академія медичних наук Шаньдун, Цзінань, Китай
Лі Се
2 Відділ клінічної лабораторії, Ракова лікарня та інститут Шаньдуна, Перший медичний університет Шаньдуна та Академія медичних наук Шаньдун, Цзінань, Китай
Пов’язані дані
Набори даних, проаналізовані в цьому рукописі, не є загальнодоступними. Запити на доступ до наборів даних слід направляти на moc.621@1002eix_l.
Анотація
Передумови: Екзосомні мікроРНК, що циркулюють, є потенційними неінвазивними біомаркерами для колоректального раку. Це дослідження мало на меті перевірити нові чутливі та специфічні екзосомні біоМаркери miRNA для діагностики раку прямої кишки (CRC).
Пацієнти та методи: Екзосоми, виділені із сироватки крові пацієнтів з КРР та здорових донорів ультрацентрифугуванням, характеризували за допомогою ТЕМ, qNano та імуноблотингу. Екзосоми від 2 здорових донорів та 4 хворих на CRC піддавались виділенню РНК та секвенуванню мікроРНК. Різно виражені мікроРНК у 165 первинних хворих на ХРЗ та 153 здорових донорів були обґрунтовані RT-qPCR.
Результати: Аналіз даних РНК-послідовності показав, що було відібрано 29 екзосомних мікроРНК (20 з регульованою та 9 з регульованою регуляцією) з різницею> 1,5 рази між пацієнтами з КРР та здоровими донорами. Рівні екзосомних miR-99b-5p та miR-150-5p у сироватці крові були суттєво знижені у пацієнтів із CRC порівняно зі здоровими донорами (p Ключові слова: екзосоми, колоректальний рак, miR-99b-5p, miR-150-5p, діагностика
Вступ
Колоректальний рак (КРР) є третім за поширеністю раком у світі з 1,36 мільйона нових випадків щороку та близько 700 тисяч смертей (1, 2). Приблизно 50% хворих на КРР померли як наслідок пізнього виявлення запущеного захворювання з локалізованими або віддаленими метастазами (3). Ці явища підкреслюють і підкреслюють потребу у виявленні та розробці надійних та недорогих скринінгових біомаркерів, які не є інвазивними та сприяють ранньому виявленню CRC, таких як біопсія рідини на основі вмісту крові, включаючи безклітинну ДНК (4), циркулюючі пухлинні клітини (5) та екзосоми (6).
Екзосоми відомі як позаклітинні везикули діаметром 50–150 нм, що вивільняються з різних типів клітин (7–9), які розглядаються як критичні посередники міжклітинних комунікацій, включаючи доставку біологічних сигналів та селективного вантажу між різними клітинами, завдяки чому регулювання численних біологічних процедур (10, 11). Екзосоми також виконують плейотропну роль у прогресуванні раку, метастазуванні, імунній модуляції та стійкості до лікарських засобів (12–16). Критичним відкриттям опосередкованої екзосомою комунікації є передача генетичної інформації через екзосоми, такі як РНК-месенджери (мРНК) та короткі некодуючі мікроРНК (мікроРНК), до сусідніх клітин або віддалених органів. Наприклад, мікроРНК в екзосомах раку - це гормони, які життєво важливі для опосередкування прогресування та метастазування раку, таким чином, з’являючись як перспективні біомаркери для раку (17).
У цьому дослідженні ми використовували послідовності малих РНК та кількісну ПЛР для пошуку диференціальних екзосомних мікроРНК між пацієнтами з КПР та здоровими донорами відповідно. Отже, були відібрані екзосомні miR-150-5p та miR-99b-5p та проаналізовано їх кореляцію з клінічними характеристиками та ефективністю діагностики для діагностики CRC; таким чином, вони послужили новими біомаркерами для КПР.
Матеріали і методи
Пацієнти
Загалом 169 пацієнтів з CRC, 155 здорових донорів та 20 пацієнтів з доброякісними захворюваннями були прийняті в онкологічну лікарню Шаньдун з вересня 2017 року по липень 2018 року. Екзосоми від 2 здорових донорів та 4 пацієнтів CRC були піддані послідовності мікроРНК, і 165 пацієнтів CRC, екзосом від інших 155 здорових донорів та 20 пацієнтів із доброякісними захворюваннями були піддані верифікації qPCR. Письмова інформована згода була отримана від усіх суб’єктів. Постановка пухлини була оцінена відповідно до Довідника AJCC щодо ракових захворювань Американського об’єднаного комітету з питань раку, 2010 р. Усі пацієнти не отримували протипухлинного лікування до забору сироватки або страждали на будь-які інші ендокринні, імунні або метаболічні захворювання. Сироватки відбирали у 20/165 пацієнтів з ХРН, які перенесли операцію через 2 місяці. Характеристики пацієнтів та анамнез діабету хворих на ХРН наведені в Таблиця 3.
Виділення екзосом
Екзосоми виділяли за допомогою ультрацентрифугування, як описано раніше (25). Коротко кажучи, сироватку проводили центрифугування при 10000 × g протягом 30 хв при 4 ° C для видалення клітинного сміття з подальшим ультрацентрифугуванням (Beckman Coulter, Brea, CA, USA) при 100000 × g протягом 2 годин при 4 ° C для екзосомних опадів. Потім екзосомний осад аналізували за допомогою трансмісійної електронної мікроскопії (ТЕМ), qNano та імуноблотингу, послідовності мікроРНК та ПЛР у реальному часі.
Тест TEM
ТЕМ проводили для ідентифікації очищених екзосом. Гранули екзосоми переносили в сітки по 50 мкл 1% -ного глутарового альдегіду протягом 5 хв і переносили в 100-мкл краплі дистильованої води і давали сіткам стояти протягом 2 хв. Потім сітки поміщали безпосередньо у краплю 50 мкл розчину уранил-оксалату (рН 7) на 5 хв і покривали покритою парафільмами скляною тарілкою, покритою без льоду. Згодом сітки сім разів промивали дистильованою водою по 2 хв кожну і досліджували за допомогою просвічуючого електронного мікроскопа JEM-1200EX (JEOL, Японія), що працював при 100 кВ.
Регульоване резистивне імпульсне зондування (TRPS)
Розмір наночастинки вимірювали за допомогою TRPS та на qNano (Izon Science Ltd, Крайстчерч, Нова Зеландія). Дані аналізували за допомогою Izon Control Suite v.3.3.2.2000 (Izon Science Ltd.).
Імуноблотинг
Еквівалентну кількість екзосомних або клітинних білків розщеплювали за допомогою SDS-PAGE і переносили в мембрани PVDF (Millipore, Billerica, MA, США). Мембрани блокували 5% молоком у буферному сольовому розчині, що містить 0,1% Tween 20 (TBST), протягом 1 години і досліджували протягом ночі при 4 ° C первинними антитілами кроликів проти CD63, TSG101 та GM130 з наступною інкубацією з HRP- кон'югованих вторинних антитіл (Proteintech) протягом 1 год при кімнатній температурі. Імунореактивні смуги візуалізували за допомогою реагентів для блоттингу ECL (Bio-Rad, США), розробляли та фіксували на рентгенівських плівках.
Диференціальна експресія мікроРНК наборів даних РНК-послідовності та аналіз
Всього 3 мкг РНК від кожного зразка використовувались як вихідний матеріал для створення невеликої бібліотеки РНК. Після генерації кластера бібліотеки були послідовно розподілені на платформі Illumina HiSeq 2500/2000 (Illumina, США), і було створено однобічне читання на 50 bp. Після секвенування дані були піддані наступним попереднім аналізам та процедурам, які проводила корпорація Novogene: аналіз контролю якості, зчитування зчитування в геном homo spaiens, складання транскриптома, аналіз потенційного кодування, консервативний аналіз, прогнозування цільового гена, ген кількісне визначення рівня експресії, диференційний аналіз експресії та аналіз збагачення Кіотської енциклопедії генів і геномів (KEGG). Аналіз диференціальної експресії двох умов/груп проводили за допомогою пакету DESeq R (1.8.3). Значення Р регулювали за допомогою методу Бенджаміні та Хохберга. Виправлене значення Р 0,05 було встановлено як поріг для суттєво диференціального вираження за замовчуванням. Ми використовували програмне забезпечення KOBAS для тестування статистичного збагачення кандидатів-цільових генів у шляхах KEGG. Для аналізу збагачення GO було впроваджено нецентральний гіпергеометричний розподіл Валеніуса, заснований на GOseq, який може коригуватись на зміщення довжини гена. Прогнозування цільового гена miRNA проводили RNAhybrid: (https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/); ПІТА: (genie.weizmann.ac.il/pubs/mir07/mir07_dyn_data.html); miRanda: (http://www.microrna.org/microrna/getMirnaForm.do) (Таблиця S1).
Виділення РНК та ПЛР у реальному часі
Загальні РНК екстрагували реактивом TRIzol (Thermo Fisher Scientific, Карлсбад, Каліфорнія, США) відповідно до інструкцій виробника. Вилучену РНК перетворювали зворотним шляхом в додаткову ДНК (кДНК), використовуючи набір синтетичних синтетиків First-Strand Synthesis Mix-X (TaKaRa Bio, Nojihigashi, Kusatsu, Японія) згідно з інструкціями виробника. ПЛР у режимі реального часу проводили з використанням реагенту TB-Green Premix Ex Taq II (TaKaRa Bio) відповідно до інструкцій виробника. U6 використовували як внутрішній контроль (26). Кожен зразок аналізували у двох примірниках. Реакцію ПЛР оцінювали за допомогою аналізу кривої плавлення. Відносну кількісну оцінку експресії міРНК оцінювали за допомогою методу ΔCT (Ct miРНК -Ct U6), як описано раніше (27).
Статистичний аналіз
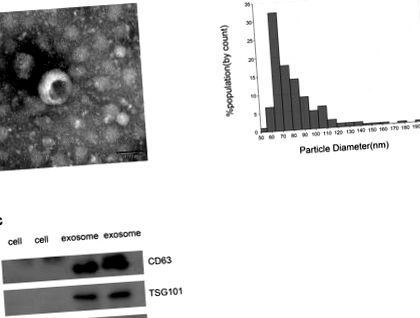
Статистичний аналіз проводили за допомогою SPSS 22.0 (IBM, Енінген, Німеччина) та GraphPad Prism 6.0 (Сан-Дієго, Каліфорнія, США). Порівняння проводили за допомогою U-тесту Манна – Уітні або t-критерію, а різницю між парними значеннями оцінювали за допомогою парного t-критерію. Було проведено багаторазове порівняння з використанням одностороннього дисперсійного аналізу (ANOVA) або однобічного ANOVA Крускала – Уолліса. Криві робочої характеристики приймача (ROC) із відповідною статистикою C (площа під кривою, AUC), засновані на логістичних моделях, використовувались для визначення відповідних точок відсікання з патологічним діагнозом, який розглядався як “золотий стандарт”. p Рисунок 1A) ілюструє типову екзосомоподібну круглу морфологію діаметром 50–150 нм методом TEM, що узгоджується з результатом qNano (рис. 1B). Крім того, CD63 та TSG101, два добре відомі білкові маркери (28, 29), збагачені екзосомами пацієнтів із КРР, але їх неможливо виявити в клітині (рис. 1С). З іншого боку, GM130 є фактором прив'язки, пов'язаним з гігантином у відділенні цис-Гольджі, який зазвичай використовується як негативний контроль для екзосоми (рис. 1С) (30). Це було виявлено лише в клітині, але не в екзосомі CRC. Отже, ці результати підтвердили, що везикули, виділені ультрацентрифугуванням, були екзосомами.
Ідентифікація ізольованих екзосом. (A) На ТЕМ-зображенні були представлені репрезентативні дані екзосом пацієнтів із КРР із діаметром пухлин 50–150 нм (шкала шкали: 50 нм; висока напруга (ВН) = 100 кВ). (B) Розподіл екзосом діаметром 50–150 нм; зразки були отримані від пацієнтів з CRC на основі системи qNano. (C) Вестерн-блот-аналіз CD63, TSG101 та GM130 як екзосомних маркерів.
Екзосомний профіль мікроРНК пацієнтів з КПР
Екзосоми від 2 здорових донорів та 4 хворих на КРР піддавали виділенню РНК та секвенуванню міРНК. Всього було проведено скринінг 1145 диференціальних мікроРНК між здоровими донорами та пацієнтами з КРР шляхом аналізу вихідних даних профілювання експресії мікроРНК (рис. 2А). Більше того, було вибрано 29 міРНК (20 регульованих та 9 регульованих, таблиці 1, 2) 2), виходячи із> 1,5-кратної різниці між двома групами (рис. 2В). KEGG-аналіз продемонстрував, що цільові гени по-різному експресованих miРНК в основному призначаються 20 шляхам, серед яких мітоген-активована протеїнкіназа (MAPK) та циклічні сигнальні шляхи гуанозинмонофосфат-білкар-кінази G (cGMP-PKG) в основному беруть участь в екзосомній міРНК функції в CRC (Рисунок 2C).
Екзосомальний профіль мікроРНК пацієнтів з КРР. (A) Теплова карта була сформована після контрольованого ієрархічного кластерного аналізу. Диференціальна експресія мікроРНК відображається червоним кольором (підвищення регуляції) проти синього (зниження регуляції) (p Малюнок 3A). Крім того, ми перевірили стабільність екзосомних міРНК. Експресія міРНК в екзосомах все ще залишалася незмінною під час лікування РНКазою А (рис. 3В). Коротко, результати показують, що miR-99b-5p та miR-150-5p в основному існують в екзосомах, які захищають miРНК від ферментної обробки. У тесті інкубації при кімнатній температурі екзосоми підтримувались при кімнатній температурі протягом 0, 6, 12, 18, 2 4 год. Не виявлено суттєвих змін щодо рівнів експресії miR-99b-5p та miR-150-5p в різні моменти часу (малюнки 3C, D).
- Дієтичні схеми та ризик розвитку колоректальної аденоми, дослідження раку чорношкірих жінок
- Вплив кефіру на якість життя пацієнтів, які лікуються від раку прямої кишки - PubMed
- Дієтичні схеми та рак прямої кишки є результатами канадського популяційного дослідження «Харчування»
- Циркулюючі позаклітинні мікроРНК у крові та слині є новим джерелом біомаркерів у
- Глобальні мікробні підписи для раку прямої кишки - ScienceDaily