Чи впливає пилковий раціон на виробництво та експресію антимікробних пептидів у окремих медоносних бджіл?
Іржі Даніглік
1 Кафедра біохімії та протеоміки білка, Центр регіону Хана для біотехнологічних та сільськогосподарських досліджень, Природничий факультет, Палацький університет в Оломоуці, Šlechtitelů 27, 783 71 Olomouc, Чеська Республіка; [email protected] (J.D.); [email protected] (R.L.); [email protected] (M.Š.)
2 Кафедра біохімії, природничий факультет, Палацький університет в Оломоуці, Шлехтітель 27, 783 71 Оломоуць, Чеська Республіка; [email protected]
Марія Шкрабішова
3 Відділ молекулярної біології, Центр регіону Хана для біотехнологічних та сільськогосподарських досліджень, Природничий факультет, Палацький університет в Оломоуці, Шлехтітель 27, 783 71 Оломоуць, Чеська Республіка; [email protected]
Рене Ленобель
1 Кафедра біохімії та протеоміки білка, Центр регіону Хана для біотехнологічних та сільськогосподарських досліджень, Природничий факультет, Палацький університет в Оломоуці, Šlechtitelů 27, 783 71 Olomouc, Чеська Республіка; [email protected] (J.D.); [email protected] (R.L.); [email protected] (M.Š.)
Марек Шебела
1 Кафедра біохімії та протеоміки білка, Центр регіону Хана для біотехнологічних та сільськогосподарських досліджень, Природничий факультет, Палацький університет в Оломоуці, Šlechtitelů 27, 783 71 Olomouc, Чеська Республіка; [email protected] (J.D.); [email protected] (R.L.); [email protected] (M.Š.)
Еслам Омар
4 Інститут біології, Університет Граца, Universitätsplatz 2, 8010 Грац, Австрія; ge.ude.nua@ramomalse (E.O.); [email protected] (К.Ц.)
Марек Петрживальський
2 Біохімічний факультет природничо-наукового факультету Палацького університету в Оломоуці, Шлехтітель 27, 783 71 Оломоуць, Чеська Республіка; [email protected]
Карл Крайльсхайм
4 Інститут біології, Університет Граца, Universitätsplatz 2, 8010 Грац, Австрія; ge.ude.nua@ramomalse (E.O.); [email protected] (К.Ц.)
Роберт Бродшнайдер
4 Інститут біології, Університет Граца, Universitätsplatz 2, 8010 Грац, Австрія; ge.ude.nua@ramomalse (E.O.); [email protected] (К.Ц.)
Пов’язані дані
Анотація
1. Вступ
Відсутність важливих поживних речовин у харчуванні бджіл може призвести до зменшення чисельності личинок або до ослаблення життєвого тонусу дорослих у медоносних колоніях [1]. Найбільш необхідними поживними речовинами є цукри, білки та ліпіди, що містяться в нектарі та пилку. Дорослі бджоли потребують відповідного та збалансованого харчування протягом усього життя, оскільки вони стикаються з різними завданнями та проблемами. Харчові якості пилку різняться серед видів рослин, суттєво змінюючись у загальному вмісті білків, ліпідів, цукрів та амінокислот, а також в антиоксидантній здатності [2]. Середнє споживання пилку на медоносну бджолу становить 3,4–4,3 мг/добу, причому найбільшу кількість пилку споживають бджоли-годувальниці [3]. Окрім природних джерел раціону, зібраних бджолами протягом сезону (нектар, медова роса, пилок), відомо, що різні вуглеводні дієти, які живляться колоніями як зимова їжа, викликають диференціальну експресію різних генів у жирових організмах бджіл [4].
Соціальні комахи, як правило, мають меншу кількість імуногенних генів у порівнянні з одиночними комахами [5,6]. Існує три рівні бджолиного імунітету, що відображається у їх взаємодії з патогенами - фізичні бар’єри, клітинний імунітет та гуморальний імунітет, і крім того, бджоли як соціальні комахи виробили особливий тип імунітету - соціальний імунітет [7,8]. Харчове споживання медоносних бджіл та ефективність індивідуальних імунних реакцій виявляються у можливих взаємних стосунках [9]. Гуморальна частина імунітету робочої бджоли складається з ферментів, лектинів та антимікробних пептидів (АМФ). Gätschenberger та ін. [10] показали, що загальна імунна сила літніх та зимових бджіл залишалася на одному рівні. Однак, коли бджоли сильно заражені вірусом деформованого крила, гени клітинного імунітету знижуються, тоді як експресія гуморальних імунних генів збільшується [11]. Стресові умови, викликані впливом сублетальних доз неонікотиноїдів, також порушують індивідуальну імунокомпетентність медоносних бджіл [12].
Опублікована дослідницька робота, присвячена змінам у експресії генів AMP медоносних бджіл у відповідь на специфічні стимули, в основному базується на кількісному ПЛР-аналізі тканин бджіл або цілих тіл [21,22,23]. Крім того, кілька інших методів, таких як електрофорез у поліакриламідному гелі, високоефективна рідинна хроматографія та мас-спектрометрія, були використані для виявлення та кількісної оцінки антимікробних пептидів у збірних зразках великої кількості бджіл [14,24,25]. Дослідження АМФ бджіл стосуються здебільшого змін у експресії відповідних генів, оскільки до теперішнього часу опубліковано лише декілька звітів про кількісну оцінку рівнів пептидів АМФ. Нещодавно був розроблений новий високочутливий аналітичний метод кількісного визначення ізоформ апідецину 1 у гемолімфі або частинах тіла окремих бджіл, який вважається перспективним інструментом для точної кількісної оцінки AMP бджіл [26].
Тут ми досліджували зміни у вибраних параметрах гуморальної імунної системи у окремих бджіл, яких годували різними пилковими раціонами. Ми проаналізували відносну експресію генів, що кодують апідецини та абаецин у череві медоносних бджіл, де вони синтезуються в жирових тілах. Ми також повідомляємо про перше кількісне вимірювання рівнів активних ізоформ апідецину 1 у грудях бджіл, де вони присутні в циркулюючій гемолімфі, на індивідуальному рівні бджіл, що підтримуються in vitro.
2. Матеріали та методи
2.1. Хімікати
Синтетичні стандарти апідецину 1А та ізотопно позначений [13 C6 15 N4] апідецин 1А (на С-кінці) синтезував Clonestar (Брно, Чеська Республіка). Обидва стандарти синтетичного пептиду в розчинах були кількісно визначені за допомогою аналізу амінокислот Групою аналізу білка, Центром функціональної геноміки, Швейцарським федеральним технологічним інститутом, Цюріх, Швейцарія. Ацетонітрил, метанол, вода (усі з якістю LC/MS), 98% (об./Об.) Мурашина кислота та трифтороцтова кислота приблизно. класу були від Sigma-Aldrich (Штайнхайм, Німеччина). 2-пропанол для спектроскопії був від Merck (Дармштадт, Німеччина). Всі хімічні речовини, що використовуються для кількісної оцінки експресії генів, були придбані в якості молекулярної біології.
2.2. Вирощування та годівля бджіл
Ми інкубували герметичні розводи для розплоду з кількох колоній Apis mellifera carnica від Інституту зоології, Грац, при 34,5 ° C за стандартних умов, щоб отримати нових медоносів, молодших за 24 год [27]. Бджіл вибирали випадковим чином і перемішували перед тим, як їх поміщали в експериментальні клітини, що складалися з прозорих пластикових стаканчиків. Клітки також постачали восковим батончиком і експерименти тривали протягом 18 днів. Кожна клітка містила 100 бджіл, і експеримент проводився у двох клітинах для кожного типу раціону.
2.3. Підготовка пилкових дієт та фактори харчування
Усі бджоли отримували 50% (мас./Об.) Розчину сахарози за необхідності. Усі клітини, крім однієї, додатково годувались однією з наступних білкових дієт: Feedbee TM, додаткова білкова дієта, доступна на ринку, яка не містить жодного продукту з вуликів [28], або пилок, що містить карбікули, що містить 94,8% соняшнику (Helianthus spp.), 91,2% гірчиці (Sinapis spp.), 70,6% спаржі (Asparagus spp.) або 87,6% каштана (Castanea sativa). Див. Омар та ін. [29] докладніше про дієти. Монофлорний пилок збирали бджоли в Австрії і зберігали замороженим до використання. Змішана група пилку отримувала 25% (мас./Мас.) Суміші кожного з чотирьох різних типів пилку. Кожне завантаження пилку було палінологічно проаналізовано в AGES — SPB, Abteilung, Bienenkunde und Bienenschutz, Lunz am See, Австрія та замішане у тісто, яке забезпечувалося бджолами в клітині в одній половині циліндричних 10-міліметрових пластикових трубок [27]. Усі раціони бджіл щодня оновлювались і зважувались. Середнє кумулятивне споживання дієт протягом 18 днів годування коливалося від 42,52 мг/бджола для спаржі до 68,28 мг/бджола для змішаної пилкової дієти (див. Додатковий матеріал S1).
2.4. Попередня обробка зразків
Експериментальних бджіл збирали, негайно заморожували та зберігали при -80 ° C до використання. Перед обробкою окремих заморожених бджіл розтинали на цілі груди, використовували для кількісного визначення ізоформ апідецину 1 та черевця, використовували для кількісного визначення експресії генів апідецинів та абаецину.
2.5. Кількісне визначення ізоформ апідецину 1
2.6. Білковий аналіз
Бредфордський аналіз застосовували у мікрочипах для кількісного визначення білка у зразках. Бичачий сироватковий альбумін служив білковим стандартом [30].
2.7. Виділення РНК та підготовка кДНК
Окремі черевні відділи бджіл гомогенізували в буфері GITC (300 мкл на черевце) [31]. Міні-набір RNeasy Plant (Qiagen, Hilden, Німеччина) був використаний для виділення РНК. Гомогенати (100 мкл) змішували з 350 мкл RTL-буфера з набору та обробляли, дотримуючись інструкцій виробника. Нарешті, концентрацію РНК визначали за коефіцієнтом поглинання при 260 нм за допомогою мікрооб’ємного спектрофотометра BioSpec-nano (Shimadzu, Токіо, Японія). Забруднююча ДНК перетравлювалася за допомогою Turbo DNAse (Ambion від Life Technologies, Карлсбад, Каліфорнія, США) (Додатковий матеріал S3). Цілісність РНК перевіряли за допомогою гель-електрофорезу на 1,1% (мас./Об.) Агарозному гелі, що містить бромід етидію. Набір Transcriptor High Fidelity (Рош, Базель, Швейцарія) використовували для синтезу кДНК із очищеної РНК, дотримуючись інструкцій виробника. Якість кДНК та можливу наявність забруднення геномної ДНК перевіряли методом гель-електрофорезу ПЛР (Supplementary Material S3) у 3% (мас./Об.) Агарозному гелі з бромідом етидію як метод виявлення та за допомогою маркера ПЛР 50–1000 п.н. ( Promega, Madison, WI, USA) як стандарт.
2.8. Аналіз експресії генів
Кількісну реакцію ПЛР (qPCR) проводили на системі виявлення ПЛР у реальному часі CFX96 TouchTM (Bio Rad, Геркулес, Каліфорнія, США) з SyberSelect ® Master Mix (Life Technologies, Carlsbad, CA, USA). Пара праймерів, розроблена для ампліфікації гена Apid1 (синонімічно Apid14 - для послідовностей праймерів див. Додатковий матеріал S3), є універсальною для всіх трьох існуючих генів апідецину: Apid14 (ген ID 406140), Apid22 (ген ID 494510) та Apid73 (Ідентифікатор гена 406115). Експресія гена була кількісно визначена в животі. Ефективність ампліфікації визначали для всіх праймерів (додатковий матеріал S4). Специфічність кожного аналізу експресії гена qPCR оцінювали за відповідною кривою плавлення дисоціації.
2.9. Кількісна оцінка рівня відносної експресії генів
Обидва вибрані HKG, Arp1 та EF1a-F2, використовувались для нормалізації генів, що кодують пептиди апідецинів та абаецину. Дані qPCR відповідають рекомендаціям MIQE [34] (Додатковий матеріал S6).
2.10. Статистичний аналіз
Графіки графіків прямокутників були побудовані в OriginPro 9.0.0. Графік граф відображає 1–3 квартилі, тоді як квадрати означають середні значення, а лінії - медіани. Основні статистичні дані та параметричні ANOVA або непараметричні тести Крускала-Уолліса та пост-hoc багаторазові статистичні тести порівняння були проведені в Statistica 13 (64-розрядна версія).
Стабільність експресії генів ведення домашнього господарства (HKG), що кодують Arp1 (HKG1) та EF1a-F2 (HKG2), оцінювались у BestKeeper [33], а відносні вирази генів, що представляють інтерес (GOI), для апідецинів (GOI1) та абаецину ( GOI2) були розраховані шляхом порівняння співвідношення між експресією генів ведення домашнього господарства та генами, що представляють інтерес, скоригованими на їх ефективність [35,36].
3. Результати
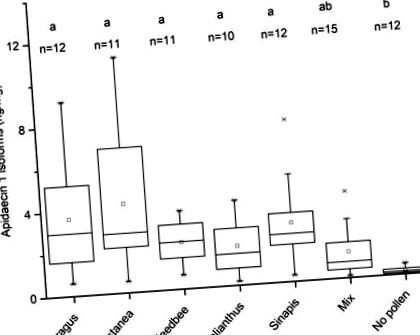
3.1. Вплив дієти на пилок на рівні ізоформ апідецину 1 у бджолиному грудному відділі
Концентрація ізоформ апідецину 1 у грудях бджіл, що перебувають у клітині, що харчуються різними способами харчування. Групи позначені малими регістровими літерами; різні літери позначають суттєві відмінності між групами (незалежні зразки тест Крускала-Уолліса, р 0,05; в одну сторону ANOVA, р> 0,05). Тому ніяких попарних порівнянь не проводилось. Середнє значення концентрації білка становило 65 мкг білка на мг гомогенізованої грудної клітини (95% ДІ: 60–70 мкг/мг) (дані не наведені).
3.2. Вплив дієти пилку на експресію генів апідецину та абацину
Спостерігались різні тенденції щодо експресії гена апідецину та абаецину. Оскільки нормальність розподілу даних в експериментальних групах була відхилена тестом Шапіро-Вілька (р> 0,05), для оцінки відмінностей між експериментальними групами використовували непараметричний тест Крускала-Уолліса та пост-медіанне порівняння. Бджоли, яких годували змішаною пилком та не мали пилку, демонстрували суттєво нижчу експресію гена апідецину порівняно з бджолами, які годували пилок спаржі, синапісу чи кастанеї (рис. 2 А). Суттєвих відмінностей серед бджіл, яких годували пилком геліантусу або FeedBee TM, не спостерігалось, порівняно зі змішаним пилком або відсутністю пилку.
Відносний вираз (A) апідецин та (B) гени абаецину, що харчуються різними дієтами. Групи позначені малими регістровими літерами; різні букви позначають суттєві відмінності між групами (незалежний зразок тест Крускала-Уолліса, p TM, але різниця не була суттєвою для інших груп.
3.3. Співвідношення концентрації ізоформ апідецину 1 у тораках та експресії генів у черевній порожнині
Медіани концентрацій апідецину в грудях будували за медіанами експресії генів у черевній порожнині всіх експериментальних груп (рис.3), і було встановлено просту модель лінійної регресії: y = 0,782 (SE = 0,11448) x Пірсона r = 0,95). Лінійна модель з перехопленням не приймалася, оскільки перехоплення не суттєво відрізнялося від нуля (95% ДІ = -0,76; 0,78).
Співвідношення відносної експресії генів апідецину та рівнів ізоформ апідецину1 у групах бджіл, яких годували різними типами їжі. Окремі бали представляють середні значення кожної групи.
4. Обговорення
Загалом, харчовий білок є необхідною умовою синтезу білка, включаючи утворення ізоформ антимікробного пептиду апідецину 1. Усі дієти білка, крім змішаного, збільшували концентрації ізоформ апідецину 1 у медоносних бджолах порівняно з дієта без пилку (рисунок 1).
Відомо, що оптимальне білкове харчування має забезпечувати збалансований вміст незамінних амінокислот, необхідних для медоносних бджіл [37,38]. Якість монофлорних дієт залежить від того, як вони виконують цю біохімічну потребу. У певній пилку, включаючи геліантову, може бракувати кількох амінокислот, необхідних для харчування медоносних бджіл [39]. З іншого боку, пилок каштана (Castanea spp.) Вважається високою харчовою цінністю для медоносних бджіл [2]. Тут ми показуємо, що бджоли, яких годували пилком Кастанеї, продемонстрували найвищий приріст середнього рівня ізоформ апідецину 1 у грудях порівняно з бджолами, які не годували пилком. Загалом, вважається, що суміші різних пилкових дієт є добрими джерелами поживних речовин для дорослих медоносних бджіл [2,29].
Нещодавні дослідження підтвердили зміни в експресії генів АМФ в межах імунної генної мережі медоносних бджіл у відповідь на основні патогени та паразити бджіл [21,23,43,44]. Однак широко відомо, що рівень експресії генів не обов'язково корелює з рівнем активних пептидних молекул у тканинах бджіл. Це може статися, наприклад, коли трансляція пептиду регулюється мікроРНК [45,46]. Тут ми виявили позитивну кореляцію між експресією гена апідецину в жировому організмі та рівнем апідецину у бджіл (рис. 3). Зосереджені на апідецинах, вони секретуються як препротеїни: апідецин типу 73, тип 22 і тип 14, ці препротеїни секретуються генами Apid73 (ген ID 406115), Apid22 (ген ID 494510) та Apid14 (ген ID 406140). Препротеїни нарешті сплайсируються у три активні ізоформи, виявлені на рівні пептидів: апідецин 1 (ізоформи 1А та 1В), апідецин 2 та один передбачуваний апідецин з бібліотеки кДНК [13,15].
Дієтичні білки необхідні для належної роботи багатьох імунних шляхів медоносних бджіл [47]. Пилковий раціон, який складається з пилкових зерен багатьох різних ботанічних видів, часто вважається найбільш природним і поживним харчуванням для медоносних бджіл [48,49,50]. Попередні дослідження щодо придатності штучного білкового раціону для медоносних бджіл дали суперечливі результати залежно від досліджуваної риси життєдіяльності медоносних бджіл [50,51]. У порівнянні з різними пилковими дієтами, які використовувались у нашому експерименті, не можна виявити вражаючих переваг чи недоліків Feedbee TM на основі оцінених параметрів вродженого імунітету, тобто концентрації ізоформ апідецину 1 та експресії генів апідецинів та абаецину. У нашому дослідженні ми не могли однозначно визначити, чи спостерігається посилення регуляції генів, що кодують абаецин та апідецини, у бджіл, що харчуються харчовими добавками, що містять пилок, чи пояснюється це лише харчовою цінністю білка в раціоні, чи викликається антигенами чи іншими хімічними компонентами. Разом з іншими факторами стресу, що знижують імунокомпетентність медоносних бджіл (наприклад, пестициди), недоїдання може діяти синергічно, впливаючи негативно на імунні шляхи бджіл та здатність захищатись від патогенів [52,53,54].
5. Висновки
Подяка
Ми вдячні Томашу Фюрсту з Палацького університету в Оломоуці за допомогу в статистичному аналізі.
- Чи впливає олігоантигенна дієта на гіперактивних дітей із порушенням поведінки - контрольоване дослідження
- Федеральний апеляційний суд підтверджує; дієта; етикетка не обманливо обіцяє схуднення - ЮРИСТ - Новини
- Вплив антимікробних пептидів у раціонах для розплідника на ефективність росту свиней, вирощених на п’ятьох
- Вплив дієти з низьким вмістом жиру та високим вмістом вуглеводів на збір, виготовлення та тригліцериди ЛПНЩ
- Годування майбутнього Як змінити виробництво їжі та раціон харчування, щоб забезпечити підтримку світового населення