Центральна роль mTOR у ліпідному гомеостазі
Дадлі В. Ламінг
1 Інститут біомедичних досліджень Уайтхеда, Кембридж, МА 02142, США; Департамент біології, MIT, Кембридж, Массачусетс 02139, США; Медичний інститут Говарда Х'юза, Массачусетський технологічний інститут, Кембридж, Массачусетс 02139, США; Широкий інститут Гарварда та Массачусетського технологічного інституту, Сім Кембриджський центр, Кембридж, Массачусетс 02142, США; Інститут інтегративних досліджень раку Девіда Х. Коха при Массачусетському технологічному інституті, Кембридж, Массачусетс 02139, США
Девід М. Сабатіні
1 Інститут біомедичних досліджень Уайтхеда, Кембридж, МА 02142, США; Департамент біології, MIT, Кембридж, Массачусетс 02139, США; Медичний інститут Говарда Х'юза, Массачусетський технологічний інститут, Кембридж, Массачусетс 02139, США; Широкий інститут Гарварда та Массачусетського технологічного інституту, Сім Кембриджський центр, Кембридж, Массачусетс 02142, США; Інститут інтегративних досліджень раку Девіда Х. Коха при Массачусетському технологічному інституті, Кембридж, Массачусетс 02139, США
Резюме
Сигнальний шлях mTOR регулює багато фундаментальних метаболічних та фізіологічних процесів, включаючи ліпідний обмін. Ми досліджуємо останні результати щодо ролі mTOR у ліпідному гомеостазі, з акцентом на нещодавніх висновках моделей in vivo щодо ролі mTORC2 у ліполізі, ліпогенезі та адипогенезі.
Вступ до mTOR
Механістичною мішенню рапаміцину (mTOR) є PI3K-подібна серин/треонін протеїнкіназа, яка еволюційно зберігається у всіх еукаріотів. mTOR міститься у двох комплексах, кожен із різних білкових компонентів, а також субстратів. Комплекс mTOR 1 (mTORC1), гостро чутливий до рапаміцину, регулює такі процеси, як біогенез рибосом, трансляція, що залежить від шапки, біогенез лізосом та аутофагія через субстрати, що включають S6K, 4E-BP1, TFEB1 та Ulk1. Активність mTORC1 частково регулюється сімейством ГТФаз Rag, які сприяють локалізації mTORC1 у лізосомі у відповідь на амінокислоти та глюкозу. У лізосомі mTORC1 активується пов'язаним з GTP ребеком, який сам регулюється комплексом бульбового склерозу (TSC 1/2) у відповідь на сигнали AMPK, кисню та фактора росту. Комплекс mTOR 2 (mTORC2), стійкий до лікування гострого рапаміцину, але може бути порушений хронічним лікуванням рапаміцином у культурі тканин, а також in vivo, чутливий до сигналізації про фактор росту та регулює цілі за рецептором інсуліну/IGF-1 через основи, що включають Akt, SGK та PKCα. Для більш повного лікування регуляції передачі сигналів mTOR у відповідь на поживні речовини, ми звертаємося до читача до недавнього всебічного огляду (Laplante and Sabatini, 2012).
Протягом кількох останніх років спостерігався вибух інтересу до сигнального шляху mTOR, що значною мірою стимулювалось виявленням того, що інгібування передачі сигналів mTORC1 може значно збільшити тривалість життя та захистити від вікових захворювань на моделях мишей (оглянуто в (Lamming et al., 2013)). Генно-інженерні моделі мишей суттєво додали нам розуміння ролі mTOR у фізіології ссавців. Зрозуміло, що сигналізація mTOR регулює ліпідний гомеостаз, оскільки лікування гризунами або людьми рапаміцином призводить до гіперліпідемії та гіперхолестеринемії. Цей міні-огляд буде зосереджений на ролі mTORC1 та mTORC2 у фізіології ліпідів (Рисунок 1А).
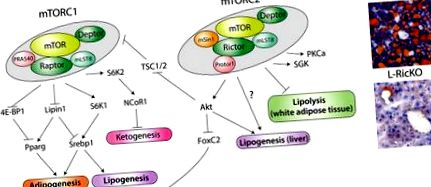
mTOR при ліпідному гомеостазі. А) Модель дії mTORC1 та mTORC2 в ліпідному обміні, включаючи адипогенез, ліпогенез та ліполіз. mTORC1 також контролює кетогенез, який може мати взаємні зв'язки з ліпогенезом, за допомогою NCoR1, але точний механізм регулювання NCoR1 невідомий. Механізм, за допомогою якого mTORC2 регулює ліпогенез та ліполіз, також наразі не відомий, хоча Akt може брати участь у регуляції ліпогенезу. Б) Представницькі зрізи печінки, змазані олійно-червоним О, від мишей дикого типу або печінки Ріктор (L-RicKO) на дієті з високим вмістом жиру протягом 25 тижнів.
Обидва комплекси mTOR відіграють роль в адипогенезі
Деякий час було оцінено, що mTORC1 відіграє роль в адипогенезі. Експерименти з культури тканин, розпочаті в 2001 р., Показали, що інгібування передачі сигналів mTORC1 генетично або за допомогою рапаміцину погіршує адипогенез, тоді як посилення сигналізації mTORC1 за допомогою siРНК проти TSC1/2 сприяє розвитку адипогенезу. Делеція TSC2 також сприяє диференціації адипоцитів (Zhang et al., 2009). Цей ефект частково опосередковується 4E-BP1 через регулювання трансляції PPARγ, але експерименти in vivo також вказують на важливу роль для S6K. Миші-нокаути S6K1 демонструють стійкість до збільшення ваги на дієті з високим вмістом жиру через порушення генерації адипоцитів (Carnevalli et al., 2010). Миші із специфічною для жиру делецією Raptor, яка необхідна для активності mTORC1, фенокопують мишей-нокаутів S6K1 (Polak et al., 2008). Вони легші, худі і стійкі до збільшення ваги на дієті з високим вмістом жиру. Крім того, їх адипоцити як менші, так і менш численні. Це було правдою, хоча експресія хижака була втрачена лише у зрілих адипоцитах. Нарешті, як обговорювалося в наступному розділі, mTORC1 може також регулювати адипогенез частково за допомогою регуляції білків, що зв'язують регулюючі елементи стеролу (SREBP).
Хоча спочатку припускали, що mTORC2 також відіграє певну роль у адипогенезі, оскільки він знаходиться вище за Akt, у початкових дослідженнях нокаутних мишей Rictor, що нокаутують, не спостерігалося дефектів адипогенезу (Cybulski et al., 2009; Kumar et al., 2010) . Однак Яо та його колеги нещодавно виявили роль mTORC2 в адипогенезі (Yao et al., 2013). Вони виявили, що фосфорилювання Akt S473 mTORC2 залежить від взаємодії Akt з фосфорильованим BTSA (білок, що містить домен BSD). Більше того, вони виявили, що BSTA є прямим субстратом mTORC2, а фосфорилювання BSTA сприяє взаємодії з Akt, що призводить до його подальшого фосфорилювання при S473. Ембріональні стовбурові клітини, у яких відсутня BSTA, мають дефектне фосфорилювання Akt S473 і не здатні диференціюватися в адипоцити. Яо та ін. виявив, що це було пов'язано з індукцією фактора транскрипції FoxC2, який пригнічує білий адипогенез, одночасно посилюючи коричневий адипогенез. Поєднання цих досліджень свідчить про те, що mTORC2 може мати важливе значення для раннього адипогенезу, але не впливає на адипогенез при вирізанні на зрілі адипоцити.
Білок, що містить mTOR-взаємодіючий білок DEP (DEPTOR), взаємодіє як з mTORC1, так і з mTORC2 (Peterson et al., 2009). DEPTOR є частиною кількісного локусу ознак, пов’язаного з ожирінням у мишей, і нещодавно було помічено, що надмірна експресія DEPTOR призводить до накопичення білої жирової тканини (Laplante et al., 2012). Підвищена експресія DEPTOR стимулює адипогенез in vitro, частково шляхом активації PPARγ (Laplante et al., 2012). Експресія DEPTOR також знімає негативний вплив mTORC1 на сигналізацію інсуліну, активуючи адипогенні функції Akt. Експресія DEPTOR значно підвищена в жировій тканині людей із ожирінням, що свідчить про те, що цей механізм може зберігатися від миші до людини (Laplante et al., 2012).
Печінковий mTORC1 регулює кетогенез та ліпогенез
Давно відомо, що під час голодування в печінці виробляються кетонові тіла як джерело енергії для периферичних тканин, включаючи мозок. Під час вивчення мишей із специфічною для печінки делецією TSC1, що призводить до конститутивної активації mTORC1, Sengupta et al. спостерігали дефектний кетогенез при голодуванні. Після 24-годинного голодування ці миші мали менше половини рівня загальних кетонів у сироватці крові контрольних мишей (Sengupta et al., 2010). Печінка літніх мишей також має підвищену активність mTORC1 та дефект кетогенезу, який можна виправити делецією печінкового раптору (Sengupta et al., 2010). Хоча механізм був невловимим, вони виявили, що mTORC1 регулює активність PPARα та експресію генів, сприяючи ядерній локалізації NCoR1, корепресора, який взаємодіє з PPARα. Кім та ін. нещодавно визначив, що S6K2, ефектор mTORC1, який є дуже гомологічним до S6K1, регулює ядерну локалізацію NCoR1 (Kim et al., 2012).
У 2008 році Портсманн та його колеги першими визначили роль mTORC1 у ліпогенезі, встановивши, що рапаміцин блокує експресію генів, що беруть участь у ліпогенезі, та погіршує ядерне накопичення білків, що зв'язують регуляторні елементи стеролу (SREBP) (Porstmann et співавт., 2008). Подальша робота Дювела та його колег визначила елемент регулювання стеролу як найбільш збагачений мотив ДНК у дослідженні експресії генів чутливих до рапаміцину генів (Duvel et al., 2010). Хоча точний механізм регулювання SREBP1 та SREBP2 mTORC1 незрозумілий, вважається, що він опосередкований S6K1 (Duvel et al., 2010). Використовуючи невеликий молекулярний інгібітор S6K, Owen et. всі виявляють, що регуляція транскрипції SREBP1c інсуліном не залежить від S6K, тоді як обробка SREBP1c після транскрипції залежить від S6K (Owen et al., 2012).
mTORC1 також може регулювати транскрипційну мережу SREBP за допомогою негативної регуляції ліпіну1 (Peterson et al., 2011). Ліпін1 є субстратом mTORC1 з множинними сайтами фосфорилювання, включаючи як чутливі до рапаміцину ділянки, так і сайти, фосфорильовані mTORC1, які відносно нечутливі до рапаміцину. Фосфорилювання ліпіну1 mTORC1 регулює його субклітинну локалізацію, при цьому фосфорильований ліпін1 знаходиться в цитоплазмі, а дефосфорильований ліпін1 накопичується в ядрі. Ядерний ліпін1 пригнічує транскрипцію генів, залежних від SREBP, зменшуючи рівень ядерних білків SREBP (Peterson et al., 2011). Незважаючи на останні досягнення в розумінні того, як mTORC1 регулює ліпогенез, молекулярні механізми, за допомогою яких S6K або ліпін1 регулюють SREBP, залишаються невідомими. Слід також підкреслити, що передача сигналів mTORC1 є важливою, але недостатньою для активації синтезу SREBP1c та печінкових ліпідів. Миші зі специфічною для печінки делецією TSC1 демонструють підвищену активність mTORC1, але мають дефектну активацію SREBP1c та ліпогенез через ослаблення сигналізації Akt (Yecies et al., 2011). Як обговорюється нижче, передача сигналів через mTORC2 також є важливою для ліпогенезу.
mTORC2, нещодавно визначений регулятор ліпідного гомеостазу
У порівнянні з mTORC1, набагато менше відомо про субстрати та функції mTORC2, як це було виявлено недавно. Найкраще охарактеризовані субстрати mTORC2 є членами сімейства AGC кіназ, включаючи Akt, SGK1 та PKCα. mTORC2 опосередковує активність Akt, безпосередньо фосфорилюючи Akt S473 у відповідь на сигналізацію про фактор росту, а також фосфорилює T450 спільно трансляційно. Оскільки Akt регулює mTORC1 за допомогою фосфорилювання TSC2 і PRAS40, mTORC2 опосередковано регулює mTORC1 у відповідь на сигналізацію про фактор росту. mTORC2 також необхідний для фосфорилювання сайтів на PKCα, а також SGK1. Додаткові субстрати mTORC2 також можуть включати PKCδ і все ще ідентифікуються за допомогою фосфопротеомічних методів.
Регуляція Akt та SGK1 mTORC2 передбачає, що mTORC2 може відігравати вирішальну роль у регуляції метаболізму. Дані C. elegans підтверджують цю концепцію, оскільки глисти Rictor-null мають високий рівень жиру в організмі як на звичайній, так і на жирній дієті (Jones et al., 2009; Soukas et al., 2009). Хоча точний механізм, що лежить в основі цих ефектів, не ясний, звіти як лабораторій Ашрафі, так і Рувкуна погоджуються, що ці ефекти принаймні частково залежать від SGK1 (Jones et al., 2009; Soukas et al., 2009).
Докази щодо ролі mTORC2 у метаболізмі довше надходять через потребу в mTORC2 під час розвитку. Більше того, деякі з перших моделей мишей із специфічною для тканини інактивацією mTORC2, досягнутою за допомогою використання мишей, що експресують умовний алель Rictor, показали мінімальні фенотипи. Бенцінгер та його колеги виявили, що миші, у яких відсутній скелетний м'яз Rictor (M-RicKO), мали нормальну активацію Akt і нормальне фосфорилювання Akt T308, незважаючи на зниження фосфорилювання Akt S473 (Bentzinger et al., 2008). Подальші дослідження ролі mTORC2 в інших тканинах свідчать про те, що, хоча mTORC2 може бути необхідним для активності Akt у м’язах, він необхідний для активності Akt у печінці та жировій тканині (Kumar et al., 2008; Lamming et al., 2012; Yuan та ін., 2012). Хоча роль in vivo mTORC2 у скелетних м'язах не визначена, дані in vitro свідчать про те, що mTORC2 може відігравати роль у опосередкованій рапаміцином опорі інсуліну скелетних м'язів (Ye et al., 2012).
Жировий mTORC2 регулює ліполіз
Специфічна для жиру інактивація mTORC2 була досліджена незалежно двома групами, з більшою мірою подібними висновками. Депіляція мишей Rictor (A-RicKO) мишами, що мають специфічну для жиру тенденцію, стають дещо важчими, із суттєво збільшеною сухою масою (Cybulski et al., 2009). На дієті з високим вмістом жиру ці тенденції перебільшуються, оскільки печінка mTORC2-жирових нокаутованих мишей важить на 75% більше, ніж печінка контрольних мишей через 10 тижнів на дієті з високим вмістом жиру (Cybulski et al., 2009). Збільшення маси цих печінок частково було зумовлене значним підвищенням рівня печінкових тригліцеридів порівняно з контрольними мишами із супутнім збільшенням стеатозу печінки.
У той час як Цибульський та його колеги виявили, що миші A-RicKO є толерантними до глюкози, Кумар та його колеги виявили, що миші, що вибивають жирову клітковину mTORC2, досить сильно не переносять глюкозу (Kumar et al., 2010). Ця очевидна розбіжність у висновках легко пояснюється різним віком мишей, оскільки Кумар досліджував відносно старих мишей (віком понад 9 місяців). У цьому віці миші A-RicKO демонстрували стійкість до інсуліну як жирової, так і скелетної мускулатури, ймовірно, через значне відкладення ліпідів у скелетних м’язах (Kumar et al., 2010). Кумар та його колеги також виявили посилення печінкового відкладення ліпідів та стеатоз у молодих та старих печінок мишей A-RicKO. Ці результати свідчать про те, що багато метаболічні наслідки порушення mTORC2 в жировій тканині обумовлені відкладенням ліпідів в інших тканинах.
Цікаво, що Кумар та його колеги виявили, що mTORC2 регулює інсуліноподібне придушення ліполізу в жировій тканині. Ліполіз, розпад ліпідів на вільні жирні кислоти, зазвичай слід придушувати поживними речовинами, але це не відбувається у мишей A-RicKO (Kumar et al., 2010). Більше того, миші A-RicKO мають високий рівень FFA, що вказує на те, що відсутність активності mTORC2 призводить до вищих базальних рівнів ліполізу. Хоча механізм ще не повністю відпрацьований, mTORC2 може нормально регулювати ліполіз, інгібуючи активацію РКА. За відсутності mTORC2 РКА активується і фосфорилює гормоночутливу ліпазу, активізуючи її ліполітичну активність (Kumar et al., 2010). Нарешті, mTORC2 може також сприяти засвоєнню глюкози в жировій тканині, оскільки миші, що вибивають жирову клітковину mTORC2, зменшують споживання глюкози (Kumar et al., 2010). Однак це потребуватиме подальших досліджень, оскільки дорослі миші, у яких Риктор виснажений у всьому організмі, демонструють підвищене поглинання глюкози в жирову тканину, що виснажується Ріктором (Lamming et al., 2012).
Печінковий mTORC2 регулює ліпогенез
За минулий рік було засвоєно кілька захоплюючих уроків про роль mTORC2 у печінковій тканині завдяки використанню мишей із специфічною для печінки делецією Rictor (L-RicKO). Одним з найвідоміших фенотипів цих мишей є печінкова резистентність до інсуліну, що призводить до посилення глюконеогенезу (Lamming et al., 2012). Однак, хоча печінкова резистентність до інсуліну часто пов’язана з жировою печінкою, миші L-RicKO насправді захищені від жирової печінки, спричиненої дієтою (Hagiwara et al., 2012; Yuan et al., 2012). Хагівара та його колеги відзначали, що на додаток до посиленого глюконеогенезу, гепатоцити мишей L-RicKO знижують поглинання глюкози, ймовірно, в результаті зниження експресії глюкокінази. Більше того, у мишей L-RiKO знижений рівень тригліцеридів, і Хагівара та його колеги, а також Юань та його колеги висунули теорію, що mTORC2 необхідний для печінкового ліпогенезу.
Дійсно, обидві групи виявили, що стимульований інсуліном печінковий ліпогенез суттєво порушений у мишей L-RicKO. За відсутності mTORC2 печінкова експресія багатьох ключових генів синтезу ліпідів, включаючи ацетил-КоА-карбоксилазу та синтазу жирних кислот, була знижена на 50% і більше (Hagiwara et al., 2012; Yuan et al., 2012). Миші L-RicKO також мають знижену печінкову експресію SREBP1c та PPARγ. Цікаво, що миші L-RicKO також мають підвищену експресію генів, пов’язаних з окисленням жирних кислот, включаючи PPARα, і знижену експресію генів поглинання жирних кислот. Отже, відсутність печінкових ліпідів у печінці з дефіцитом mTORC2, ймовірно, зумовлена комбінацією зниженого синтезу ліпідів, зменшення споживання ліпідів та збільшення споживання ліпідів.
Висновки
mTOR є центральним регулятором ліпідного обміну, регулюючи не тільки ліпогенез і ліполіз, але й адипогенез. Зовсім недавно mTORC2, зокрема, став ключовим контролером ліпідного обміну, регулюючи ліпогенез у печінці, ліполіз у білій жировій тканині та керуючий адипогенез. Ці висновки узагальнені на малюнку 1А. З клінічної точки зору, розвиток mTORC1-специфічних інгібіторів може значно зменшити побічні ефекти, пов'язані з рапаміцином. Специфічне інгібування mTORC2 може призвести до реальних успіхів у лікуванні ожиріння та неалкогольної жирової хвороби печінки (НАЖХП). Як показано на малюнку 1B, видалення печінкового ріктора, що призводить до інгібування передачі сигналів mTORC2, забезпечує значний захист від жирової печінки, спричиненої дієтою.
Клінічно інгібування печінкового mTORC2 може сприяти метаболізму надлишку печінкових ліпідів, тоді як інгібування mTORC2 під час диференціації адипоцитів може сприяти збільшенню коричневої жирової тканини. Обидва ці властивості потенційно можуть бути вигідними з точки зору лікування ожиріння. Однак побічні ефекти інгібування mTORC2, включаючи печінкову резистентність до інсуліну, що може пояснювати підвищену частоту діабету, що почався у пацієнтів, які отримують рапаміцин, свідчить про те, що безпосереднє інгібування mTORC2 буде небажаним. Визначення остаточних механізмів після mTORC2, що регулюють ліпідний обмін, та утворення нових сполук, які безпосередньо впливають на ці механізми, не порушуючи гомеостаз глюкози, буде життєво важливим для безпечного перекладу цих результатів у клініку.
Подяка
Ми хотіли б подякувати Лірону Бар-Пеледу, Джозефу Бауру та Матьє Лапланте за критичне читання рукопису, Тому ДіСезаре за допомогу в графічному дизайні та всім членам лабораторії Сабатіні за підтримку. DWL підтримується нагородою K99/R00 від NIH/NIA (> AG041765). DMS є слідчим медичного інституту Говарда Хьюза.
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- Енн Хетеуей за раз набрала вагу, але додає, що я обережна в своїх похвалах щодо
- Річні зміни в антиоксидантному захисті печінки та перекисному окисленні ліпідів у помірних риб,
- Енн Хетеуей тонко сказали, щоб вона схудла за роллю у віці 16 років - Е! Інтернет
- Антонія Кемпбелл-Хьюз попереджала, що Голодний за роль у фільмі може вбити вас - Daily Star
- 10 порад, як уникнути літнього саботажу дієти, вправи West Central Tribune