Candida albicans холецистит з асоційованим гепатитом у кота
Шеннон М Палермо
1 Ветеринарні спеціалісти та аварійні служби, Рочестер, Нью-Йорк, США
Ешлі Ш Ньюман
2 Коледж ветеринарної медицини, Корнельський університет, Ітака, Нью-Йорк, США
Michael W Koch
1 Ветеринарні спеціалісти та аварійні служби, Рочестер, Нью-Йорк, США
Анотація
Резюме справи
3-річного чоловіка кастрованого домашнього короткошерстого кота було представлено через блювоту, відсутність апетиту та жовтяницю. Біохімічні результати та результати УЗД відповідали холестазу та можливій обструкції жовчних шляхів. Діагноз холециститу Candida albicans з асоційованим гепатитом був поставлений після цитологічного дослідження та грибкового посіву. Прогресуюча гіпербілірубінемія та печінкова енцефалопатія в кінцевому підсумку мали летальний результат.
Актуальність та нова інформація
Наскільки нам відомо, це перший звіт про жовчний кандидоз, діагностований при цитологічному дослідженні зразка холецистоцентезу у свійської тварини без ознак імунодефіциту. Крім того, це перший зареєстрований випадок грибкового холециститу з асоційованим синдромом білої жовчі через обструктивний холестаз, без явного мукоцеле жовчного міхура.
Вступ
Види Candida - це нормальна флора харчового тракту, верхніх дихальних шляхів та нижніх сечостатевих шляхів як людей, так і тварин у всьому світі. Незважаючи на те, що у людей повідомлялося про інфікування внаслідок порушення слизового бар'єру, інфікований антибіотиками надмірний ріст та імуносупресія, первинна інфекція та вторинні ускладнення рідко реєструються у котів та собак. 1 –4
Механізми, за допомогою яких види Candida прилипають і колонізують поверхні слизової, добре описані; 1 однак, щоб викликати хворобу, повинні бути порушені нормальні захисні механізми господаря. Умови прийому, що підвищують ризик системного кандидозу, включають попередню терапію глюкокортикоїдами, антибіотикотерапію, виразку шлунково-кишкового тракту, пов’язану з попередньою терапією нестероїдними протизапальними препаратами (НПЗЗ), імунодепресивні препарати, постійні або внутрішньовенні катетери, сечові катетери та цукровий діабет. 2–4 Зафіксовані випадки кандидозу у собак та котів з ослабленим імунітетом стосуються нижніх відділів сечовивідних шляхів та порожнини очеревини, 2,3, а нещодавно - шлунково-кишкового тракту імунокомпетентної кішки. 5 У цьому звіті докладно викладено перший відомий випадок холециститу Candida albicans у кота без ознак імунодефіциту.
Опис справи
3-річного кастрованого домашнього короткошерстого кота було скеровано до нашого закладу для розслідування причин гострого початку жовтяниці. Як повідомляється, пацієнт не мав істотних історій хвороби в минулому, раніше був негативним до ретровірусу і жив як у приміщенні, так і на відкритому повітрі. Кіт був в курсі щеплень, але не отримував жодного запобіжного засобу від дирофілярії, блох та кліщів. Протягом 24 годин, що передували передлежанням, у пацієнта розвинулася гостра блювота, відсутність апетиту, млявість та жовтяниця. Під час пред'явлення пацієнт мав тупий вигляд, але реагував на подразники та мав нормальні життєві параметри.
Повний аналіз крові (CELL-DYN 3500; Abbott Diagnostics) не був помітним. Панель хімічної сироватки (AU480; Бекман Коултер) та аналіз сечі (VetStix 11) виявили помітну гіпербілірубінемію (12,2 мг/дл; контрольний інтервал [RI] 0–0,9 мг/дл) з білірубінурією (6 мг/дл), помірно підвищена лужність активність фосфатази (ALP) (205 ОД/л [RI 0–60 ОД/L]) та поміркована гіперхолестеринемія (337 мг/дл [RI 80-250 мг/дл]), що свідчить про холестаз. Були дані про пошкодження печінки, враховуючи помітно підвищену активність аланінамінотрансферази (ALT) (1863 U/L [RI 0–100U/L]) та помірно підвищену активність аспартатамінотрансферази (AST) (586 U/L [RI 0–60 U/L]). Була легка гіпонатріємія (144 мекв/л [RI 148–160 мекв/л]) з непропорційно помірною гіпохлоремією (104 ммоль/л [RI 115–126 ммоль/л]), що свідчить про втрати рідини та гіпохлоремічний метаболічний алкалоз, що було пов’язано з блювотою пацієнта. Панель коагуляції (Amelung KC4A; Sigma Diagnostics) виявила незначно подовжений частковий час тромбопластину (23,3 с [RI 10–17 с]) та нормальний протромбіновий час. Серологічна оцінка вірусу імунодефіциту котів (FIV) та вірусу лейкемії котів (FeLV) була негативною (потрійний тест SNAP FIV/FeLV/HW; IDEXX).
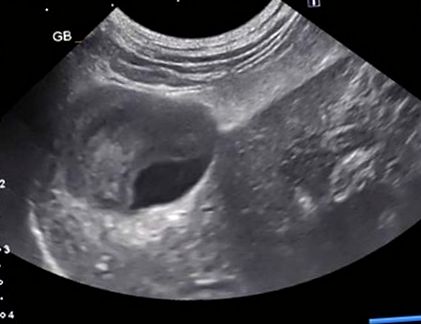
Початкова ультрасонографія черевної порожнини була проведена протягом 24 годин після прийому і виявила різноманітно організований безехогенний до гіперехогенний матеріал у просвіті жовчного міхура (рис. 1). Шлях загальної жовчної протоки не міг пройти до сосочка дванадцятипалої кишки через втручання, спричинене затемненням шлунково-кишкового газу, а також запалення навколишньої брижі, що призводить до ослаблення ультразвукового пучка. Ліва кінцівка підшлункової залози була гіпоехогенною, з прилеглим гіперехогенним жиром. Випоту або вільного газу не відзначено, а решта живота була непримітною. Рентгенограми грудної клітки були в межах норми.
Репрезентативне ультразвукове зображення варіабельно організованих гіперехогенних та безехогенних уламків у просвіті жовчного міхура (ГБ)
Пацієнту розпочато антимікробну терапію, що складається з ампіциліну сульбактаму (22 мг/кг внутрішньовенно через 8 годин [Unasyn; Pfizer]) та енрофлоксацину (5 мг/кг внутрішньовенно протягом 24 годин [Baytril; Bayer DVM]), а також ондансетрону (0,5 мг/кг IV q12h [Ondansetron Accord; Accord Healthcare]) для протиблювотного засобу. Бупренорфін (0,01 мг/кг внутрішньовенно внутрішньовенно через 8–12 годин [Бупренекс (бупренорфін гідрохлорид) для ін’єкцій; Fresenius Kabi USA]) також додавали для знеболення. Через сорок вісім годин після первинного передлежання гіпербілірубінемія пацієнта погіршилась (23 мг/дл); однак клінічне поліпшення було відзначено, оскільки пацієнт виглядав світлішим, комфортнішим при пальпації живота і добре харчувався. Рекомендовано продовження госпіталізації; однак власники вирішили відвезти пацієнта додому для подальшого спостереження.
Через два дні пацієнта повторно представили для повторного аналізу крові та аналізу на анорексію. Панель хімічної сироватки виявила прогресуючу гіпербілірубінемію (26,4 мг/дл) та погіршення гіпохлоремічного метаболічного алкалозу (хлорид 99 ммоль/л, натрій 143 мекв/л) та гіпокаліємію (3,2 мЕкв/л [RI 3,5–5,5 мЕкв/л]), ймовірно через анорексію. Повторне УЗД черевної порожнини виявило здебільшого гіперехогенний, організований матеріал проти межі безехогенного вмісту в просвіті жовчного міхура (рис. 1). Кістозна протока була аномально розширена на 2,9 мм, а загальна жовчна протока була звивистою і важкою для простеження. Дистальна частина загальної жовчної протоки вимірювалась 5,0 мм при її закінченні, де нормальний діаметр загальної жовчної протоки у котів дорівнював 6.
Наступного дня пацієнтові проводили седацію буторфанолом (0,2 мг/кг внутрішньовенно [Долорекс; Здоров’я тварин Merck]) та пропофолом (5 мл/кг внутрішньовенно [ПропоТезія; Генрі Шейн, здоров’я тварин]), а загальну анестезію підтримували ізофлураном та киснем . Аспірати печінки та холецистоцентез під контролем ультразвуку проводили за допомогою голки 22 G 1 дюйм з подальшим розміщенням езофагостомічної трубки (e-tube) (14 Fr Mila). Рідина, отримана при холецистоцентезі, була дуже білою та непрозорою. Розміщення езофагостомічної трубки відбулося без інцидентів, і пацієнт почав отримувати третину потреби у спокої в енергії у спокої через електронну трубку з клінічною підтримкою Clinicare (Abbott). Наступного ранку в просвіті електронної трубки була виявлена нематода невідомого типу (передбачуваний вид Ollanulus tricuspis або Physaloptera). Зразок калу не вдалося отримати для паразитарної оцінки, і пацієнт виписаний 3-денним курсом фенбендазолу (Panacur; Merck).
У пофарбованому мазку Райта, отриманому від холецистоцентезу, відсутній типовий цитологічний вигляд жовчі, яка, як правило, від клітин до погано клітин із зернистим до аморфного фіолетово-сірим фоном. 7,8 Натомість фон мав туманну білково-мукоїдну якість із помірною кількістю крові. Лейкоцити, що складаються здебільшого з слабо вироджених нейтрофілів, здавалося, зросли порівняно з очікуваним внеском крові. Низька кількість округлих до овальних, приблизно 2 х 5–7 мкм, темно-синіх дріжджових організмів з тонким прозорим ореолом була присутня позаклітинно і рідко фагоцитувалась у нейтрофілах (рис. 2а, б). Псевдогіф або гіфальних форм не спостерігалося. Жодних епітеліальних клітин не було. Рідкісні нейтрофіли містили фагоцитований синій матеріал, що свідчить про муцин (рис. 2в). Цитологічною інтерпретацією було легке гнійне запалення з інтралезійними дріжджовими організмами. Морфологічний вигляд дріжджових організмів наводив на думку про види Candida, і для підтвердження рекомендували культуру грибів.
Репрезентативне зображення прямого мазка з рідини, отриманого при холецистоцентезі. (а) Легко вироджений нейтрофіл з двома позаклітинними округлими до овальних, приблизно 2 х 5–7 мкм, глибоко-синіми дріжджовими організмами з тонким прозорим ореолом. (b) Легко вироджений нейтрофіл, що містить фагоцитований дріжджовий організм. Морфологічний вигляд дріжджових організмів свідчив про види Candida, що згодом було підтверджено на культурі грибів. (c) Невироджений нейтрофіл, що містить фагоцитований аморфний синій матеріал, що вказує на муцин. Пляма Райта, об'єктив Х 100, бар = 20 мкм
Репрезентативне зображення тонкоголового аспірату печінки. Поодиноке однорідне скупчення кубоїдальних до низьких стовпчастих клітин епітелію, що трактується як жовчне за походженням. Зверніть увагу на аморфний блідо-блакитний матеріал, який інтерпретується як муцин, у цитоплазмі клітин. Цей матеріал не є звичайною знахідкою в жовчному епітелії, розглядається як випадкова знахідка у аспіратів печінки, і свідчить про надмірне утворення слизу та/або пригнічення. Пляма Райта, об'єктив Х 50, бар = 50 мкм
Репрезентативне зображення тонкоголового аспірату печінки. Гепатоцити та збільшена кількість нероджених нейтрофілів потрапляють у пухкі потоки та щільні спіралі блідо-до темно-синього муцинозного матеріалу. Цей муциновий матеріал є ненормальною знахідкою у печінкових аспіратів і наводить на думку про «білу жовч», як це можна побачити при мукоцеле жовчного міхура. Відзначається, що гепатоцити демонструють помірний анізоцитоз та анізокаріоз та підвищену цитоплазматичну базофілію, що трактується як регенеративна реакція на запалення. Низька кількість прозорих дискретних вакуолей, що відповідає ліпідам, також видно в гепатоцитах. Пляма Райта, об'єктив Х 50, бар = 50 мкм
Цитологічна інтерпретація полягала у помірному та помірному змішаному (нейтрофіли, лімфоцити, плазматичні клітини та макрофаги) запаленні, слабкому накопиченні ліпідів та ймовірній гіперплазії жовчі. Хоча аденому жовчних шляхів, цистаденому або добре диференційовану карциному не можна виключати, це вважалося малоймовірним, враховуючи відсутність повідомлених вузлових та/або масових уражень печінки. Гіперплазії жовчних шляхів сприяли, враховуючи їх добре диференційований вигляд та одночасну наявність запалення. 9 Цитологічна атипія, зафіксована в гепатоцитах, інтерпретувалася як реактивна, ймовірно, репрезентативна регенеративна реакція в печінці, вторинна до наявного запалення. Рясний мукоїдний матеріал у зразку є ненормальним виявленням для печінкових аспіратів, і підвищується можливість появи „білої жовчі”, як повідомлялося при мукоцеле жовчного міхура та позапечінковій обструкції жовчних шляхів. Для підтвердження цих висновків було рекомендовано гістопатологічне дослідження.
Пацієнт продовжував добре переносити годування через е-зонд, але почав систематично зменшуватися. Через десять днів після первинного передлежання було виявлено, що кішка була в’яленою та гіпотензивною (систолічний артеріальний тиск 40–96 мм рт. Ст.). Перевірка об'єму упакованих клітин виявила анемію (20% [RI 24–45%]), а хімія повторної перевірки виявила прогресуючу гіпербілірубінемію (33,8 мг/дл) та стійке підвищення рівня печінкових ферментів (ALT 1486 U/L, AST 663 U/L, гамма-глутамілтрансфераза 17 ОД/л, ALP 241 ОД/л). Також була нещодавно задокументована гіперамонемія з легким голодуванням (128 мкмоль/л [RI 0–100 мкмоль/л]), яка разом із клінічними показниками та результатами хімії підтримувала печінкову енцефалопатію. Повторний холецистоцентез під контролем ультразвуку проводили без седації, використовуючи голку 22 Г, 1 дюйм, щоб отримати зразок для культури грибів. Пізніше того ж вечора пацієнт пережив зупинку серцево-дихальної системи. Культура грибів виростила ізолят C albicans (Центр діагностики здоров’я тварин Корнельського університету).
Обговорення
Наскільки нам відомо, це являє собою перший звіт про жовчний кандидоз у тварини-компаньйона. Не було жодних доказів імунодефіциту, у пацієнта був негативний вплив на ретровірус і не було виявлено жодної основної причини, що вела б до кандидозної інфекції. Історично склалося так, що пацієнт був здоровим у здоровому стані до 24 годин до передлежання, що робило невизначений схильний стан малоймовірним. Коту також не було в анамнезі прийому антибіотиків, НПЗЗ або глюкокортикоїдів. Поки в просвіті езофагостомічної трубки була виявлена нематода, фекальна оцінка виявилася неможливою для виявлення паразитарної інфекції. Незрозуміло, чи могло це бути випадковим виявленням для пацієнта чи може бути основним захворюванням шлунково-кишкового тракту.
Можливі причини кандидозу пацієнта включають дисбактеріоз кишечника та жовчний рефлюкс вмісту кишечника. Подібно до патогенезу бактеріального холангіту, не виключено, що комменсальна кишкова кандида дозволила рефлюксувати через загальну жовчну протоку і колонізувати жовчний міхур пацієнта. Унікальний для котячої анатомії загальний жовчний проток і протока підшлункової залози з’єднуються перед тим, як влитися в дванадцятипалу кишку у великому сосочку дванадцятипалої кишки. Крім того, порушення функції кишкового бар’єру може також призвести до транслокації кишкових бактерій до підшлункової залози та печінки. 13 Це було підтверджено в ряді досліджень, що використовують як бактеріальні культури, так і флуоресцентну гібридизацію in situ для виявлення кишкових бактерій у підшлунковій залозі, печінці та жовчі котів з холангітом або холангіогепатитом. 14–16 Порівняно з собаками, у кішок також спостерігається більший вміст бактерій в дванадцятипалій кишці, що може додатково схилити пацієнтів котів до рефлюксу та холангіту. 17 Передбачувана нематода, виявлена в просвіті е-трубки пацієнта, також могла діяти як фактор ризику жовчного рефлюксу та подальшого жовчного кандидозу.
Види Candida можуть утворювати гіфи, які діють як фактор вірулентності, асоційований з інфекцією, дозволяючи вторгнення епітеліальних клітин, що призводить до пошкодження тканин. 18 Крім того, було показано, що наявність жовчних кислот сприяє вірулентності Candida. 19 Вірулентність видів Candida також може бути збільшена у випадках зміненого жовчного потоку і, зокрема, при обструктивних процесах захворювання. Можливо також, що організуючий внутрішньосвітловий уламок жовчного міхура міг представляти розвивається мукоцеле, що підтверджується аномальним загальним виглядом жовчної рідини при аспірації. Повідомляється про синдром білої жовчі у пацієнтів із позапечінковою обструкцією жовчних проток, у яких жовчний епітелій продовжує виділяти слиз, незважаючи на застій жовчного потоку через обструкцію на рівні кістозної протоки. 20,21 У людини присутність білої жовчі асоціюється з меншим часом виживання у пацієнтів із злоякісною жовтяницею. 22 Хоча у котів рідко повідомляється про мукоцеле, 23–25 раннє утворення мукоцеле, що спричиняє обструкцію жовчних шляхів, могло призвести до холестазу та умовно-патогенної інвазії видів Candida з кишкового тракту у пацієнта, про який повідомляється тут.
Висновки
Ми описуємо перший звіт про жовчний кандидоз у свійської тварини, а також перший зареєстрований випадок грибкового холециститу з асоційованим синдромом білої жовчі через обструктивний холестаз. Цей випадок наголошує на важливості проведення холецистоцентезу для цитологічного обстеження у пацієнтів з гіпербілірубінемією та холестазом, особливо якщо лікування емпіричною антибіотикотерапією не вдалося. Крім того, хоча кандидоз добре задокументований у пацієнтів із ослабленим імунітетом, цей випадок викликає підозру щодо ролі збудника у первинних процесах захворювання.
Виноски
Прийнято: 29 квітня 2019 р
Конфлікт інтересів: Автори не заявили про потенційний конфлікт інтересів щодо досліджень, авторства та/або публікації цієї статті.
Фінансування: Автори не отримали фінансової підтримки для дослідження, авторства та/або публікації цієї статті.
Етичне схвалення: Ця робота передбачала використання лише тварини, що належить клієнту, і слідувала встановленим міжнародно визнаним високим стандартам („найкраща практика“) індивідуального ветеринарного клінічного обслуговування пацієнтів. Тому етичне схвалення комітету не потрібно.
Інформовану згоду: Для будь-яких тварин чи людей, яких можна ідентифікувати в цій публікації, від осіб, які беруть участь, була отримана інформована згода на їх використання у публікації (усна чи письмова).
- Candida Diet Bv Candida Albicans Причини хвороб - теорема Конгредіора
- Candida Albicans Книга Леона Чейтува Офіційна сторінка видавця Саймон; Шустер
- Новонароджений; s жирова маса пов'язана з ожирінням як дошкільнята, виявляє дослідження (оновлення 1) 104
- Антибіотики та надмірний ріст кандиди при дисбіозі кишечника - манекени
- Накопичення жиру в животі, а не резистентність до інсуліну, пов’язане з олігоменореєю у