Брусниця (Vaccinium vitis-idaea Л.) Виявляє протидіабетичну активність у мишачої моделі ожиріння, спричиненого дієтою
1 Лабораторія природних продуктів здоров'я та метаболічних захворювань, кафедра фармакології, Монреальський університет, станція Центр-Віль, П.О. Box 6128, Монреаль, QC, Канада
2 Лабораторія фітохімії, лікарських рослин та етнофармакології, Департамент біології, Університет Оттави, Оттава, Онтаріо, Канада
3 дослідницькі групи канадських Інститутів охорони здоров’я з антидіабетних препаратів аборигенів та Центр досліджень діабету в Монреалі, Канада
4 Кафедра фармакогнозії, Університет Бені-Суеф, Бені-Суеф 62511, Єгипет
Анотація
1. Вступ
Ожиріння є складним і багатогранним розладом. Враховуючи сучасний рівень глобальної епідемії та міцний зв’язок із небезпечними для життя хворобами, такими як діабет, серцево-судинні та ракові захворювання, потреба у профілактиці або лікуванні ожиріння та його ускладнень стає більш актуальною.
Інсулінорезистентність зазвичай передує розвитку діабету 2 типу і частіше зустрічається у людей із ожирінням. У скелетних м’язах інсулін сприяє засвоєнню глюкози шляхом активації шляху фосфатидилінозитол-3-кінази (PI3-K)/Akt та індукування транслокації транспортера глюкози GLUT4 з внутрішньоклітинних везикул до плазматичної мембрани [1]. Альтернативним шляхом стимулювання поглинання глюкози є шлях АМФ-активованої протеїнкінази (АМФК). AMPK стимулює транслокацію GLUT4 до плазматичної мембрани за допомогою механізму, відмінного від шляху PI3-K, стимульованого інсуліном [2]. Слід зазначити, що AMPK посилює експресію GLUT4, можливо, шляхом прямого фосфорилювання транскрипційного коактиватора PPARγ коактиватор-1α (PGC-1α). З іншого боку, активація АМФК зменшує накопичення ліпідів у внутрішньоміоцитах і підвищує чутливість м’язів до інсуліну за рахунок фосфорилювання та інгібування ацетил-КоА карбоксилази (АСС) [3, 4].
У печінці AMPK зменшує вироблення печінкової глюкози, головним чином, пригнічуючи експресію глюконеогенних генів, таких як фосфоенолпіруваткарбоксилаза (PEPCK) та глюкоза 6-фосфат (G-6-Pase). Більше того, активація AMPK стимулює окислення жирних кислот і пригнічує експресію генів, що кодують ліпогенні ферменти (синтазу жирних кислот та АСС) [5].
SIRT1 - ще один важливий фактор енергетичного гомеостазу ссавців. Це нікотинамід-аденин-динуклеотид- (NAD + -) залежна деацетилаза та член сімейства сіртуїнів ссавців. SIRT1 контролює різноманітні клітинні процеси, такі як апоптоз, клітинний цикл та метаболізм шляхом деацетилювання цільових білків, включаючи p53, NFkB та PGC-1.α. Він активується завдяки голодуванню та обмеженню калорій, а також багатьом дрібним молекулам, таким як рослинні феноли кверцетин, піцеатанол та ресвератрол. Повідомлялося, що активація SIRT1 покращує гомеостаз глюкози, підвищує чутливість до інсуліну та покращує функції мітохондрій у скелетних м’язах моделей гризунів діабету 2 типу [6]. І навпаки, активація SIRT1 у печінці збільшує глюконеогенні гени та пригнічує гліколіз, що припускає, що SIRT1 індукує орган-специфічні метаболічні відповіді. Подібно до скелетних м’язів, активація SIRT в печінці сприяє окисленню жирних кислот та запобігає індукованому дієтою стеатозу печінки та резистентності до інсуліну [7].
Нарешті, рецептор активованого проліфератором пероксисоми-α (PPAR-α) належить до надродини ядерних рецепторів PPAR і сильно експресується в тканинах з активним жировим обміном, таких як печінка, серце та скелетні м’язи. PPAR-α індукує експресію генів, що контролюють β-окислення жирних кислот.
Цукровий діабет 2 типу досягнув безпрецедентних масштабів серед населення аборигенів у всьому світі. У Канаді за останні кілька десятиліть показники зросли в геометричній прогресії вище середнього по країні і, як очікується, будуть продовжувати зростати. Наприклад, поширеність діабету серед народів Кри Ію Ішті (ЦЕІ), що населяють східну частину затоки Джеймс-Бей на півночі Квебеку, за той самий проміжок часу потроїлася серед дорослих людей старше 20 років [8]. Для вирішення цієї серйозної проблеми охорони здоров’я, з якою стикаються канадські Перші Нації, зокрема ЦЕІ, наша дослідницька група мала на меті визначити культурно значущі методи лікування діабету в рамках їх традиційної фармакопеї.
Брусниця (V. vitis-idaea) належить до сімейства рослини Ericaceae і тісно пов’язана з чорницею висококущовою (Vaccinium corymbosum L.) та журавлиною (V. macrocarpum Л.) [9]. Ягоди їстівні і використовуються в Північній Європі для виготовлення варення, соусів та інших продуктів [10]. Вони також традиційно використовуються як їжа корінними народами Канади, де їх їдять сирими, тушкованими та подають до риби чи м’яса або змішують з вареними рибними яйцями, печінкою та жиром [11, 12]. Крі використовує ягоди як народну медицину для лікування частого сечовипускання та інших симптомів діабету [13, 14].
У попередньому дослідженні ми повідомляли, що етанольний екстракт ягід V. vitis-idaea виявив цікаві властивості посилення поглинання глюкози в культивованих клітинах скелетних м’язів C2C12 завдяки активації AMPK [15]. У цій роботі ми оцінили ефект V. vitis-idaea екстракт на мишачій моделі ожиріння, спричиненого дієтою (DIO), що точно імітує метаболічний синдром людини та ранній діабет 2 типу, пов’язаний із нездоровим способом життя. Найбільш вивченою експериментальною моделлю DIO є штам миші C57Bl/6J. Цей штам стає ожирінням, резистентним до інсуліну та гіперглікемічним при харчуванні з високим вмістом жиру [16]. Крім системних параметрів гомеостазу глюкози та ліпідів, ми також звернули увагу на основні тканинні компоненти інсулінозалежних та незалежних шляхів, описані раніше.
2. Матеріали та методи
2.1. Рослинні матеріали
Ягоди V. vitis-idaea були зібрані в районі Східної Джеймс-Бей, штат Каліфорнія, Канада, згідно традиційних процедур (сезон, час доби, місцезнаходження та подарунок подарунків) за вказівкою старійшин Кри. Їх тримали в сухому холодному місці до використання. Ботанічну ідентичність підтвердив д-р Ален Кур'є (Інститут досліджень біології вегетації, Університет Монреаля), а зразки ваучерів були здані в Гербарій ботанічного саду Монреаля (номер ваучера Whap04-21). 80% -ний етанольний екстракт готували, як описано раніше [17], дотримуючись стандартних операційних процедур лабораторії професора Арнасона.
2.2. Тварини і В природних умовах Експериментальні протоколи
Чотиритижневі самці мишей C57BL/6 були придбані у Charles River (St-Constant, QC). Після аклімації мишей випадковим чином розділили на п'ять груп (
кожен) і починали із звичайної чау-їжі (контрольна група CHOW) або дієти з високим вмістом жиру (35% жиру, 20% білка та 36,5% вуглеводів, Bio-Serv, Frenchtown, NJ, USA). Через 8 тижнів на цих дієтах миші, що годували HFD, страждали ожирінням та не мали стійкості до інсуліну. Вони важили в середньому 31,78 г ± 2,71, тоді як їхні колеги, що харчувалися CHOW, важили
g. На цей момент одна група мишей, що годувались HFD, служила контролем DIO (продовження прийому HFD ще 8 тижнів), тоді як інші три групи мишей, що годували HFD, отримували V. vitis-idaea екстракт у 3 дози (125, 250 та 500 мг/кг), включений у HFD протягом іншого періоду 8 тижнів.
Вага тіла, споживання їжі, споживання води та рівень глюкози в крові вимірювались у тварин, що не голодували, 2-3 рази на тиждень протягом усього дослідження. Кров хвоста збирали для визначення глюкози за допомогою глюкометра (Accu-Check Roche, Montreal, QC). В кінці дослідження лікування тварин забивали, а різні тканини збирали, зважували та обробляли для подальшого аналізу. Усі процедури та експериментальні протоколи були затверджені Комітетом з питань етики експериментів з тваринами Університету Монреаля та дотримувались керівних принципів Канадської ради з догляду та захисту тварин.
2.3. Вимірювання зразків плазми
Тригліцериди плазми, загальний холестерин, ЛПНЩ, ЛПВЩ, аланінамінотрансфераза (ALT), аспартатамінотрансфераза (AST), лужна фосфатаза та креатинін оцінювались за допомогою стандартних протоколів клінічної біохімії в дитячій лікарні Сент-Жюстіна (Монреаль, Квебек).
Інсулін вимірювали за допомогою набору для радіоімунологічного аналізу (Linco; St-Charles, MO), тоді як адипонектин і лептин вимірювали за допомогою наборів ELISA (Millipore, St-Charles, MO).
2.4. Гістологічна оцінка
Зразки печінки, отримані від кожної миші, фіксували у 10% розчині формаліну, вкладали у парафін, розрізали на зрізи, потім встановлювали на предметне скло та фарбували шафраном гематоксилін-флоксину (HPS). Стеатоз печінки оцінювали відповідно до відсотка печінкових клітин, які виявляли макровезикулярні крапельки жиру, наступним чином: ступінь 0, відсутність, менше 5% гепатоцитів; ступінь 1, легкий, 5–33% гепатоцитів; ступінь 2, середня, 33–66% гепатоцитів; ступінь 3, важкий,> 66% уражених гепатоцитів [18].
2.5. Визначення тригліцеридів тканин (TG)
Тканину (100 мг) подрібнювали під рідким азотом, а загальні ліпіди екстрагували 50 обсягами реагенту Фольха (2: 1 хлороформ-метанол) [19]. Вміст TG визначали за допомогою комерційного набору (Randox Laboratories Ltd., Великобританія).
2.6. Вестерн-блот-аналіз
2.7. Статистичний аналіз
Дані аналізували за допомогою програмного забезпечення SigmaStat 3.1 (Jandel Scientific, Сан-Рафаель, Каліфорнія) з використанням одностороннього дисперсійного аналізу (ANOVA). Площі під кривою (AUC) розраховували за допомогою програмного забезпечення PRISM (GraphPad, Сан-Дієго, Каліфорнія, США). Непараметричні дані аналізували за допомогою тесту хі-квадрат. Статистичне значення було встановлене
. Результати представлені як середнє значення ± SEM для зазначеної кількості визначень або тварин.
3. Результати
3.1. V. vitis-idaea Суттєво покращує гіперглікемію, спричинену ВЧР, у мишей DIO
Як і слід було очікувати, контрольні DIO тварини страждали ожирінням, гіперглікемікою, гіперінсулінемією та дисліпідемією (таблиці 1 та 2). Спостережувані співвідношення лептин: адипонектин та стеатоз печінки також відповідали встановленню інсулінорезистентного стану (таблиці 2 та 3).
). * позначає суттєву різницю порівняно з контрольною ЧОУ, а † вказує на значну відмінність від контрольної групи DIO (
значення † означає a
V. vitis-idaea лікування не вплинуло на загальну масу тіла, а також на масу заочеревинного та епідидиального жиру (рис. 1 (а) та таблиця 1). Аналогічно, споживання калорій залишалося незмінним у контрольній групі DIO та групах, які отримували лікування, порівняно з групою CHOW (дані не наведені). Тим не менше, V. vitis-idaea лікування, проведене протягом останнього восьмитижневого періоду експериментальних протоколів у дозах 125 та 250 мг/кг, значно зменшило площу під кривою (AUC) рівня глюкози в крові відповідно на 9 та 12% порівняно з контролем DIO (Малюнок 1 (b);
). З іншої сторони V. vitis-idaea при 500 мг/кг призвів до слабшого ефекту (зменшення глікемії на 7%), який не досяг статистичної значущості. Антигіперглікемічний ефект був ще більш очевидним в кінці лікування для трьох доз, де було зафіксовано значне падіння (28%, 25% та 17% зменшення для доз 125, 250 та 500 мг/кг, відповідно; ).
) за оцінкою тесту ANOVA;
З іншого боку, різні види лікування на інсулінемію не впливали суттєво. Тенденція до зменшення (30%) порівняно з контролем DIO спостерігалась лише у 500 мг/кг V. vitis-idaea-лікувана група (Таблиця 2).
3.2. V. vitis-idaea Лікування послаблює стеатоз печінки та гіперліпідемію у мишей DIO
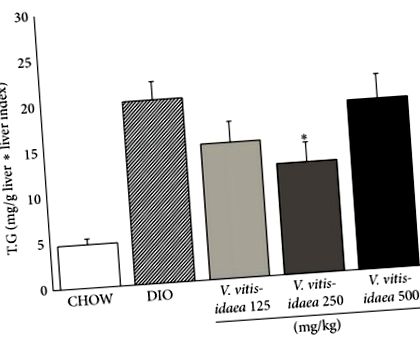
Стеатоз печінки оцінювали шляхом гістологічного оцінювання зрізів тканин печінки, як було попередньо підтверджено [18]. Як і очікувалось, у 82% тварин контрольної групи DIO спостерігався тяжкий (ступінь 3) стеатоз, тоді як у 18% спостерігався легкий та помірний (1 або 2 ступінь) стеатоз, порівняно зі 100% здоровою печінкою (ступінь 0), що спостерігалася у нонобезів КОНГЕНИ, що харчуються ЧОУ. V. vitis-idaea лікування зменшило частку тварин із ДІО, які виявляли стеатоз 3 ступеня, лише до 50–66%. Цікаво, що тварини зі здоровою печінкою (стеатоз 0 ступеня), яких не було в контрольній групі DIO, були присутніми в пропорціях від 8 до 33%. V. vitis-idaea-лікували DIO тварин. З іншого боку, 20–32% V. vitis-idaea група демонструвала стеатоз 1 або 2 ступеня (таблиця 3;), що підтверджує загальне покращення цього параметра. Група, яка отримувала дозу 250 мг/кг/день, показала найкраще зниження стеатотичного гістологічного профілю.
Відповідно до цих результатів, V. vitis-idaea знижений рівень тригліцеридів печінки. Як групи 125, так і 250 мг/кг/день продемонстрували статистично значуще зниження (39%) (рис. 2;). Більше того, однакові дози 250 мг/кг/добу змогли значно зменшити загальний рівень холестерину в плазмі та ЛПНЩ у плазмі крові на 12% та 18% відповідно (табл.
) визначали за допомогою комерційного набору. Дані представлені як середнє значення ± SEM і репрезентативні для 12 мишей на експериментальну групу. * позначає a
значення). З іншого боку, висока доза рослинного екстракту продемонструвала тенденцію до зменшення вмісту ацетильованого p53 (Lys 379) (рис. 3 (a) та 3 (c);) та суттєво збільшила фосфорилювання Akt (серин 473) (Рисунки 3 (а) та 3 (г);). Більше того, рівень білка GLUT4 значно збільшився у 1,4-2 рази у мишей DIO, які годувались середньою та високою дозою V. vitis-idaea (Рисунки 4 (a) та 4 (b);).
значення ≤ 0,05 суттєво відрізняється від групи CHOW, а † вказує на a
значення). Це не було пов'язано зі збільшенням вмісту PPAR у печінці-α, ключовий фактор транскрипції, що контролює окислення печінкової жирної кислоти (N.S., Рисунки 5 (a) і 5 (d)), а також жодних змін в ацетильованому p53 (не показано).
- Брусниця захищає від ожиріння у мишей
- Дієта, косметика та менструація HCG - Новини естетичної медицини Новини естетичної медицини
- Чи існує взаємозв'язок між паратиреоїдним гормоном та розладами, пов'язаними з ожирінням ECE2015 17-е
- Голодні перекусити Спробуйте дитяче харчування - The Globe and Mail
- Картопляні чіпси LAY S CLASSIC®