Білкові гідролізати в харчуванні тварин: промислове виробництво, біоактивні пептиди та функціональне значення
Анотація
Передумови
Білок - це макромолекула, яка зазвичай складається з двадцяти різних амінокислот (АА), зв’язаних пептидними зв’язками. Селенопротеїни містять селеноцистеїн як рідкісний АА, але вільного селеноцистеїну в клітинах тварин немає. Білок є основним компонентом тканин тварин (наприклад, скелетних м'язів, молочних залоз, печінки та тонкої кишки) та продуктів (наприклад, м'яса, молока, яєць та вовни). Наприклад, вміст білка в скелетних м’язах вирощуваної м’ясної худоби або свиней становить приблизно 70% на основі сухої речовини [1]. Таким чином, адекватне споживання дієтичних білків має важливе значення для максимального зростання, показників виробництва та ефективності годівлі худоби, птиці та риби. Після вживання тваринами в їжу білки, що містяться в кормових інгредієнтах (наприклад, кров’яна, м’ясо-кісткова мука, порошок слизової оболонки кишечника, рибне борошно, соєве борошно, арахісове борошно та бавовняне борошно) гідролізуються до дрібних пептидів - і трипептиди) та вільні АА протеазами та олігопептидазами тонкої кишки [2]; однак типи отриманих пептидів можуть сильно відрізнятися залежно від фізіологічних умов тварин та складу їх раціону. Для послідовного виробництва пептидів з білків тваринних та рослинних джерел перед годуванням використовувались надійні хімічні, ферментативні або мікробні методи для поліпшення їх харчових якостей та зменшення будь-яких пов'язаних з цим факторів анти-нутріції [3, 4]. Останні два методи можуть також поліпшити розчинність, в'язкість, емульгування та гелеутворення пептидів.
У тваринництві високоякісний білок не гідролізується як кормові добавки. Гідролізуються лише побічні продукти тваринного походження, побічні продукти пивоваріння та рослинні інгредієнти, що містять протипоживні фактори, з отриманням пептидів для кормів тварин. Протеази, виділені з різних джерел (включаючи бактерії, рослини та дріжджі), використовуються для ферментативного методу, тоді як інтактні мікроорганізми використовуються для культури при мікробному підході. На сьогоднішній день білкові гідролізати застосовуються в таких різноманітних галузях, як медицина, харчування (включаючи харчування тварин) та біотехнології [5]. Основними цілями цієї статті є висвітлення ферментних та ферментаційних методів промислового приготування білкових гідролізатів та обговорення харчової та функціональної значимості їх біоактивних пептидів у годівлі тварин.
Визначення амінокислот, пептидів та білка
Амінокислоти - це органічні речовини, що містять як аміно-, так і кислотні групи. Всі протеїногенні АА мають α-аміногрупу і, за винятком гліцину, зустрічаються як L-ізомери у тварин та кормів. Пептид визначається як органічна молекула, що складається з двох або більше залишків АА, пов'язаних пептидними зв'язками [2]. Утворення одного пептидного зв’язку призводить до видалення однієї молекули води. У більшості пептидів типові пептидні зв’язки утворюються з α-аміно- та α-карбоксильних груп сусідніх АА. Пептиди можна класифікувати за кількістю залишків АА. Олігопептид складається з 2-20 залишків АА. Ті олігопептиди, що містять ≤ 10 залишків АА, називаються малими олігопептидами (або малими пептидами), тоді як ті олігопептиди, що містять від 10 до 20 залишків АА, називаються великими олігопептидами (або великими пептидами). Пептид, який містить ≥ 21 залишку АА і не має тривимірної структури, називають поліпептидом [6]. Білок складається з одного або декількох високомолекулярних поліпептидів.
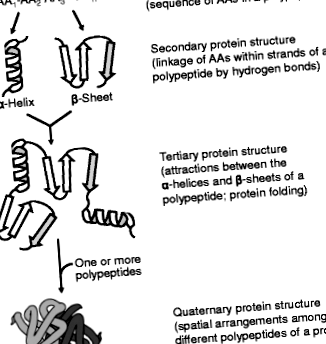
Чотири порядки білкових структур. Білок має (1): первинну структуру (послідовність АА уздовж поліпептидного ланцюга; (2) вторинну структуру (конформація поліпептидного кістяка); (3) третинну структуру (тривимірна структура білка) і (4) четвертинну структуру (просторове розташування поліпептидних субодиниць). Первинна послідовність АА у білку визначає його вторинну, третинну та четвертинну структури, а також біологічні функції
Трихлороцтова кислота (TCA; кінцева концентрація 5%) або хлорна кислота (PCA; кінцева концентрація 0,2 моль/л) можуть повністю осаджувати білки, але не пептиди, з тканин тварин, клітин, плазми та інших фізіологічних рідин (наприклад, рубці, алантоїсні, амніотичні, кишково-просвітні рідини та дигеста) [9, 10]. Етанол (кінцева концентрація 80%) може ефективно осаджувати як білки, так і нуклеїнові кислоти з водних розчинів [11]. Цей метод може бути корисним для видалення водорозчинних неорганічних сполук (наприклад, алюмінію) з білкових гідролізатів. Слід зазначити, що 1% вольфрамова кислота може осаджувати як білки, так і пептиди з ≥ 4 залишками АА [10]. Таким чином, PCA або TCA можна використовувати разом з вольфрамовою кислотою для розрізнення малих та великих пептидів.
Промислове виробництво білкових гідролізатів
Загальні міркування щодо гідролізу білка
Загальні процедури виробництва пептидів із тваринних і рослинних білків. Пептиди (включаючи біоактивні пептиди) можуть бути отримані з білків, що містяться в продуктах тваринного походження (включаючи побічні продукти) або в сировині з рослинних джерел (наприклад, соя та пшениця), шляхом хімічного, ферментативного або мікробного гідролізу. Ці загальні процедури, можливо, доведеться модифікувати для виробництва пептидів залежно від джерел білка та технічних характеристик продукту
Ступінь гідролізу
Білкові гідролізати включають вільні АА, малі пептиди та великі пептиди. Пропорції цих продуктів змінюються залежно від джерел білків, якості води, типу протеаз та виду мікробів. Ступінь гідролізу, тобто ступінь гідролізу білка, вимірюється кількістю розщеплених пептидних зв’язків, поділеною на загальну кількість пептидних зв’язків у білку і помноженою на 100 [3]. Кількість розщеплених пептидних зв'язків вимірюється молями вільних АА плюс молями ТЦА- або РСА-розчинних пептидів. Через відсутність стандартів для всіх пептидів, що утворюються в результаті гідролізу білків, технічно складно визначити кількісні показники пептидів, що виділяються з тваринних, рослинних або мікробних джерел білків. Відсоток АА у вільній формі або пептидній формі розраховується наступним чином:
Коли катаболізм АА обмежений (як при ферментативному гідролізі), відсоток АА у пептидах обчислюється як (загальний вміст АА у вільних від білків АА)/загальний вміст АА у білку х 100%. Високоефективна рідинна хроматографія (ВЕРХ) широко використовується для визначення вільних АА [12]. ВЕРХ та інші аналітичні методи (наприклад, ядерно-магнітно-резонансна спектроскопія, матрична допоміжна лазерна десорбція, час іонізації польоту, мас-спектрометрія, картування пептидів та іонообмінна хроматографія) часто застосовуються для характеристики пептидів у білкових гідролізатах [13, 14]. Коли стандарти доступні, ВЕРХ можна використовувати для аналізу пептидів.
Методи гідролізу білка
Кислотний гідроліз білків
Про кислотний гідроліз білка (желатин) при високій температурі вперше повідомив французький хімік Х. Браконно в 1920 р. Зараз встановлено, що повний гідроліз білка в 6 моль/л HCl відбувається при 110 ° С протягом 24 годин [ 12]. Для отримання пептидів використовується набагато коротший проміжок часу (наприклад, від 2 до 6 год) [3]. Після гідролізу продукт випаровують, пастеризують і сушать розпиленням. Більшість кислотних білкових гідролізатів використовуються як підсилювачі смаку (наприклад, ароматизатори, такі як гідролізований рослинний білок) [5]. Метод кислотного гідролізу білка пропонує перевагу в низькій вартості. Однак цей процес призводить до повного знищення триптофану, часткової втрати метіоніну та перетворення глутаміну в глутамат і аспарагіну в аспартат [5].
Лужний гідроліз білків
Лужні агенти, такі як гідроксид кальцію, натрію або калію (наприклад, 4 моль/л), можна використовувати при високій температурі (наприклад, 105 ° С) протягом 20 годин для повного гідролізу білка [12, 15]. Більш низькі температури (наприклад, від 27 до 55 ° C) і коротший період часу гідролізу (наприклад, від 4 до 8 годин) часто бажані для утворення пептидів у харчовій промисловості [5]. Після гідролізу продукт випаровують, пастеризують і сушать розпиленням. Як і кислотний гідроліз білків, лужний гідроліз білків забезпечує перевагу низької вартості і може мати 100% швидкість відновлення триптофану [12]. Однак цей процес призводить до повного знищення більшості АА (наприклад, 100% втрати). Таким чином, хоча лужний гідроліз часто використовується для виробництва піноутворювачів (наприклад, замінників яєчних білків) та пін вогнегасників, він не використовується широко в харчовій промисловості.
Безклітинні протеази
Пептидні зв’язки білків можуть розщеплюватися багатьма різними видами протеаз, які можна класифікувати як екзопептидази та ендопептидази на основі типу реакції, а саме гідролізу пептидного зв’язку в кінцевій області (екзопептидаза) або у внутрішній області (ендопептидаза) білка [2]. Деякі протеази гідролізують дипептиди (дипептидази), тоді як інші видаляють кінцеві залишки АА, які заміщені, циклізовані або пов'язані ізопептидними зв'язками (а саме пептидні зв'язки, крім зв'язків α-карбоксилу з α-аміногрупами; наприклад, ω-пептидази). Коли протеаза виявляє помітну перевагу пептидному зв’язку, утвореному з певного залишку АА, назва цього АА використовується для утворення кваліфікатора (наприклад, “лейцин” амінопептидаза та “пролін” ендопептидаза). Навпаки, для ферментів з дуже складною або широкою специфічністю для гідролізу білка використовуються алфавітні або числові серійні назви (наприклад, пептидил-дипептидаза А, пептидил-дипептидаза В, дипептидил-пептидаза I та дипептидил-пептидаза II). Деякі протеази можуть мати властивості як екзопептидази, так і ендопептидази (наприклад, катепсини В і Н). Ферментативний гідроліз відбувається в м’яких умовах (наприклад, рН 6–8 та 30 - 60 ° C) і мінімізує побічні реакції.
Мікробний гідроліз білка
Мікроорганізми вивільняють протеази для гідролізу позаклітинних білків у великі пептиди, малі пептиди та вільні АА. Дрібні пептиди можуть поглинатися мікробами для внутрішньоклітинного гідролізу, отримуючи вільні АА. Мікроорганізми також виробляють ферменти, крім протеаз, для розкладання складних вуглеводів та ліпідів [22]. Ферментація білка класифікується на рідкий або твердий тип. Рідкоферментне бродіння проводиться з білковими субстратами в умовах високої вологості бродіння, тоді як тверде ферментація проводиться в умовах низької вологості бродіння. Низький рівень вологи твердого твердого бродіння може допомогти скоротити час висихання білкових гідролізатів.
Біоактивні пептиди в білкових гідролізатах
Визначення
Біоактивні пептиди визначаються як фрагменти послідовностей АА у білку, що надають біологічні функції понад їх харчову цінність [25]. Вони мають протимікробну, антиоксидантну, гіпотензивну та імуномодулюючу дію. Ці біоактивні пептиди зазвичай мають довжину 2–20 залишків АА, але деякі можуть складатися з> 20 залишків АА [23]. Багато з них виявляють загальні структурні властивості, такі як відносно невелика кількість АА, велика кількість гідрофобних залишків АА та наявність залишків Arg, Lys та Pro [24]. У тварин ендогенні пептиди виконують найважливіші фізіологічні або регуляторні функції. Наприклад, PEC-60 активує Na/K АТФазу в тонкому кишечнику та інших тканинах [26]. Крім того, багато кишкові пептиди (секретуються клітинами Панета) мають антимікробну функцію [27]. Крім того, мозок вивільняє численні пептиди для регулювання ендокринного статусу, споживання їжі та поведінки у тварин [28].
Транспорт малих пептидів у тонкий кишечник
У тонкому кишечнику пептидний транспортер 1 (PepT1) відповідає за протоновий транспорт позаклітинних ди- та трипептидів через апікальну мембрану ентероциту до клітини [29]. Однак через високу активність внутрішньоклітинних пептидаз у тонкому кишечнику [2] малоймовірно, що поживна значна кількість пептидів у просвіті кишки може потрапити у ворітну вену або лімфатичний кровообіг. Можливо, обмежена, але фізіологічно значна кількість пептидів (особливо тих, що містять імінокислоту) може поглинатися цілим із вмісту просвіту в кров через М-клітини, екзосоми та ентероцити через трансепітеліальний клітинний транспорт [30, 31] . Похідні від дієти пептиди можуть здійснювати свої біоактивні (наприклад, фізіологічні та регуляторні) дії на рівні тонкої кишки, а генеровані в кишечнику сигнали можуть передаватися в мозок, ендокринну систему та імунну систему організму, щоб отримати корисні результати впливати на все тіло.
АПФ-інгібуючі пептиди
Перший біоактивний пептид, отриманий з їжі, який посилював кальцифікацію кісток, незалежно від вітаміну D, у немовлят з рахітом, отримували з казеїну [32]. На сьогоднішній день з молока або м’яса утворено багато пептидів, що інгібують ангіотензин-I-перетворюючий фермент (АПФ) (табл. 2). АПФ видаляє С-кінцевий дипептид His-Leu в ангіотензині I (Ang I), утворюючи Ang II (потужний судинозвужувальний пептид), надаючи тим самим їх антигіпертензивний ефект [33]. Найкращими прикладами для інгібуючих АПФ пептидів є Ile-Pro-Pro (IPP) та Val-Pro-Pro (VPP), обидва з яких отримують з молочного білка шляхом гідролізу нейтральної протеази, лужної протеази або папаїну [34]. Є дані, що ці два багаті проліном пептиди можуть частково уникнути шлунково-кишкового гідролізу і транспортуватися через епітелій кишечника в кровообіг [35]. Подібним чином гідроліз білків з м’яса [36] та яєчного жовтка [37] також генерує потужні інгібітори АПФ.
Антиоксидантні та антимікробні пептиди
Багато дрібних пептидів з продуктів тваринного походження (наприклад, риби та м’яса) (табл. 3) та кормів рослинного походження [25] виконують антиоксидантну функцію, виводячи вільні радикали та/або пригнічуючи вироблення окисників та прозапальних цитокінів [38– 41]. Ці дрібні пептиди можуть зменшити вироблення окисників у тонкому кишечнику, одночасно посилюючи виведення окисників, що призводить до зменшення їх внутрішньоклітинної концентрації та полегшення окисного стресу (рис. 3). Багато біоактивні пептиди мають як інгібуючі АПФ, так і антиокислювальні ефекти [36, 37]. Крім того, деякі пептиди тваринних (табл. 4) та рослинних білків-гідролізатів [25] також мають антимікробну дію, як повідомляється для певних ендогенних пептидів у тонкому кишечнику [27]. Ці антимікробні пептиди здійснюють свої дії, пошкоджуючи клітинну мембрану бактерій, втручаючись у функції їх внутрішньоклітинних білків, викликаючи агрегацію цитоплазматичних білків та впливаючи на метаболізм бактерій [42–44], але основні механізми залишаються в основному невідомими [ 27].
Інгібування клітинного окисного стресу харчовими дрібними пептидами в тонкому кишечнику. Дрібні пептиди, які доповнюють раціон тварин (особливо молодих тварин), можуть зменшити вироблення окисників у тонкому кишечнику та посилити виведення окисників, що призводить до зменшення їх внутрішньоклітинної концентрації та полегшення окисного стресу. (-), гальмування; (+), активація; ↓, зменшення
Опіоїдні пептиди
Гідроліз певних білків (наприклад, казеїну, глютену (присутніх у пшениці, житі та ячмені) та сої) у шлунково-кишковому тракті може генерувати опіоїдні пептиди [45]. Це можна зробити in vitro, використовуючи травні ферменти з тонкої кишки ссавців (наприклад, свиней). Опіоїдні пептиди - це олігопептиди (зазвичай 4–8 залишків АА у довжину), які зв’язуються з опіоїдними рецепторами мозку, впливаючи на функцію кишечника [46, 47], а також на поведінку та споживання їжі тваринами (табл. 5). Крім того, білкові гідролізати, що містять опіоїдоподібні пептиди, можуть використовуватися як кормові добавки для полегшення стресу, контролю болю та сну та модуляції ситості у тварин.
Застосування рослинних та тваринних білкових гідролізатів у харчуванні тварин
Загальний розгляд
Рослинні пептиди
Пептиди тварин
Потенційний масштаб та економічне значення для глобального використання гідролізатів білків тваринного та рослинного походження у годівлі тварин
Промислова переробка домашніх сільськогосподарських тварин утворює велику кількість тканин (30–40% маси тіла), що не споживаються людиною, включаючи нутрощі, обрізки туш, кістки (20–30% маси тіла), жир, шкіру, стопи, дрібну - кишково-кишкова тканина (2% маси тіла), перо (до 10% маси тіла) та колекційна кров (5% маси тіла), причому глобальні неїстівні поживні тварини та птиця є побічними продуктами
54 млрд. Кг/рік [66–68]. Так само рибопереробна промисловість виробляє велику кількість відходів (до 55% маси тіла), таких як обрізка м’язів (15–20%), шкіра та плавники (1–3%), кістки (9–15%), голови (9–12%), нутрощі (12–18%) та луска, причому глобальні неїстівні побічні продукти риби становлять
6 млрд. Кг/рік [66–69]. Таким чином, щорічний глобальний обсяг побічних продуктів тваринного походження, що генеруються переробною промисловістю, становить приблизно 60 млрд. Кг щороку. Якщо припустити, що лише 5% побічних продуктів тваринного походження та рослинних продуктів на корм використовується для гідролізу білка, і виходячи з нинішніх середніх цін на гідролізати білків тварин, сої та пшениці [70], їх урожайність становить 3, 6,75 та 12,75. млрд. кг/рік відповідно, а їх економічні значення складають 4,5, 3,88 та 20,02 млрд. доларів США на рік (табл. 6). Таким чином, білкові гідролізати з побічних продуктів свиней або птиці та рослинних інгредієнтів мають великі перспективи для підтримки сільського господарства тварин та управління тваринами-компаньйонами у всьому світі.
- Чистий ізолят сироваткового протеїну за допомогою датчика м’язової маси Найнижчі ціни на м’язи; Сила
- Інститут нейропротективного харчування з функціональної медицини
- Функціональне харчування Ніколь Сейл
- Онкологічні та функціональні результати післяопераційного загального парентерального харчування після радикалу
- Reflex Nutrition Diet Protein 2кг; Кардіфф Спортивне харчування