Змінений адипогенез у личинок даніо внаслідок дієти з високим вмістом жиру та хімічного впливу візуалізується за допомогою стимульованої розсіюючої мікроскопії
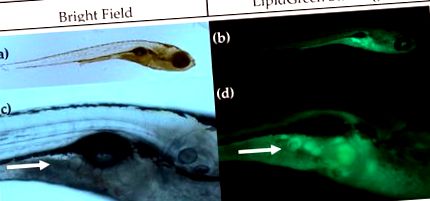
Візуалізація адипоцитів за допомогою Bright Field (ліворуч) та флуоресцентної мікроскопії після фарбування LipidGreen (праворуч). (a, b) репрезентативні зображення личинок через 15 днів після запліднення (dpf) (5-кратне збільшення); (c, d) Закри ділянки підшлункової залози, де розвиваються перші адипоцити. Адипоцити позначені білою стрілкою (збільшення 16 ×).
Вплив різних дієт на адипогенез та ріст личинок. (a) Середній відсоток личинок з адипоцитами після згодовування від 6–15 dpf стандартними кормами (StF), дієтою з високим вмістом глюкози (HGD) або дієтою з високим вмістом жиру (HFD); (b) Розподіл личинок по довжині (мм) при 15 dpf. (StF: n = 32; HGD: n = 30; HFD: n = 33); (c) Довжина (мм) личинок з адипоцитами. (StF: n = 5; HGD: n = 6; HFD: n = 17) (** p ≤ 0,05, *** p ≤ 0,01, **** p ≤ 0,0001). Смужки помилок представляють стандартне відхилення.
SRS візуалізація адипоцитів у личинок даніо, які зазнали різного раціону харчування. (а - в) Репрезентативні зображення обсягів вимірювань ліпідів SRS для стандартної дієти (StF), дієти з високим вмістом глюкози (HGD) або дієти з високим вмістом жиру (HFD) відповідно; (d - f) Частота адипоцитів у різних класах розміру відповідно до StF (n = 7), HGD (n = 6) та HFD (n = 7) відповідно, визначається автоматизованим алгоритмом обробки зображень у MATLAB.
Експресія генів адипогенних маркерів під час адипогенезу після впливу різних дієт. (a - f) Зміни експресії у 8 разів, 8 та 12 днів щодо мРНК, відібраної у ембріонів через 6 днів після запліднення (контроль 6 dpf). Личинок годували стандартною дієтою (StF), дієтою з високим вмістом глюкози (HGD) або дієтою з високим вмістом жиру (HFD) (** p ≤ 0,05) (n = 4 (кожна проба містила 10 личинок)). Смужки помилок представляють SEM.
Експресія генів гормонів та рецепторів жирової тканини кишечник-мозок під час адипогенезу. (а - f) Зміни експресії у 8 разів, 8 та 12 днів щодо мРНК, відібраної у ембріонів через 6 днів після запліднення до початку годування (контроль 6 dpf). Личинок годували стандартною дієтою (StF), дієтою з високим вмістом глюкози (HGD) або дієтою з високим вмістом жиру (HFD). (** p ≤ 0,05). (n = 4 (кожна проба містила 10 личинок)). Смужки помилок представляють SEM.
Ієрархічна кластеризація генної експресії генів, що беруть участь в адипогенезі та шляху жирової кишки та мозку. Порівняння експресії генів при 15 dpf між зразками стандартних кормів (StF), дієти з високим вмістом глюкози (HGD) та дієти з високим вмістом жиру (HFD) (евклідова відстань), нормалізованих до контролю 6 dpf.
Вплив впливу на організм хімічних речовин навколишнього середовища на адипогенез та ріст личинок. (а) Наявність адипоцитів у личинок 15 dpf після впливу (0–6 dpf) розвитку під контролем розчинника (0,01% DMSO), 0,5 мкМ TDCiPP або 1 нМ TBT; (b) Розподіл личинок по довжині (мм) при 15 dpf (n = 20); (c) Довжина (мм) личинок з адипоцитами (n = 10) Смужки похибок представляють стандартне відхилення. (* p ≤ 0,05).
SRS візуалізація адипоцитів у риб, що зазнають впливу хімічних речовин навколишнього середовища. (a - c) Репрезентативні зображення обсягів вимірювань ліпідів SRS після контролю розчинника (0,01% DMSO), 0,5 мкМ TDCiPP або 1 нМ експозиції TBT відповідно; (d - f) Частота адипоцитів у різних класах розмірів контролю розчинника (n = 8), TDCiPP (n = 8) або TBT (n = 8) відповідно, визначається автоматизованим алгоритмом обробки зображень у MATLAB.
Експресія генів гормонів та рецепторів після раннього впливу хімічних речовин навколишнього середовища. (a - h) Зміни експресії у генах (нормалізовані до контролю розчинника при 6 dpf або 15 dpf) вимірювали за допомогою qPCR, використовуючи масив ожиріння. Зразки брали з двох незалежних експериментів експозиції (n = 3 на експеримент); (** p ≤ 0,05). Смужки помилок представляють SEM.
Експресія генів гормонів та рецепторів після раннього впливу хімічних речовин навколишнього середовища. (a - h) Зміни експресії у генах (нормалізовані до контролю розчинника при 6 dpf або 15 dpf) вимірювали за допомогою qPCR, використовуючи масив ожиріння. Зразки брали з двох незалежних експериментів експозиції (n = 3 на експеримент); (** p ≤ 0,05). Смужки помилок представляють SEM.
Ієрархічна кластеризація експресії генів після впливу хімічних речовин навколишнього середовища. Порівняння експресії генів при 6 і 15 dpf після впливу від 0–6 dpf до 1 нМ TBT або 0,5 мкМ TDCiPP. Експресія гена нормалізувалась до контролю розчинника за часову точку (евклідова відстань).
Схематичне зображення процедури, яка використовується для аналізу впливу різних дієт на розвиток адипоцитів у личинок даніо.
Схематичне зображення процедури, яка використовується для аналізу впливу хімічних речовин навколишнього середовища (ЕК) на розвиток адипоцитів у личинок даніо.
Деталі візуалізації стимульованого раманівського розсіювання (SRS) (a) Схематичне зображення набору зображень SRS. AOM = акустооптичний модулятор; (b) Енергетична діаграма Яблонського подання SRS. Електронний основний стан S0 взаємодіє з вібраційно збудженим станом через віртуальний стан. Різниця в енергії фотонів між двома лазерами відповідає 2845 см -1 розтяжній вібрації груп CH2.
Анотація
Візуалізація адипоцитів за допомогою Bright Field (ліворуч) та флуоресцентної мікроскопії після фарбування LipidGreen (праворуч). (a, b) репрезентативні зображення личинок через 15 днів після запліднення (dpf) (5-кратне збільшення); (c, d) Закри ділянки підшлункової залози, де розвиваються перші адипоцити. Адипоцити позначені білою стрілкою (збільшення 16 ×).
Вплив різних дієт на адипогенез та ріст личинок. (a) Середній відсоток личинок з адипоцитами після згодовування від 6–15 dpf стандартними кормами (StF), дієтою з високим вмістом глюкози (HGD) або дієтою з високим вмістом жиру (HFD); (b) Розподіл личинок по довжині (мм) при 15 dpf. (StF: n = 32; HGD: n = 30; HFD: n = 33); (c) Довжина (мм) личинок з адипоцитами. (StF: n = 5; HGD: n = 6; HFD: n = 17) (** p ≤ 0,05, *** p ≤ 0,01, **** p ≤ 0,0001). Смужки помилок представляють стандартне відхилення.
SRS візуалізація адипоцитів у личинок даніо, які зазнали різного раціону харчування. (а - в) Репрезентативні зображення обсягів вимірювань ліпідів SRS для стандартної дієти (StF), дієти з високим вмістом глюкози (HGD) або дієти з високим вмістом жиру (HFD) відповідно; (d - f) Частота адипоцитів у різних класах розміру відповідно до StF (n = 7), HGD (n = 6) та HFD (n = 7) відповідно, визначається автоматизованим алгоритмом обробки зображень у MATLAB.
Експресія генів адипогенних маркерів під час адипогенезу після впливу різних дієт. (a - f) Зміни експресії у 8 разів, 8 та 12 днів щодо мРНК, відібраної у ембріонів через 6 днів після запліднення (контроль 6 dpf). Личинок годували стандартною дієтою (StF), дієтою з високим вмістом глюкози (HGD) або дієтою з високим вмістом жиру (HFD) (** p ≤ 0,05) (n = 4 (кожна проба містила 10 личинок)). Смужки помилок представляють SEM.
Експресія генів гормонів та рецепторів жирової тканини-кишечник-мозок під час адипогенезу. (а - f) Зміни експресії у 8 разів, 8 та 12 днів щодо мРНК, відібраної у ембріонів через 6 днів після запліднення до початку годування (контроль 6 dpf). Личинок годували стандартною дієтою (StF), дієтою з високим вмістом глюкози (HGD) або дієтою з високим вмістом жиру (HFD). (** p ≤ 0,05). (n = 4 (кожна проба містила 10 личинок)). Смужки помилок представляють SEM.
Ієрархічна кластеризація генної експресії генів, що беруть участь в адипогенезі та шляху жирової кишки та мозку. Порівняння експресії генів при 15 dpf між зразками стандартних кормів (StF), дієти з високим вмістом глюкози (HGD) та дієти з високим вмістом жиру (HFD) (евклідова відстань), нормалізованих до контролю 6 dpf.
Вплив впливу на організм хімічних речовин навколишнього середовища на адипогенез та ріст личинок. (а) Наявність адипоцитів у личинок 15 dpf після впливу (0–6 dpf) розвитку під контролем розчинника (0,01% DMSO), 0,5 мкМ TDCiPP або 1 нМ TBT; (b) Розподіл личинок по довжині (мм) при 15 dpf (n = 20); (c) Довжина (мм) личинок з адипоцитами (n = 10) Смужки похибок представляють стандартне відхилення. (* p ≤ 0,05).
SRS візуалізація адипоцитів у риб, що зазнають впливу хімічних речовин навколишнього середовища. (a - c) Репрезентативні зображення обсягів вимірювань ліпідів SRS після контролю розчинника (0,01% DMSO), 0,5 мкМ TDCiPP або 1 нМ експозиції TBT відповідно; (d - f) Частота адипоцитів у різних класах розмірів контролю розчинника (n = 8), TDCiPP (n = 8) або TBT (n = 8) відповідно, визначається автоматизованим алгоритмом обробки зображень у MATLAB.
Експресія генів гормонів та рецепторів після раннього впливу хімічних речовин навколишнього середовища. (a - h) Зміни експресії у генах (нормалізовані до контролю розчинника при 6 dpf або 15 dpf) вимірювали за допомогою qPCR, використовуючи масив ожиріння. Зразки брали з двох незалежних експериментів експозиції (n = 3 на експеримент); (** p ≤ 0,05). Смужки помилок представляють SEM.
Експресія генів гормонів та рецепторів після раннього впливу хімічних речовин навколишнього середовища. (a - h) Зміни експресії у генах (нормалізовані до контролю розчинника при 6 dpf або 15 dpf) вимірювали за допомогою qPCR, використовуючи масив ожиріння. Зразки брали з двох незалежних експериментів експозиції (n = 3 на експеримент); (** p ≤ 0,05). Смужки помилок представляють SEM.
Ієрархічна кластеризація експресії генів після впливу хімічних речовин навколишнього середовища. Порівняння експресії генів при 6 і 15 dpf після впливу від 0–6 dpf до 1 нМ TBT або 0,5 мкМ TDCiPP. Експресія гена нормалізувалась до контролю розчинника за часову точку (евклідова відстань).
Схематичне зображення процедури, яка використовується для аналізу впливу різних дієт на розвиток адипоцитів у личинок даніо.
Схематичне зображення процедури, яка використовується для аналізу впливу хімічних речовин навколишнього середовища (ЕК) на розвиток адипоцитів у личинок даніо.
Деталі візуалізації стимульованого раманівського розсіювання (SRS) (a) Схематичне зображення набору зображень SRS. AOM = акустооптичний модулятор; (b) Енергетична діаграма Яблонського подання SRS. Електронний основний стан S0 взаємодіє з вібраційно збудженим станом через віртуальний стан. Різниця в енергії фотонів між двома лазерами відповідає 2845 см -1 розтяжній вібрації груп CH2.
- IJMS Безкоштовний повнотекстовий ефект проти ожиріння дієтичного кальцію Докази та можливі механізми
- Безкоштовні повнотекстові біохімічні зміни IJMS під час процесу старіння ожиріння у жінок та чоловіків
- Безкоштовне повнотекстове спільне адміністрування традиційних лікарських засобів Хачімі-Джіо-Ган та
- IJMS Безкоштовна повнотекстова хондросаркома Рідкісне нещастя у старінні хряща людини Роль стовбура та
- Безкоштовні повнотекстові включення в побічний потік сільськогосподарської їжі в раціоні частини Alphitobius diaperinus