Бактеріальні метаболіти з низькою молекулярною вагою у взаємодії господар-мікроб
* Відповідний автор:
Анотація
Огляд дає уявлення про властиві біологічним властивостям бактеріальних метаболітів - низькомолекулярні фенілкарбонові кислоти (PCA), включаючи бензойну кислоту (BA), p-гідроксифенілактову кислоту (HPLA), фенілактову кислоту (PLA), p-гідроксифенілуксусну кислоту (HPAA) ), Фенілоцтової кислоти (PAA) та фенілпропіонової кислоти (PPA). Було продемонстровано, що бактерії з мікрофлори людини - переважно анаероби - можуть метаболізувати ароматичні амінокислоти в PCA, а PCA здатні пригнічувати ріст і розповсюдження інших бактерій, вступаючи в конкурентні взаємодії в межах мікробних асоціацій. Автори припускають, що в товстій кишці людини, де концентрація мікробних метаболітів досягає біологічно активного рівня, PCA можуть надавати не тільки місцеві, але й системні ефекти, отже будь-яке відхилення від існуючого складу мікробних асоціацій може потенційно призвести до порушення звичного балансу PCA і поява PCA з протилежними біологічними властивостями. Наявні опубліковані дані, а також результати власних досліджень дозволили нам обґрунтувати новий підхід, спрямований на розробку нових терапевтичних стратегій, заснованих на регулюванні місцевого та системного балансу мікробних ароматичних метаболітів в організмі людини.
Ключові слова
СКОРОЧЕННЯ
PCA - фенілкарбонові кислоти
BA - бензойна кислота
HPLA - п-гідроксифенілактова кислота
PLA - фенілактова кислота
HPAA - п-гідроксифенілацтова кислота
PAA - фенілоцтова кислота
PPA - фенілпропіонова кислота
BAA - бензаміно-оцтова кислота
AMM - Ароматичні мікробні метаболіти
АТФ - аденозиновий трифосфат
SB - Бензоат натрію
АФК - реактивні види кисню
LPS - ліпополісахарид
iNOS - індукована NO-синтаза
МСТ - монокарбоксилатні транспортери
MFS - головний фасилітатор, супер сім'я
HA - гіпурова кислота
NOAEL - Відсутній рівень побічних ефектів
MIC - мінімальна інгібуюча концентрація
MBC - мінімальна бактерицидна концентрація
MFC - мінімальна фунгіцидна концентрація
ВСТУП
Добре налагоджене та збалансоване біологічне взаємозв'язок між макро- та мікроорганізмами сформувалося в процесі еволюції. Тим часом це явище навряд чи враховується в контексті клінічних досліджень, оскільки традиційно дослідження та опис біохімічних та сигнальних процесів проводяться окремо для макроорганізму та заселення його мікрофлорою. Це пов’язано здебільшого з інертністю медичної науки, яка постійно повторює помилкове сприйняття розбіжних біохімічних шляхів регулювання про та еукаріотичних організмів, нехтуючи їх постійною коеволюцією.
Ми вважаємо, що подальший прогрес у клінічній науці неможливий без урахування ролі життєдіяльності мікрофлори людини, прожитості та взаємозв'язку з метаболізмом людини, без виявлення загальних сигнальних шляхів, що передбачають ключову роль мікробних метаболітів у патогенезі як інфекційних, так і неінфекційних (таких як онкологічні, ендокринні, психічні та ін.) хвороби. Клінічна мікроекологія, яка є новою сферою медичної науки, є найбільш підходящим терміном, що охоплює всі перелічені вище аспекти.
Цей дефіцит знань з мікроекології найболючіше проявляється в анестезіології та медицині критичної та невідкладної допомоги. Сепсис залишається головною прямою причиною смерті у відділеннях інтенсивної терапії, незважаючи на інтенсивне використання багаторівневого та багатокомпонентного моніторингу, найбільш потужних антимікробних засобів та технологій заміщення органів hitech [1-5]. Активні дослідження ароматичних мікробних метаболітів та їх потенційна роль у танатогенезі проводяться в Лабораторії метаболізму людини в критичних станах (МКС) ННІ загальної реанімації ім. Неговського [6].
Показано, що прості хімічні сполуки діють як сигнальні молекули та біорегулятори в мікробному співтоваристві, представляючи найбільш архаїчний механізм авторегуляції та міжклітинного зв'язку, так званий кворум-зондування [7]. В процесі еволюції низькомолекулярні сполуки забезпечили свою основну роль в метаболізмі людини, достатньо згадати деякі гормони (такі як ендогенні катехоламіни, гормони щитовидної залози), нейромедіатори (серотонін, γ-аміномасляна кислота), тканини та мітохондріальний метаболізм автокрин регулятори (NO) тощо.
Прості хімічні сполуки можуть зіграти важливу сполучну роль у взаємозв'язку між бактеріальним та людським метаболізмом. Наприклад, адреналін та інші катехоламіни виявились залученими до міжбактеріального спілкування, а також до взаємодії бактерій з макроорганізмом [8,9]. Попередні дані про встановлені профілі живих мікроорганізмів екзометаболітів у сироватці крові людини вже опубліковані [6,10,11]. Комплексні дослідження мікробних метаболітів в біологічних рідинах і тканинах людини представляються найбільш перспективним підходом для подальшого глибшого розуміння потенційного впливу мікроекологічних порушень на організм людини, що миттєво виявляється через порушення балансу екзометаболітів.
КЛІНІЧНО ДОПОВІДНІ ФЕНІЛКАРБОКСИЛОВІ КИСЛОТИ
Більше того, ми встановили пряму кореляцію між сукупним вмістом PCA у сироватці крові та тяжкістю захворювання [10]. Кількісна оцінка деяких РСА була успішно використана в клінічній практиці для верифікації сепсису (патент на винахід № 2423704 RU), хоча глибше розуміння та краще розуміння конкретних ролей та механізмів дії мікробних екзометаболітів у метаболізмі людини все ще попереду [14-17].
Бензойна кислота - найповніше представлена в доступних публікаціях - обрана як модель для теоретичного аналізу різноманітних біологічних властивостей PCA.
Бензойна кислота
Біологічні властивості: Чиста бензойна кислота (CAS № 65-85-0;? 6? 5. Молекулярна маса 122.13) - це безбарвна і біла кристалічна речовина з 122º? плавлення і 249º? точки кипіння, погано розчиняються у воді (2,9 г розчиняється в 1 л води при tº = 20º?). Бензойна кислота (БА) та її солі зазвичай виявляються методами спектрофотометрії, газової та рідинної хроматографії [18].
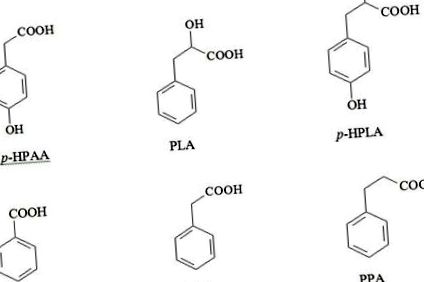
БА природним чином синтезується бактеріями, рослинами та грибами. Високі концентрації БА виявлені у ферментованих молочних продуктах, значна кількість БА виробляється Лактобактеріями з гіпурової кислоти та накопичується як кінцевий продукт біологічного розкладу фенілаланіну (Рисунок 2) [15,18,19].
Малюнок 3: Взаємозв’язок між ендогенними та мікробними катаболічними шляхами синтезу PCAS із фенілаланіну та тирозину у людей [14].
Хоча бактерії використовують деякі PCA, зокрема гідроксифенілпропіонову кислоту (HPAA) та p-гідроксифенілпропіонову кислоту (p-HPPA) як попередники синтезу фенілаланіну, тирозину та триптофану [32].
Було показано, що вищі організми втрачають здатність виробляти деякі метаболіти в тісному спільному проживанні з мікрофлорою в процесі коеволюції. На малюнку 3 показаний приклад анаеробного утворення коричної, гідроксикинамічної, фенілпропіонової та гідроксифенілпропіонової кислот виключно бактеріями.
антимікробну дію
| Мікроорганізм | рН | MIC, мг/л |
| Кишкова паличка [33] | 6.0 | 100-200 |
| Lactobacillus spp [15] | 4,3-6,0 | 300-1800 |
| Пневмонія клебсієли [33] | 6.0 | 100-200 |
| Синьогнійна паличка [34] | 5,0/7,0 | 250/1000 |
| Синьогнійна паличка [33] | 6.0 | 200-500 |
| Золотистий стафілокок [34] | 5,0/7,0 | 500/1000 |
| Золотистий стафілокок [33] | 6.0 | 50-100 |
| Streptococcus spp [15] | 5.2-5.6 | 200-400 |
| Candida albicans [34] | 5,0/7,0 | 130 /> 1000 |
| Zygosaccharomyces bailii [33] | 4.8 | 4500 |
| Zygosaccharomyces bailii [33] | 4.0 | 1200 |
Таблиця 1: Мінімальні інгібуючі концентрації БА для деяких видів бактерій та грибів, мг/л.
Завдяки властивим антисептичним властивостям BA та його солі зазвичай використовуються як консерванти (E210-? 213) у харчовій та косметичній промисловості.
Потенційний бактеріостатичний та бактерицидний ефект BA на мікрофлору верхніх відділів ШКТ був продемонстрований в експериментальних дослідженнях на поросятах. Бактеріологічні дослідження потенціалу PCA для інгібування чистих культур клінічно значущих штамів показали, що BA, як і фенілоцтова кислота (PAA) та фенілпропіонова кислота (PPA), найбільшою мірою пригнічують ріст?. coli, з непатогенною ATCC 25992?. colistrain є більш стійким до BA/PCA, ніж ентеропатогенний? 157: H7 E. coli. Незначний ефект PCA з однією або двома гідроксильними групами (3-гідрокси-4-гідроксил-3, 4-дигідрокси-заміщені PCA) в ароматичному кільці був задокументований з ентеропатогенним штамом, а відсутність ефекту з непатогенним штамом ATCC 25992 при ≤ Концентрації 1000 мг/л. Гідроксибензойні кислоти виявилися більш потужними, ніж БА, у пригніченні лактобактерій, тоді як БА та їх похідні були найефективнішими інгібіторами патогенного золотистого стафілокока (штам EP167). PAA та PPA здаються найвищими - у порівнянні з їх гідроксильними похідними - інгібіторами Lactobacilli та S. aureus [35].
Pseudomonas aeruginosa PAO1 із сімейства gram-ve продемонстрував стійкість до BA та інших PCA при концентрації 1000 мг/л. BA та PPA при 1000 мг/л лише частково (на 16% та 29% відповідно) інгібували? Andida albicans MY1055. Автори припустили, що чутливість різних мікроорганізмів до PCAs залежить переважно від специфічної структури клітинної стінки [36]. Важливо згадати, що всі РСА у цьому огляді пригнічували розмноження мікроорганізмів при значеннях концентрацій, що коливаються в межах одного порядку, що передбачає подібні механізми їх дії, згідно з теорією слабких органічних кислот (див. Нижче).
Існує припущення, що БА належить до так званих аллохімікатів, що виражають алелопатію, тобто пригнічують або пригнічують ріст інших організмів у навколишньому середовищі [37]. Це може бути застосовним до інших СПС. Ми пропонуємо, щоб PCA певною мірою регулювали різноманітність та темпи поширення мікрофлори людини [36].
Дженнер А.М. та співавт. Виявили значну кількість різних РСА у фекальних водах людини з переважаючими РАА-479 мкм, PPA -166 мкм, p-HPPA - 68 мкм, 3,4-дигідрокси-коричної кислоти - 52 мкг; BA - 51 мкм, 3-гідрогіденілецтова кислота - 46 мкМ; p-HPAA - 19 мкм? і 3,4-дигідрокси-ПАА - 7 мкр. Важливо, що довготривалий моніторинг профілю PCA товстої кишки у добровольців-учасників показав стабільну стійкість рівнів BA, коливаючись в межах 23-25 µ? у послідовних щоденних зразках [31].
Результати власних досліджень також підтверджують потенціал анаеробних бактерій, отриманих з мікрофлори людини, для продукування PCA [38]. Більше того, ідентифікований профіль PCA відповідав профілю Jenner AM та співавт. (Таблиця 2). Важливо, що деякі РСА в анаеробних культурах накопичувались до рівнів, заявлених іншими авторами як концентрації, що стримують розмноження мікробів.
155,7 мг/л (1036,8 мкм?)
Дженнер А.М. [31]
35,4 мг/л (213 мкм?)
Білобородова Н.В. та ін. [38]
200-3500 мкм? Герез CL [39]
Механізми проникнення внутрішньоклітинних РСА
| Мікроорганізм | BA | Оцтова кислота | Молочна кислота |
| ?. цереус ATCC11778 | 296 | 2020 рік | 3480 |
| B. subtilis ATCC6633 | 192 | 105 | 8320 |
| Кишкова паличка ATCC25922 | 316 | 1550 рік | 3720 |
| L. fermentum ATCC14931 | 2500 | 26300 | 25300 |
| L. plantarum EH22G | 2610 | 27500 | 30700 |
Вплив на метаболізм клітин
У попередніх дослідженнях на культурі митохондріальної культури мишей ВА при концентрації 0,1 мкМ було показано, що значно знижує мембранний потенціал та вміст кальцію, пригнічуючи дихання мітохондрій (I комплекс дихального ланцюга) та інгібуючи окислення пірувату, мабуть, через блокування піруватдегідрогенази. Ці ефекти бензоату, розгляданого як токсичний, послаблювались менадіоном та дитиотрейтолом через окислення тіолових груп [38,54]. Також було встановлено, що BA та інші PCA інгібують вироблення реактивних видів кисню (АФК) у нейтрофілах, тоді як АФК, як відомо, погіршують фагоцитарну активність [38]. Ці результати узгоджуються з іншими опублікованими даними [55,56].
Бензоат натрію при 0,5-2 мкм? повідомлялося, що помітно пригнічує індуковане ліпополісахаридами (LPS) вироблення деяких цитокінів (TNF-α, IL-1β), NF-κB та iNOS (індукована NO-синтаза) мікроглією. Хоча час впливу бензоату натрію (SB) (тобто тривалість інкубації клітин мікроглії з SB) перед додаванням LPS до живильного середовища мало вирішальне значення для досягнення ефектів SB [57]. Іспанська група також повідомила про інгібуючий ефект інших бактеріальних метаболітів 3,4-дигідрокси-фенілпропінової та 3,4-дигідрокси-фенілоцтової кислот на продукцію прозапальних цитокінів (TNF-a, IL-1b та IL-6) в мононуклеарних клітинах. [58].
Додавання SB до культури клітин мікроглії асоціювалось із зниженою регуляцією експресії поверхневих D-маркерів та основного комплексу гістосумісності класу II (M ? II). Подібні явища були зареєстровані в експериментах з астроцитами людини [57].
Помітне інгібування окислення жирних кислот викликано в експериментальних умовах додаванням SB до гомогенізованої мишачої печінки при 0,5-2 мкМ, тим часом парентеральне введення 5-10 ммоль/кг (1220-2440 мг/кг) SB щурам призводило до значного зменшення АТФ,? oA та ацетил-? oA та підвищений рівень амонію в тканині печінки [59].
Мембранний транспорт низькомолекулярних метаболітів
Підтримання постійного значення внутрішньоклітинного рН в мінливому середовищі є однією з основних функцій клітини для забезпечення виживання клітин.
Lin J та співавт. Повідомляють про індуковану глутаматом стійкість бактерій до кислого середовища як про більш ефективний механізм, ніж аргінінзалежна резистентність, яку застосовує?. coli [60]. Ці механізми ще не з'ясовані, але експерименти з кишковою паличкою встановили посилену експресію понад 30 білків у відповідь на виклик БА [61].
Мембрана? + - АТФаза відповідає за видалення протону з внутрішньоклітинного простору у Saccharomyces cerevisiae. Цей процес миттєво активізується після додавання БА до культуральних середовищ [50]. Saccharomyces cerevisiae, на відміну від Zygosaccharomyces bailii, не можуть метаболізувати аніони БА, отже, вони виганяють аніони БА з клітини транспортними носіями. Індукція синтезу Pdr12p-транспортера вважається основним механізмом адаптації Saccharomyces cerevisiae до БА, забезпечуючи видалення бензоату за допомогою активного транспортного механізму [51].
Мембранний носій Pdr12p належить до суперсімейства ABC-транспортерів (ATP-зв'язуюча касета) і, крім бензоату, він також транспортує інші аніони слабких органічних кислот, включаючи p-HPAA? Аніони PAA [17]. . -транспортери були виявлені як у прокаріотів, так і у еукаріотів, включаючи людей [62,63]. ABC-транспортери відіграють ключову роль у стійкості бактерій до антимікробних препаратів у прокаріотичних організмів, тоді як у людей - у стійкості до протипухлинних препаратів [64].
Транспорт аніонів BA у ссавців та людей здійснюється протонзалежними транспортерами монокарбоксилатів (MCTs) та натрій-залежними транспортерами монокарбоксилатів (SMCTs) із супер сімейства MFS (Super Facilitator Super Family). Сімейство МСТ представлено щонайменше 14 мембранними білками, відповідальними за транспортування низькомолекулярних монокарбонових кислот, гормонів щитовидної залози та таких важливих для базального обміну монокарбоксилатів, як лактат, піруват та ацетоацетат. SMCT, використання градієнта натрію, транспортування лактату, пірувату та кетонових тіл із позаклітинного середовища в кишковий та нирковий епітелій та мозок [65-67].
MCT1 є універсальним транспортером для більшості тканин та органів, включаючи BBB (гематоенцефалічний бар'єр), тоді як деякі інші MCT характеризуються специфічністю до органів. МСТ підтримують внутрішньоклітинний рН шляхом видалення з цитозолю органічних кислот, що утворюються в результаті гліколізу та інших метаболічних процесів. М’язові клітини, еритроцити та ракові клітини сильно залежать від МСТ завдяки активному гліколізу та інтенсивному виробленню органічних кислот [68]. Печінка та нирки можуть використовувати лактат для глюконеогенезу, тоді як гладкі серцеві та позбавлені м’язи скелета використовують лактат для «дихання» [69,70]. Залежно від тканини та її функціональної активності, МСТ або виводять монокарбоксилатні органічні кислоти з клітини, або транспортують їх до клітини. Загалом, специфічний транспорт моно- та? 4-дикарбоксилатів відіграє ключову роль в енергетичному метаболізмі еукаріотичної клітини, пов'язуючи внутрішньоклітинні та системні метаболічні процеси у всьому організмі [71]. На сьогодні продемонстровано, що ароматичні кислоти, такі як БА та фенілпіровиноградна, можуть інгібувати МСТ і перешкоджати здатності клітин підтримувати оптимальне значення внутрішньоклітинного рН при підвищеній внутрішньоклітинній концентрації PCA, змінюючи тим самим ферментативні шляхи всередині клітини [68,72- 76].
- Чи є екстракт зеленої кави чудом для схуднення
- Це жадібність - ключ до схуднення
- Гвен Стефані змушує Блейка Шелтона схуднути
- Найновіший магазин чорних таблеток для схуднення - HazMat Management
- Таблетки для схуднення Herbalife - чи працює це для схуднення