APOA2 -256T> C поліморфізм взаємодіє із споживанням насичених жирних кислот, впливаючи на антропометричні та гормональні показники у хворих на цукровий діабет 2 типу.
Анотація
Вступ
Ожиріння є головною проблемою охорони здоров'я, де його поширеність зростає у Південно-Східній Азії, Середземномор'ї та Ірані (Klein et al. 2002; Mohamadnejad et al. 2003). Надмірна вага та ожиріння є одними з найпоширеніших проблем зі здоров’ям у пацієнтів з діабетом 2 типу, які страждають понад 85% усіх випадків. Ожиріння завдяки збільшенню резистентності до інсуліну та концентрації глюкози в сироватці додає більшої складності прогресуванню діабету 2 типу (Maggio and Pi-Sunyer 1997). Дисліпідемія та збільшення жирової тканини черевної порожнини є найпоширенішими метаболічними порушеннями у хворих на цукровий діабет 2 типу (Sam and Haffner 2008).
Расові відмінності ожиріння у подібних середовищах (Wang and Beydoun 2007; Ogden et al. 2006) свідчать про те, що ожиріння є результатом складної взаємодії між генетичними, поведінковими, соціальними та екологічними факторами (Hill 2006; Prentice 2005; Speakman 2004; Ravussin and Bouchard 2000). Nutrigenetics оцінює вплив варіацій геному на реакцію людини на поживні речовини (Ordovas and Corella 2004). Дослідження з одним нуклеотидним поліморфізмом (SNP) забезпечують потужний молекулярний інструмент для вивчення ролі харчування для здоров'я та захворювань, що веде до визначення оптимальних дієт для людей (Ames 1999). Карта генів ожиріння показує специфічні локуси всіх хромосом, за винятком хромосоми Y, які пов'язані з ожирінням (Ellsworth et al. 2005). Є багато генів, які регулюють енергетичний баланс, апетит, ліпідний обмін та адипогенез (Martinez et al. 2008).
Одним з помітних генів є аполіпопротеїн А2, з багатьма ідентифікованими генетичними варіантами (Fullerton et al. 2002). APOA2 є другим за значимістю білком ЛПВЩ, що складає приблизно 20% загального білка ЛПВЩ (Blanco-Vaca et al. 2001). Попередні дослідження вказують на нову зв'язок між -256T> C APOA2 поліморфізм та споживання насичених жирних кислот щодо ІМТ та ожиріння (Corella et al. 2007, 2009, 2011).
Нещодавнє дослідження вивчило зв'язок між цим SNP та рівнем лептину та греліну в сироватці крові як ефективного механізму, що лежить в основі ожиріння. У цьому дослідженні суттєво APOA2-Спостерігали взаємодію SFA щодо рівня греліну. Грелін у сироватці крові для хворих на ХК з низьким споживанням SFA був нижчим, ніж у хворих на CC із високим споживанням SFA та носіями аллелю T (TT + TC) (Smith et al. 2011).
Насправді дієта є одним з найважливіших факторів навколишнього середовища, який взаємодіє з геномом, щоб модулювати ризик захворювань. Розуміння цих взаємодій може призвести до запобігання хронічним захворюванням за допомогою дієтичних рекомендацій (Ordovas and Corella 2004). Через кілька досліджень у цій галузі та відсутність даних в Ірані, ми проводимо поточне дослідження з метою вивчення розподілу −256T> C APOA2 поліморфізм, а потім взаємодія між APOA2 споживання генотипів та насичених жирних кислот з урахуванням антропометричних змінних, рівня греліну та лептину у сироватці крові у хворих на цукровий діабет 2 типу.
Матеріали і методи
Вивчення дизайну та предметів
У цьому поперечному дослідженні, проведеному з жовтня 2011 року по червень 2012 року, 737 хворих на цукровий діабет 2 типу (290 чоловіків та 447 жінок) у віці від 35 до 65 років були випадково відібрані через Іранське суспільство діабету, Асоціацію діабету Габрика, Тегеран, Східний медичний центр та медичні центри по всьому місту.
Після письмового та усного пояснення мети та методології цього дослідження була отримана поінформована згода всіх суб’єктів. Особи віком до 35 років або старше 65 років, пацієнти, які вводять інсулін, вагітні або жінки, що годують, а також ті, хто вживав алкоголь за 24 години до забору крові. Це дослідження було схвалено Комітетом з етики Тегеранського університету медичних наук.
Оцінка антропометричних показників та фізичної активності
Вага вимірювалась натще, з мінімальним одягом, за допомогою соколяських ваг Seca з точністю до 100 гр. Висоту вимірювали за допомогою датчика висоти Seca з точністю до 0,5 см. Окружність талії вимірювали з точністю до 0,5 см від середини між верхнім краєм клубового гребеня та нижнім краєм грудної клітки та останнім ребром (Lohman et al. 1988). Вимірювання проводив дієтолог. ІМТ розраховували діленням ваги (у кг) на квадрат висоти (у м).
Кількість щоденних фізичних навантажень оцінювали за класифікованою анкетою фізичної активності відповідно до метаболічного еквівалентного завдання (MET), яке включає дев’ять рівнів активності від сну/відпочинку (METs = 0,9) до фізичних навантажень високої інтенсивності (METs> 6). Ця анкета була розроблена та затверджена в попередніх дослідженнях у Європі (Aadalh and Jorgensen 2003). В Ірані надійність та обґрунтованість цієї анкети були підтверджені Kelishadi et al. (2004). Години, витрачені на кожну фізичну активність, помножували на їхні кількості MET, а отримані числа підсумовували для обчислення значення MET/година (день h/день).
Оцінка дієтичного споживання
Звичайне споживання дієти учасником протягом останнього року оцінювалось за допомогою особистих інтерв’ю, проведених кваліфікованим дієтологом із використанням напівкількісного опитування частоти їжі для 147 продуктів харчування. Дійсність та надійність анкети були раніше підтверджені в Ірані (Esmaillzadeh et al. 2004). Випробовуваних просили повідомити про частоту споживання продуктів харчування протягом дня, тижня, місяця чи року. Кількості, перераховані для кожної їжі, перераховувались у грами на день за допомогою побутової шкали підручників (Ghaffarpour et al. 1999). Нарешті, були визначені еквівалентні грами кожного продукту харчування. Всі продукти харчування та напої були закодовані. Для оцінки споживання калорій та поживних речовин було використано програмне забезпечення Nutritionist-III (N3), розроблене для іранських продуктів.
Біохімічний аналіз
Зразки венозної крові збирали після 12-годинного нічного голодування. Були отримані сироватки крові та проведено гормональне обстеження 258 пацієнтів із простим випадковим відбором проб з кожної з груп генотипу.
Концентрації греліну та лептину в сироватці крові вимірювали методом ІФА (Bioassay Technology Co, Китай та Mediagnost, Німеччина, відповідно).
Генетичний аналіз
Геномну ДНК витягували з цільної крові методом засолення (Miller et al. 1988). Генотипування APOA2 −265T> C (rs5082) проводили за допомогою системи ПЛР StepOne у режимі реального часу (Applied Biosystems, Фостер-Сіті, Каліфорнія, США; Alvandi and Koohdani 2014).
Статистичний аналіз
Для вивчення нормального розподілу даних використовували тест Колмогорова – Смірнова. Вага, ІМТ та окружність талії були трансформовані в журнал. Для порівняння відсотків використовували тест хі-квадрат. ANOVA і незалежний т були застосовані тести для порівняння сирих засобів. Співвідношення між APOA2 поліморфізм та антропометричні змінні випробовували в аналізі багатоваріантної моделі коваріації (ANCOVA), контролюючи суперечливі фактори (вік, стать, фізична активність та загальне споживання енергії). Взаємодія між APOA2 Поліморфізм −256T> C та споживання SFA для антропометричних змінних тестували за допомогою багатовимірної моделі взаємодії ANCOVA, контролюючи суперечливі фактори (вік, стать, фізична активність та загальне споживання енергії). Крім того, коригування ІМТ проводили за показаннями. Для вивчення взаємозв'язку між генотипами та рівнями греліну (непараметрична змінна) використовували тест Манна – Уітні. стор значення
Результати
Генотипували поліморфізм APOA2 у 737 пацієнтів (вік 54,1 ± 6,5 років). У цій популяції розподіл −256T> C APOA2 поліморфізм становив 38,9, 48,6 та 12,5 відсотка для генотипів TT, TC та CC відповідно. Алельний розподіл відповідає рівновазі Харді-Вайнберга. Виходячи з цих генотипів, загальні характеристики індивідуумів наведені в таблиці 1. Ці дані вказують на те, що суб’єкти ХК були значно старшими за носіїв аллелю Т (ТТ + ТС; стор = 0,03), а куріння значно частіше зустрічається у групі КК (стор = 0,03). Статистично значущої різниці у споживанні їжі між двома групами генотипів не виявлено (Таблиця 2).
Як показано в таблиці 3, суттєвої різниці в середньому значенні антропометричних параметрів двох генотипів групи не спостерігалось. Хоча середня вага, ІМТ та обхват талії були вищими в групі СК, ніж у групі ТТ + ТС, але ці відмінності не були статистично значущими. Крім того, після коригування віку, статі, куріння тютюну, фізичної активності та загального споживання енергії істотних відмінностей не спостерігалося.
У таблиці 4 описані середні антропометричні вимірювання за APOA2 генотипи та споживання SFA. У носіїв аллелю Т не було знайдено значущої асоціації за вагою, ІМТ та окружністю талії між двома категоріями споживання SFA (Таблиця 4 Асоціація поліморфізму APOA2 з антропометричними змінними в різних категоріях споживання насичених жирних кислот
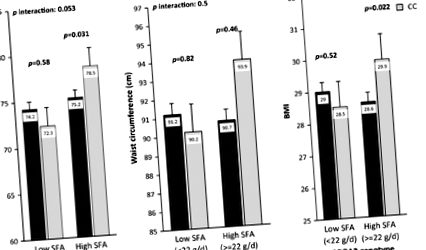
За результатами рис. 1, після корекції віку, статі, куріння тютюну, фізичної активності та загального споживання енергії, ІМТ та вага не відрізнялись у всіх суб’єктів (група CC та TC + TT) з низьким споживанням SFA (рис. 1
Взаємодія між поліморфізмом APOA2 та споживанням насичених жирних кислот щодо ваги (a), окружність талії (b) та ІМТ (c). Засоби коригуються відповідно до віку, статі, тютюнопаління, фізичної активності, загального споживання енергії (a, c) та індекс маси тіла (b). стор Отримані взаємодії з багатоваріантною моделлю взаємодії, що містить споживання жиру як категоричну змінну та поліморфізм APOA2 та додатковий контроль для коваріатів, зазначених вище. Бари вказують середнє значення ± SD
Після поправки на незрозумілі фактори між ними не було значної взаємодії APOA2 генотипи та споживання SFA щодо окружності талії.
Таблиця 5 показує, що концентрація греліну була значно вищою в групі CC, ніж у групі TT + TC (стор = 0,03), тоді як після поправки на незрозумілі змінні (вік, стать, куріння тютюну, фізичну активність, ІМТ та загальне споживання енергії), рівень лептину в сироватці крові не був значущим між двома групами. У цьому дослідженні, на основі споживання SFA, не було знайдено суттєвої різниці між середнім рівнем гормону учасників та APOA2 генотипи (дані не наведені).
Обговорення
Ми виявили значну взаємодію між споживанням насичених жирних кислот та -256T> C APOA2 генотипи ІМТ. Наші результати узгоджуються з результатами попередніх досліджень, проведених у трьох американських популяціях (Corella et al. 2009), середземноморській популяції, китайських та азіатських індіанців (Corella et al. 2011), які брали участь у Сінгапурському національному огляді здоров’я. Ці дослідження показали зв'язок високого споживання SFA з вищим ІМТ та ожирінням у генотипі CC.
У нашій популяції частота гомозиготних другорядних носіїв алелів (CC) становила 12,5%, тоді як розподіл генотипу CC відрізнявся у різних популяціях (1–16%; Corella et al. 2009, 2011; Smith et al. 2011). У FOS (16%; Corella et al. 2009), дослідженні GOLDEN (15%; Corella et al. 2009) та серед середземноморської популяції (15%; Corella et al. 2011) поширеність СС була вищою, ніж у нас та інших популяція, тоді як частота генотипу CC була такою ж, як у нашому дослідженні (12%) серед іспанської популяції (Smith et al. 2011).
У поточному дослідженні ми розділили споживання SFA на дві групи (низький та високий) згідно з попередніми дослідженнями (Corella et al. 2009). У суб'єктів з нижчим споживанням SFA, після коригування віку, статі, фізичної активності та загального споживання енергії, не було значної зв'язку між середньою вагою або ІМТ та APOA2 генотипи. Однак ці відносини суттєво відрізнялись у пацієнтів з високим споживанням SFA. Після коригування віку, статі, фізичної активності, загального споживання енергії та ІМТ, як у групах споживання високого, так і в низькому рівні СФА, спостерігається значна взаємодія між окружністю талії та двома групами APOA2 генотипів не виявлено.
Механізм, за допомогою якого −256T> C APOA2 SNP впливає на обмін жирів досі невідомо. До цього часу дослідники описували це APOA2 транскрипція контролюється масивом регуляторних елементів від А до N у промоторній області гена. Поліморфізм −265T> C знаходиться в середині елемента D (Chambaz et al. 1991). Цей елемент пов'язує кілька різних ядерних факторів (Cardot et al. 1994). Припускають, що ядерно-зв'язуючі фактори в присутності алелю С були пов'язані з нижчими APOA2 експресія в клітинах печінки, що призводить до зниження APOA2 концентрація у плазмі крові (Van’t Hooft et al. 2001), тоді як результати цього дослідження вказують на те, що ймовірна різниця в APOA2 плазмова концентрація не впливала на антропометричні змінні, але зміни способу життя, такі як високе споживання SFA, можуть змінити невідомі метаболічні шляхи, що призводить до збільшення сприйнятливості до збільшення ваги та ожиріння.
Це є причиною того, що особи з генотипами CC, які споживають SFAs C поліморфізм, асоціювались із підвищеним рівнем греліну в сироватці крові, але не було значних APOA2-взаємодія насичених жирів з урахуванням гормональних змінних. Виходячи з цих висновків, персоналізовані дієтичні рекомендації щодо прийому СФА на основі генотипу можуть бути корисними для профілактики ожиріння.
- Абляція Iah1, гена-кандидата для індукованої дієтою жирової печінки, не впливає на ліпіди печінки
- Балансування омега-6 та омега-3 жирних кислот у готових до вживання терапевтичних продуктах (RUTF) BMC Medicine
- Посібник для онкологічних хворих з омега-3 жирних кислот, лляного насіння та заліза MD Anderson Cancer Center
- Олія і насіння камелії для омега-3 жирних кислот %% сеп
- Асоціація між споживанням рису, хліба та локшини та поширеністю безалкогольної жирної печінки