Зростання Mycobacterium avium субсп. паратуберкульоз, кишкова паличка, і Сальмонели Ентерітидіс під час приготування та зберігання йогурту
1 Laboratorio de Bacteriología, Grupo Sanidad Animal, EEA INTA, 7620 Balcarce, Аргентина
2 Facultad Ciencias Agrarias, UNMdP, CC 276, 7620 Balcarce, Аргентина
3 Facultad Ciencias Veterinarias, UNCPBA, Campus Universitario, Paraje Arroyo Seco, 7000 Tandil, Аргентина
Анотація
1. Вступ
Mycobacterium avium субсп. паратуберкульоз (MAP) є збудником паратуберкульозу або хвороби Джонна. MAP вражає домашніх і диких тварин, а у корів викликає хронічний ентерит, діарею, втрату ваги та прогресуюче виснаження, що з часом може призвести до смерті [1]. MAP також пов’язаний із хворобою Крона людини, системним розладом, який викликає головним чином хронічне запалення кишечника [2]. Припускають, що люди можуть заразитися через заражене молоко, хоча про виживання MAP під час маніпуляцій з промисловим молоком відомо відносно мало. Деякі автори припускають, що пастеризація здатна знищити мікобактерії. Таким чином, були проведені лабораторні дослідження для оцінки термостійкості MAP відповідно до диференціального розподілу термічної обробки під час пастеризації [3–6]. На відміну від цього, інші автори підтримують теорію про те, що MAP здатний протистояти пастеризації, коли він присутній у сирому молоці [7–13].
Дієздатний MAP був виявлений у комерційному пастеризованому молоці у Великобританії, США, Чехії та Індії [10, 11, 14–16]. Крім того, у Чеській Республіці, використовуючи F-57 або IS900 ПЛР у режимі реального часу, MAP було виявлено в 49% зразків сухого дитячого молока, в одному дослідженні отримано життєздатний MAP [17].
Тим не менше, мало публікацій щодо ПДК у молочних продуктах, крім рідини сухого молока та деяких сирів. Загалом, кисломолочні продукти створюють значні бар’єри для росту патогенів, починаючи з термічної обробки під час пастеризації, а потім додавання закваски та кислотного середовища під час бродіння, а також зберігання в холодильнику. ван Брандт та ін. інокулював MAP у молоко з надвисокою температурою (UHT) і спостерігав, що початковий показник MAP під час бродіння йогурту з подальшим зберіганням при 6 ° C залишався незмінним протягом 6 тижнів, незалежно від використовуваної закваски та вмісту жиру в молоці [18 ].
Метою цього дослідження було з'ясувати життєздатність MAP, Кишкова паличка, і S. Ентеритидис під час традиційної обробки та зберігання йогурту в холодильнику з молока після експериментальної інокуляції та визначають, чи є синергетичний або антагоністичний ефект між цими бактеріями.
2. Матеріали та методи
2.1. Штами бактерій
Штами бактерій виділяли в лабораторії бактеріології Національного інституту сільськогосподарських технологій (INTA), м. Балькарс (Аргентина), використовуючи штам MAP INTA SB, виділений з товарного молока, Кишкова паличка штам INTA 116/C3, отриманий з бичачого калу, та S. Штам Enteritidis INTA 86/360, виділений з птиці.
2.2. Підготовка інокулятів
Для приготування інокулята вищезазначені штами розморожували від рідкого азоту. MAP культивували на твердому середовищі яєчного жовтка Herrold's (HEYM) плюс 0,0002% (мас./Об.) Мікобактину J (Allied Monitor Inc., Fayette, MO, США) та пірувату натрію (Sigma Chemical Co., St. Louis, MO, USA ) протягом 8 тижнів при 37 ° C. Для приготування інокуляту, декілька колоній суспендували в 15 мл забуференного фосфатом сольового розчину (PBS) (pH = 7), регульованого до каламутності 0,5 за шкалою Мак-Фарленда [25], що містить
колонієутворюючі одиниці
. Кишкова паличка був вирощений на агарі McConkey (MC) і S. Ентеритид культивували на агарі Xilosa-Lisina-Desoxicolato з додаванням 0,46% тергітолу-4 (Sigma Chemical Co., Сент-Луїс, Міссурі, США) (XLDT4). І агари MC, і XLDT4 інкубували протягом ночі при 37 ° C. Згодом одна колонія будь-якої Кишкова паличка або S. Ентеритид суспендували в PBS pH 7,2 і використовували для висіву відвару від інфузії мозку і серця (BHI) (Oxoid, Великобританія), який далі інкубували протягом ночі при 37 ° C. Для приготування інокуляту обидві пробірки BHI розбавляли PBS (pH = 7,2) до кінцевої концентрації колонієутворюючих одиниць .
2.3. Приготування йогурту
Три традиційні йогурти були приготовані з використанням 360 мл комерційного молока UHT, 125 г комерційного йогурту, що містить закваску Streptococcus thermophilus і Lactobacillus bulgaricus, і 5 мл відповідного бактеріального посіву: Йогурт 1 (Y1): КАРТА, Йогурт 2 (Y2): Кишкова паличка + S. Enteritidis, і Йогурт 3 (Y3): КАРТА + Кишкова паличка + S. Enteritidis. Ферментацію проводили в термостатичному орбітальному шейкері (New Brunswick Scientific, модель E24) при 43 ° C протягом 3 год. Потім йогурти зберігали при 4 ° С протягом 20 днів.
2.4. Зразки йогурту
Зразки по 50 мл відбирали до і протягом усього часу приготування через 20 хв, 45 хв, 65 хв, 90 хв, 115 хв, 135 хв, 155 хв, 180 хв і 270 хв. Крім того, зразки також відбирали під час зберігання через 4,5 год, 24 год, 48 год, 4 дні, 10 днів, 15 днів та 20 днів після щеплення.
2.5. Підрахунок живих бактерій
КАРТА. Для знезараження зразків застосовується спосіб, запропонований Tacquet et al. [26] використовували з деякими модифікаціями: 35 мл кожного йогурту центрифугували при 6000 об/хв протягом 20 хв у холодильній центрифузі (Sigma 16-K, Німеччина) і гранулу ресуспендували в 15 мл щавлевої кислоти при 5% (мас.)/об.). Зразки витримували при 37 ° С протягом 10 хв, а потім ще раз центрифугували. Потім гранулу ресуспендували в 2 мл PBS і, нарешті, 160 μL культивували в HEYM плюс ванкоміцин 0,01% (мас./Об.), Амфотерицин В 5% (мас./Об.), Налідіксинову кислоту 0,3% (мас./Об.) Та ністатин 0,01% (мас./Об.). Середовище інкубували при 37 ° C протягом 40 днів і спостерігали щотижня для зростання MAP. Остаточний КУО був розрахований з урахуванням того, що кожному нахилу прищеплювали 160 μЛ. Результати виражаються як йогурт.
Кишкова паличка та S. Enteritidis. З кожної проби йогурту відбирали 5 мл і проводили 10 десяткових логарифмічних розведень у PBS (pH = 7,2). Використовуючи метод Майлза та Місри [27], аліквота 20 μL з кожного розведення висівали на три повторні MC і XLDT4 для Кишкова паличка і S. Штами Enteritidis відповідно. Агарові пластини інкубували протягом ночі при 37 ° С, а потім колонії підраховували у розведенні, що дозволяло ідентифікувати 3–30 окремих колоній. Результати були виражені як йогурт.
2.6. Визначення рН
рН вимірювали за допомогою рН-метра (Schott Gerate, CG 820, США).
2.7. Статистичний аналіз
Криві лінійної регресії підрахунків журналів аналізували в залежності від часу підготовки та зберігання. Аналіз проводився лише для Кишкова паличка і S. Ентеритид, порівнюючи поведінку обох бактерій у йогурті та кожної із двох йогуртових бактерій, які були щеплені. Використовувалась програма Статистичний аналіз програмного забезпечення (SAS) [28].
3. Результати
3.1. КАРТА Підраховує
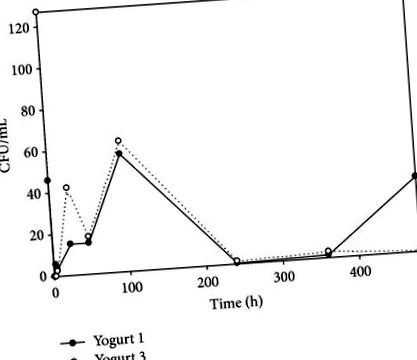
На початку підготовчого процесу, кількість ПДЧ у Y1 і Y3 становили 46 та 127 відповідно. Під час підготовчого процесу (до 135 хв) ПАР не виявлявся в жодному з йогуртів. Після цього MAP враховується Y1 становили 5,6 за 180 хв, але MAP не був ізольований від Y3. Через 4,5 год і під час зберігання при 4 ° C збільшився і досяг максимуму 56,5 і 62,7 через 4 дні в обох йогуртах, після чого життєздатність знову почала падати (рис.1 і 2).
3.2. Кишкова паличка і S. Enteritidis графів
Початковий рахунок для Кишкова паличка і S. Ентеритиди становили 5,3 та 5,5 log L-1 і зменшувались протягом першої години підготовки. Обидві бактерії досягли максимальної кількості за 24 год (6,4 log for Кишкова паличка і 5,3 журналу для S. Enteritidis). Життєздатність обох бактерій продовжувала незначно знижуватися до кінця випробування (5 log для Кишкова паличка і 4.6 журналу для S. Enteritidis) (Рисунки 3, 4, 5 та 6).
3.3. рН
Початковий рН був 6,1 для трьох йогуртів. У процесі бродіння рН поступово знижувався до 4,5. Від 180 хв до 4,5 год значення залишались у цьому діапазоні. Потім рН залишався стабільним на рівні 4,5 протягом усього зберігання до кінця випробування (малюнки 7 та 8).
3.4. Статистичний аналіз
Регресійний аналіз журналу підрахунків Кишкова паличка і S. Enteritidis порівняно з часом приготування та зберігання в Y3 дав
), який показує, що зміна у підготовці часу зберігання є причиною 94,25% змін у кількості бактерій. Порівнюючи поведінку обох бактерій, спостерігали статистичні відмінності (). В Y2, значення становило 0,58, що вказує на те, що коливання у часі приготування та зберігання пояснює 58,27% змін у кількості бактерій. У цьому випадку поведінка обох бактерій статистично не відрізнялася (
). З іншого боку, аналіз поведінки Кишкова паличка в Y3 і Y2 не показав суттєвих відмінностей (). Натомість, S. Ентерітидіс продемонстрував різну поведінку в обох йогуртах (), що відбувається в Y3 щеплений MAP.
4. Обговорення
4.1. Зростання КАРТИ
Оскільки молоко є живильним середовищем, придатним для росту мікроорганізмів, сире молоко може бути важливим джерелом патогенних мікроорганізмів для людини. Здатність MAP пережити певні методи переробки їжі та зберігати несприятливі умови, в поєднанні з можливою причетністю до хвороби Крона, викликала занепокоєння щодо впливу на людину цього патогену. Для комерційного виробництва йогурту та інших кисломолочних продуктів сире молоко зазвичай спочатку пастеризують. Однак повне усунення ПДЧ шляхом пастеризації все ще обговорюється. Якщо MAP дійсно присутній у пастеризованому молоці, він може передаватися людям після споживання побічних продуктів. Тому цікаво отримати уявлення про поведінку MAP у таких продуктах, як кислотна природа йогурту (рН близько 4–4,5), як правило, сприяє інактивації бактеріальних збудників [18].
MAP виділяли до кінця цього дослідження (20 днів зберігання), демонструючи його здатність протистояти кислим умовам, що утворюються під час приготування йогурту, і низьким температурам зберігання. У всіх зразках кількість MAP була низькою через агресивний етап дезактивації. ван Брандт та ін. [18] виявив, що початковий показник MAP залишається незмінним протягом 6 тижнів зберігання в холодильнику, незалежно від використовуваної початкової культури та вмісту жиру в молоці, але не оцінив його ізоляції під час приготування. Сунг і Коллінз [29] встановили, що при низькому рівні рН в пробірці, MAP експресував два білки, споріднені за кислотною толерантністю. Однак вони не могли передбачити криву виживання MAP у продуктах харчування, де інші фактори можуть впливати на її життєздатність. У цій роботі MAP не був ізольований під час процесу приготування, що свідчить про те, що раптове зниження рН могло спричинити пошкодження бактерій, і тому культивувати його на штучних культуральних середовищах було неможливо. Крім того, MAP рекуперували через 4,5 год після щеплення, припускаючи, що спочатку він міг перебувати в життєздатному не культивованому стані і після періоду адаптації.
У попередній роботі під час приготування та зберігання сиру, виготовленого з козлом та бичачим молоком, MAP був виділений лише тоді, коли непастеризоване молоко використовувалося до 60 днів дозрівання. Високі значення рН спостерігались між 30 і 45 днями зберігання, що збігалося з подальшим виділенням MAP [30]. Також було помічено, що рН, температура та концентрація солі можуть впливати на життєздатність MAP [31–33].
4.2. Зростання Кишкова паличка і S. Enteritidis
4.2.1. Підготовка
4.2.2. Зберігання
Подальші дослідження слід провести для оцінки конкурентних механізмів інгібування цих патогенів в пробірці а також їх стійкість до різних температур і рівнів рН з метою покращення оптимальних умов для переробки молочних продуктів та забезпечення їх усунення.
5. Висновки
У цьому дослідженні представлено докази того, що бактерії-збудники люблять MAP, Кишкова паличка, і S. Ентерітидіс може пережити умови бродіння йогурту та низький рівень рН з наступним зберіганням у холодильнику принаймні 20 днів. Таким чином ці патогени присутні в сировині, і вони можуть потрапити до споживачів. Висвітлено важливість впровадження належних виробничих практик під час виробництва та зберігання йогурту. Тому подібні дослідження слід проводити з різною концентрацією бактерій, намагаючись імітувати природне забруднення.
Подяка
Дослідження було підтримано проектом (AESA 202831) Національного інституту сільськогосподарських технологій (INTA) Аргентини.
Список літератури
- Дефіцит гормону росту; HGH для жінок BodyLogicMD
- Евеліна Бледанс фото, біографія, фільмографія, ріст
- Ринок добавок до здоров’я на 2020-2026 роки, що розвиваються в галузі, зосереджується на факторах зростання за основними напрямками
- Дріжджі Cyberlindnera jadinii як джерело білка для курчат-бройлерів впливають на ефективність росту
- Жуйте це листя на порожньому шлунку для користі для здоров’я, як втрата ваги, ріст волосся, краще