Залежні від стану сну зміни функціонального зв’язку мозку в умовах уретанової анестезії в моделі щурячої хвороби Паркінсона на ранніх стадіях
Катерина Жураковська
1 Інститут молекулярних наук А. І. Віртанена, Університет Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Хуусо Лейкас
2 Школа фармації Університету Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Тійна Пірттімякі
1 Інститут молекулярних наук А. І. Віртанена, Університет Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Франческо Касас Пн
2 Школа фармації Університету Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Мікко Гінтер
2 Школа фармації Університету Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Рубін Алієв
3 Московський фізико-технічний інститут, 117303, Москва, Росія
4 Інститут теоретичної та експериментальної біофізики, 142292, м. Пущино, Росія,
Томі Рантамякі
5 Лабораторія нейротерапії, Відділ фармакології та фармакотерапії, Фармацевтичний факультет, Гельсінський університет, Гельсінкі, FI-00790, Фінляндія
Хейккі Таніла
1 Інститут молекулярних наук А. І. Віртанена, Університет Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Маркус М. Форсберг
2 Школа фармації Університету Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Оллі Грен
1 Інститут молекулярних наук А. І. Віртанена, Університет Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Яакко Паасонен
1 Інститут молекулярних наук А. І. Віртанена, Університет Східної Фінляндії, Куопіо, FI-70211, Фінляндія
Ааро Дж. Ялканен
2 Школа фармації Університету Східної Фінляндії, Куопіо, FI-70211, Фінляндія
E.Z., J.L., T.P., M.M.F., O.G., J.P. та A.J.J. розроблені дослідження; E.Z., J.L., F.C.M., M.G., J.P. та A.J.J. виконані дослідження; E.Z., J.L., M.G., J.P. та A.J.J. проаналізовані дані; E.Z., J.L., T.P., M.G., R.A., T.R., H.T., M.M.F., O.G., J.P. та A.J.J. написав роботу.
Анотація
Заява про значущість
Порушення режиму сну та швидкий рух очей (REM) - розлад поведінки сну є одними з перших симптомів хвороби Паркінсона (PD). Однак порушення сну, пов’язані з ПД, практично не вивчені на моделях тварин. Це перше дослідження, яке вивчало функціональну зв'язність (ФК) під час індукованих уретаном сноподібних станів у частковій смугастій моделі 6-OHDA з ураженням щурів на ранніх стадіях ПД з використанням функціональної магнітно-резонансної томографії (fMRI). Ми виявили, що ФК значно знижується у тварин, ушкоджених 6-OHDA, але лише під час REM-подібного стану. Ці зміни торкнулись як пошкоджених, так і інтактних півкуль, здебільшого за участю кортикокортикальних та кортикостріальних зв’язків. Результати свідчать про те, що ця модель щурів є перспективним інструментом для вивчення порушень сну при ранніх стадіях БП з фМРТ у стані спокою.
Вступ
Хвороба Паркінсона (БП) є другим за поширеністю нейродегенеративним захворюванням і найпоширенішим руховим розладом, що вражає 1% населення у всьому світі після 70 років (Pringsheim et al., 2014). Поступова дегенерація та втрата дофамінергічних нейронів у середньому мозку substantia nigra pars compacta є патологічними ознаками, що призводять до виснаження дофаміну (DA), що призводить до прогресуючих рухових симптомів, включаючи брадикінезію, ригідність та тремор у стані спокою, які характерні для PD (Schapira, 2009). На додаток до рухових симптомів, пацієнти з БД страждають від різноманітних немоторних симптомів, включаючи розлади сну, нюхову дисфункцію, біль, депресію, тривогу, імпульсивну поведінку та когнітивні порушення, які суттєво негативно впливають на якість життя пацієнта ( Титова та Чаудхурі, 2017).
Пацієнти з БД можуть відчувати різні розлади сну, такі як синдром неспокійних ніг, швидкий рух очей (REM), розлад сну (RBD), фрагментація сну та безсоння (French та Muthusamy, 2016). Оскільки порушення сну з’являються за кілька років до появи рухових дефіцитів (Bargiotas et al., 2016), вони розглядаються як ранній маркер розвитку ПД. Зокрема, наявність РБД являє собою значно підвищений ризик розвитку ПД (Постума та ін., 2013). У хворих на РД із РБД спостерігається посилення відкладення α-синуклеїну (Postuma et al., 2015), більш серйозні початкові рухові симптоми, і вони потребують вищих доз леводопи в міру прогресування захворювання (Chung et al., 2017). Примітно, що зміни в організаціях мозкових мереж були пов'язані з RBD ще до настання очевидних рухових порушень при PD (Ellmore et al., 2013). Таким чином, експериментальна модель, що імітує ранні розлади сну, необхідна для оцінки потенційних методів лікування цих розладів, і вона також може представляти новий підхід для тестування нових методів модифікації захворювань на ранніх стадіях БП.
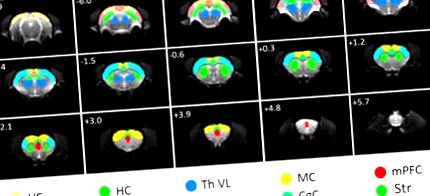
ROI, що використовуються для аналізу FC. ROI накладаються на оригінальні функціональні МРТ-зображення із спін-ехо-ехопланарними зображеннями. AC, слухова кора; CgC, сингулярна кора; HC, гіпокампу; MC, рухова кора; mPFC, медіальна префронтальна кора; RC, ретроспеніальна кора; СК, соматосенсорна кора; Вул., Стріатум; Th VL, черевний латеральний таламус; ВК, зорова кора. Відстань до брегми в міліметрах позначено у верхньому лівому куті кожного зрізу.
Для отримання показників для коефіцієнта коефіцієнта коефіцієнта часткової кореляції між ROI (або ROI та вокселями на картах кореляції) розраховували за допомогою MATLAB. Усі шість параметрів корекції руху, отримані за допомогою SPM, використовувались як регресори в кореляційних розрахунках, щоб мінімізувати вплив руху на результати.
Оцінка стану сну та ФК
Коливання частоти дихання під час фМРТ використовувались як непрямі заходи для виявлення спонтанних станів, подібних до сну, як описано (Wilson et al., 2011; Pagliardini et al., 2012). Стани з високою та низькою частотою дихання були вручну позначені як REM-подібні та не-REM (NREM) -подібні стани сну відповідно. Тварини з переходами між NREM-подібним та REM-подібним станом були включені в аналіз стану сну. Дані fMRI із державним позначенням були розділені на вікна розміром 30 томів. Помічені державою часткові коефіцієнти кореляції були розраховані для кожного вікна і згодом усереднені для кожного суб'єкта. Якщо у тварини не було принаймні 90 обсягів фМРТ стану, подібного до сну, це було виключено з аналізу стану сну.
Розтин зразків мозку та біохімічні аналізи
Стриатальне співвідношення DA, GABA та глутамату розраховували за рівнянням Сторона з боку/Синтакт.
Статистичний аналіз
Далі ми порівняли ФК у стані спокою, отриману за весь період вимірювання fMRI між 6-OHDA і групами контролю. Цей аналіз не виявив суттєвих відмінностей у ФК між загальнозв'язаними 6-OHDA і контрольними тваринами; спостерігалися лише тенденції до збільшення ФК з правого на лівий вентральний латеральний таламус (p = 0,048, не коригується FDR) та з правого вентрального латерального таламуса на поширювальну кору (p = 0,040, не коригується FDR). Крім того, спостерігалася тенденція до зниження ФК від іпсилатерального до контралатерального смугастого тіла (р = 0,047, не виправлено FDR). Однак після корекції для багаторазових порівнянь ці тенденції стають незначними.
ФК під час різних станів сну
Той факт, що швидкий сон є більш активним та енерговитратним станом (Steriade and Hobson, 1976; Franzini, 1992; Lenzi et al., 2000), ніж сон NREM, і припущення, що порушення сну, пов'язані з REM-сном, є ранніми симптомами прогресуючої нейродегенерації у хворих на БП (Heller et al., 2017) спонукали нас відокремити REM та NREM стани, подібні до сну, в нашому аналізі rsfMRI. На основі коливань частоти дихання (Wilson et al., 2011) ми спостерігали чіткі зміни стану між REM-подібним та NREM-подібним станом у контрольних тварин 8/19 та тварин 8/18. У решти тварин спостерігався лише один стан сну, і вони були виключені з аналізу FC стану сну. Відсутність переходів у стані сну приблизно у половини тварин можна пояснити різницею в глибині наркозу (Gretenkord et al., 2016) або факторами, що впливають на дихальну функцію, такими як температура навколишнього середовища (Whitten et al., 2009) або інгаляційний кисень (Pagliardini et al., 2013; Hauer et al., 2018). Середня тривалість для REM-подібних та NREM-подібних станів становила 99 ± 80,4 та 78,6 ± 70,8 с відповідно. Не було значних відмінностей у тривалості стану між контрольними та тваринами, ушкодженими 6-OHDA (p = 0,96 для REM-подібних станів, p = 0,84 для NREM-подібних станів, непарний t-тест).
Воксель-аналізи на основі насіння, отримані з іпсилатеральної рухової кори та смугастого тіла (рис. 5), ілюструють індуковані 6-OHDA великі стриатокортикальні та подальші кортикокортикальні порушення в ФК під час REM-подібного стану сну. Під час стану, подібного до NREM, відмінностей не спостерігалося (дані не наведені).
- Керівництво з природного здоров’я - Трави, що сприяють підвищенню пам’яті та мозку
- Переїдання Це може бути глюком у мозку в Америці, патч США
- Лікування нейропластичності, як це може допомогти вам оговтатися від травми мозку
- Переробляйте свій мозок для схуднення (частина V) Припиніть підраховувати калорії; Джорджі Страх
- Купуйте найздоровіші таблетки для схуднення (найкраща дієта) Таблетки від надзвичайних втрат жиру BRAIN VISTEC