Залежне від гліфосату інгібування фотосинтезу у Верби
Марсело П. Гомес
1 Лабораторія екотоксикології водних мікроорганізмів, GRIL, TOXEN, Відділ біологічних наук, Університет Квебеку в Монреалі, Монреаль, QC, Канада
2 Laboratório de Fisiologia Vegetal, Instituto de Ciências Biológicas, Departamento de Botânica, Universidade Federal de Minas Gerais, Белу-Орізонті, Бразилія
Сара Г. Ле Манах
1 Лабораторія екотоксикології водних мікроорганізмів, GRIL, TOXEN, Відділ біологічних наук, Університет Квебеку в Монреалі, Монреаль, QC, Канада
Луїза Ено-Етьє
3 Інститут наук про навколишнє середовище, Університет Квебека в Монреалі, Монреаль, КК, Канада
Мішель Лабрек
4 Institut de Recherche en Biologie Végétale, Монреальський ботанічний сад, Монреаль, QC, Канада
Марк Люкотт
3 Інститут наук про навколишнє середовище, Університет Квебека в Монреалі, Монреаль, КК, Канада
Філіпп Джуно
1 Лабораторія екотоксикології водних мікроорганізмів, GRIL, TOXEN, Відділ біологічних наук, Університет Квебеку в Монреалі, Монреаль, QC, Канада
3 Інститут наук про навколишнє середовище, Університет Квебека в Монреалі, Монреаль, КК, Канада
Пов’язані дані
Анотація
Вступ
Гліфосат [N- (фосфонометил) гліцин)] є найбільш широко застосовуваним гербіцидом у всьому світі з моменту впровадження рослин, стійких до гліфосату (GR) (Coupe et al., 2012). Хоча він був запропонований як один з найменш токсичних пестицидів для тварин та людей (Williams et al., 2000; Cerdeira and Duke, 2006), широке використання гліфосату разом з його великою розчинністю викликає певні занепокоєння щодо його можливого впливу на навколишнє середовище.
Реактивні форми кисню є важливими для сигналізації рослин; однак, накопичившись, АФК стають токсичними, індукуючи незворотні зміни в метаболізмі, клітинному циклі та посилюючи окислювальні сплески (Gomes et al., 2014a). Взаємодіючи з біологічними молекулами, АФК може спричинити руйнування ДНК, ліпідів та білків (Foyer and Noctor, 2011). Щоб уникнути окисного пошкодження внаслідок накопичення АФК, рослини розробили ферментативну (наприклад, SOD, CAT, APX, GPX та GR) та неферментативну (наприклад, аскорбат та глутатіон) системи (Foyer and Noctor, 2011). Активність антиоксидантних систем, а також ступінь перекисного окислення ліпідів є маркерами окисного стресу, які, як було показано, модулюються впливом гліфосату (Ahsan et al., 2008; Moldes et al., 2008; Miteva et al., 2010).
Матеріали і методи
Тепличні експерименти
Фотосинтез (з використанням кінетичних вимірювань флуоресценції хлорофілу) та біохімічні оцінки проводили через 0, 6, 24, 48 та 72 год після початку обробок. Оцінки були припинені через 72 години впливу, оскільки рослини, які отримували найвищий рівень гліфосату, виявляли виражені симптоми інтоксикації, включаючи кілька некротичних плям та втрату листя (дані не наведені). Після оцінки провідності фотосинтезу та устьиць рослини збирали та ретельно промивали дистильованою водою. Зразки від сьомого (першого повністю розширеного листка від верхівки) до дев'ятого листка негайно заморожували в рідкому азоті і зберігали в папері з алюмінієвої фольги при -80 ° C до біохімічних оцінок та оцінок окисних пошкоджень.
Газообмін, флуоресценція хлорофілу та концентрації пігменту
Газообмін, флуоресценцію хлорофілу та вміст пігменту вимірювали на зразках з першого, другого та третього повністю розширених листків (сьоме – дев’яте листя з верхівки), які також отримували гербіцид, в цілому три вимірювання на рослину. Вимірювання провідності устьиць (gs) проводили за допомогою листового порометра (модель SC-1, Decadon Devices Inc., Вашингтон, округ Колумбія, США). Потім ці листки піддавали темній клітці протягом 20 хв, і випромінювання флуоресценції хлорофілу оцінювали за допомогою флуорометра з імпульсно-амплітудною модуляцією (PAM) (модель PAM-2500, WALZ, Effeltrich, Німеччина). Аналіз RLC проводили згідно з Джуно та співавт. (2015). Було проведено 11 кроків RLC. Насичувальні імпульси спрацьовували з інтервалами 0,8 хв з різною актинічною інтенсивністю світла для кожного кроку (0, 31, 48, 76, 117, 179, 253, 405, 586, 874 та 1326 мкмоль фотонів м -2 с -1). За допомогою RLC проводили оцінку таких параметрів: ETR (Krall and Edwards, 1992), qP (van Kooten and Snel, 1990), UQFrel (Juneau et al., 2005), NPQ (Redondo- Gómez et al., 2008) та FV/FM (Kitajima and Butler, 1975). Для порівняння методів лікування використовували результати флуоресценції фотонів 874 мкмоль м -2 с -1 (найбільш подібне опромінення щодо умов росту світла). Також були побудовані криві ETR проти опромінення, а ETRmax та Ik були розраховані згідно з Eilers and Peeters (1988).
Для оцінки пігментів з кожного листа брали по три позакореневі диски діаметром приблизно 5 мм, а після визначення свіжої маси зразків їх хлорофіл та каротиноїдні пігменти витягували у 80% ацетоні після мацерації дисків ступкою. Спектральне поглинання екстрактів (від 300 до 800 нм) вимірювали за допомогою спектрофотометра Varian Cary ® 300 Bio UV-Vis (Varian, США). Концентрації (мкг/г маси свіжого листя) загальних хлорофілів та каротиноїдів розраховували, використовуючи рівняння, описані Ліхтенталером та Веллберном (1983).
Біохімічні оцінки
Для оцінки окисних реакцій вивчали вміст H2O2, MDA та активність антиоксидантних систем, дотримуючись методів, описаних Gomes et al. (2014c). H2O2 екстрагували в 2 мл 0,1% трихлороцтової кислоти (ТСА) і після центрифугування при 12000 × g протягом 15 хв 300 мкл центрифугованої надосадової рідини реагували з 0,5 мл 10 мМ фосфатного буфера калію (pH 7,0) і 1 мл 1 М КІ. Зразки відчитували при 390 нм, і концентрації H2O2 визначали, використовуючи коефіцієнт екстинкції (𝜀) 0,28 мМ -1 см -1. Оцінка перекисного окислення ліпідів базувалася на утворенні 2-тіобарбітурової кислоти реактивних метаболітів, особливо MDA. Зразки, що містять 200 мг листкової та кореневої тканини, мацерували в 5 мл 0,1% ТСА. Після повної гомогенізації 1,4 мл гомогенату переносили в пробірку Епендорфа і центрифугували при 10000 об/хв протягом 5 хв. Аліквоту 0,5 мл супернатанту додавали до 2 мл 0,5% (об/об) TBA (тіобарбітурової кислоти) у 20% TCA. Суміш нагрівали на водяній бані при 95 ° С протягом 30 хв, а потім охолоджували льодом протягом 10 хв. Показання проводили за допомогою спектрофотометра при 535 і 600 нм.
Для вивчення антиоксидантних ферментів 0,1 г листя мацерували у 800 мкл екстракційного буфера, що містив 100 мМ калієвий буфер (рН 7,8), 100 мМ ЕДТА, 1 мМ L-аскорбінової кислоти та 2% ПВП (м/об). Вміст білка в зразках визначали методом Бредфорда. Була оцінена діяльність SOD (EC 1.15.1.1), CAT (EC1.11.1.6), APX (EC 1.11.1.11), GPX (E.C. 1.11.1.9) та GR (E.C. 1.6.4.2). Для оцінки пулу аскорбатів [загальний аскорбат (AsA + DHA), AsA і DHA] 0,2 г замороженої тканини подрібнювали в рідкому азоті в ступці та гомогенізували з 5 мл 6,5% (мас./Об.) М-фосфорного кислота, що містить 1 мМ NaEDTA.
Статистичний аналіз
Результати виражали як середнє значення для трьох повторень. Статистичний аналіз проводили з використанням програмного забезпечення JMP 10.0 (SAS Institute Inc). Результати були подані на тести нормальності (Шапіро – Вільк) та однорідності (Бартлетт), а потім статистично оцінені. Для вимірювання відмінностей у досліджуваних змінних під час впливу обробок використовували однофакторні одноразові вимірювання MANOVA, в яких фактор Time - фактор, що впливає на суб’єкт, і концентрація гербіцидів як основні ефекти. Гліфосат, час та взаємодія між гліфосатом та часом були включені в модель. Сферичність даних перевірялася за критеріями Моклі, щоб визначити, чи дійсні одновимірні F-тести для внутрішньосуб’єктних ефектів. У випадках недійсного F для оцінки епсилону (𝜀) використовували тест Теплиці houseейзера - Гейзера. Контрастний аналіз застосовували, коли існували суттєві відмінності у змінних між обробками (Додаткові таблиці 1S та 2S).
Результати
Вміст пігменту, газообмін та флуоресценція хлорофілу
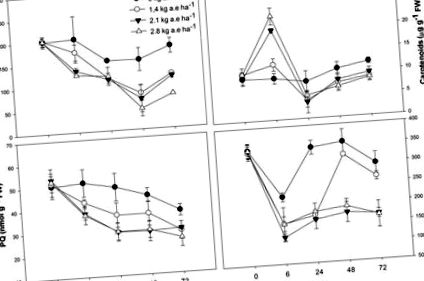
Загальні концентрації хлорофілу та пластохінону знижувались у листках рослин під впливом гербіцидів та часом обробки (Р> 0,001; Рисунок Рисунок1 1 ). Концентрація каротиноїдів була вищою у рослин, оброблених гербіцидами, через 6 год для всіх застосованих доз (Рисунок Рисунок1 1 ); потім концентрація каротиноїдів знизилася у рослин, які протягом щонайменше 24 год зазнавали концентрації гербіцидів (P Рис. 1 1 ). Подібні ефекти спостерігались на ETRmax, Ik та qP, які були значно знижені в оброблених рослинах (P Рис. 2 2 ). Однак для першої оцінки (6 год) ETRmax, Ik та qP не зменшувались у рослин, оброблених 1,4 кг a.e га -1 (P> 0,05; Рисунок Рисунок2 2 ). UQFrel збільшився у всіх оброблених рослинах (Рисунок Рисунок1 1 ). Одночасно NPQ зменшувався у рослин, які протягом 24 годин зазнавали впливу гербіциду (P Рис. 2 2 ). Максимальна фотохімічна ефективність PSII (FV/FM) була знижена у рослин, оброблених гербіцидами (P -1 лише через 72 години впливу гербіцидів (P Рис. 2 2 ). У рослин, що зазнали впливу 2,1 кг а.е. га -1, спостерігалося зниження FV/FM через 48 і 72 год експозиції (P -1 - зниження FV/FM (P Рис. 2 2 ).
Часові курси концентрацій пігменту (загального хлорофілу та каротиноїдів), пулу пластохінону (PQ) та провідності устьиць (gs) у листі рослин Salix miyabeana (сорт SX64), розподілених із збільшеними дозами (0, 1,4, 2,1 та 2,8 кг аерозолю) га -1) норми гербіциду на основі гліфосату (Фактор ® 540). Значення - це середнє значення ± SE трьох повторень.
Курсові вимірювання, пов'язані з фотосинтезом [максимальна швидкість переносу електронів (ETRmax), мінімальна насичувальна освітленість (Ik), фотохімічне гартування (qP), нефотохімічне гартування (NPQ), відносна неугашена флуоресценція (UQFrel) та максимальна фотохімічна ефективність PSII (FV/FM)] у листі рослин Salix miyabeana (сорт SX64), розповсюджених з дозами підвищених (0, 1,4, 2,1 та 2,8 кг ае га -1) норм гербіциду на основі гліфосату (Factor ® 540). Значення - це середнє значення ± SE трьох повторень.
Зміст шикімату та проліну
Концентрації шикімату та проліну в листі рослин, оброблених гербіцидами, завжди були вищими, ніж у контролі (P Рис. 3 3 ). У рослин, які зазнали впливу 2,1 та 2,8 кг а.е. га -1, було знайдено важливе скупчення шикімату через 72 год обробки гербіцидами (Р -1) гербіциду на основі гліфосату (Фактор ® 540). Значення - це середнє значення ± SE трьох повторень.
Зміст H2O2 та перекисне окислення ліпідів
Порівняно з контролем, концентрація H2O2 завжди була вищою у рослин, що зазнали дії гербіциду (P Рис.3 3 ) і значно зросла у цих рослин через 72 год (P Рис. 3 3 ). У всіх рослинах вміст МДА дещо збільшився через 24 год (Р> 0,05). Однак у рослин, оброблених гербіцидом, спостерігалося виражене збільшення концентрації MDA через 72 год (Р Малюнок 4 4 ). Ми виявили, що: (1) Активність СОД та APX була вищою у рослин, оброблених гербіцидами, до 24 годин (P Рисунок 5 5 ) ми виявили, що стосовно контролю: (1) загальні концентрації аскорбату (AsA + DHA) були вищими у рослин, оброблених гербіцидами, до 24 годин експозиції, а потім були зменшені для наступних рівнів експозиції (P -1) гербіциду на основі гліфосату (Фактор ® 540). Значення - це середнє значення ± SE трьох повторень.
Часові курси загального аскорбату (AsA + DHA), відновленого аскорбату (AsA), окисленого аскорбату (DHA) та співвідношення AsA/DHA у листках рослин Salix miyabeana (сорт SX64), розповсюджених із збільшеними дозами (0, 1.4, 2.1, та 2,8 кг ае га -1) норми гербіциду на основі гліфосату (Фактор ® 540). Значення - це середнє значення ± SE трьох повторень.
Обговорення
У цьому дослідженні вперше було проведено широке дослідження впливу гербіциду на основі гліфосату на кілька фізіологічних процесів. Ми продемонстрували, що цей тип гербіциду впливав не тільки на шикімальний шлях, але і на кілька фізіологічних процесів у верб, як раніше повідомляли Гомес та ін. (2016b). Рисунок Рисунок6 6 представляє інтегративну модель, що взаємозв'язує вивчені фізіологічні параметри (зокрема, шикіматний шлях, фотосинтетичні процеси та окислювальні події), на які впливає вплив гербіциду на основі гліфосату більше 24 годин (48 та 72 годин). Різні етапи цієї моделі в тексті визначені як Рисунок Рисунок6 6 , No1–19.
Взаємозв’язана модель впливу гербіциду на основі гліфосату (Фактор ® 540) на шикіматний шлях, фотосинтез та окислювальні маркери рослин верби. Цифри відповідають згаданим у дискусії. ABA, абсцизова кислота; ALA, δ-амінолевулінова кислота; APX, аскорбатпероксидаза; AsA, аскорбат; EPSPS, 5-енолпірувілшикімат-3-фосфатсинтаза; ETR, швидкість транспорту електронів; FV/FM, максимальна фотохімічна ефективність PSII; GPX, глутатіонпероксидаза; gs, провідність устьиць; H2O2, перекис; Ik, мінімальне насичувальне опромінення; MDA, перекисне окислення ліпідів; NPQ, нефотохімічне гартування; qP, фотохімічне гартування; СОД, супероксиддисмутаза; UQFrel, відносна непогашена флуоресценція. Інформація, заснована на літературі, у моделях виражена курсивом та пунктирними стрілками. Хоча спостережувані дані, отримані в цьому дослідженні, вводяться в модель у вигляді жирних слів та стрілок без крапок.
Ми також спостерігали цікаву реакцію активності GR протягом 48 та 72 годин, оскільки його активність не суттєво знижувалась під впливом гербіцидів на основі гліфосату. GR пов'язаний з активністю APX та GPX циклічним глутатіон-аскорбатним циклом (Foyer and Noctor, 2011). Однак, як уже згадувалося, активність GR не дотримувалася APX та GPX під час впливу гербіцидів. Підтримання активності GR у оброблених рослинах вказує на те, що активність APX та GPX не обмежувалась доступністю субстрату, що підсилює те, що запропоноване окислювальне пошкодження (карбонілювання білка) ферментів може бути причиною їх дегенерації. Ми можемо висловити гіпотезу, що, подібно до виробництва проліну, вища активність GR-залежної від NADP (H) може сприяти OPPP та сприяти фотохімії як джерело NADP +.
Внески автора
MG, SL проводили експерименти; MG, MLa та PJ розробляли експерименти; MG і PJ написали роботу; LH-E та MLu надали технічну підтримку та концептуальні поради.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Межі Вплив повільного дихання на гальмування після психологічних фізичних навантажень
- Дієтичні поліненасичені жирні кислоти n-3 та пряме інгібування реніну покращують електричне ремоделювання
- Farmina Pet Foods - Корм для собак - Farmina Vet Life canine - Водна ниркова їжа Canine
- Далекозорість Причини та коригуючі методи лікування
- Вартість життя диктує, чим харчуються кити, дельфіни та морські свині Важливість якості здобичі на