Вплив видалення жиру на толерантність до глюкози характерний для мишей самців та самок
Анотація
енергія переважно зберігається у вигляді ліпідів у білій жировій тканині (WAT), і WAT з різних анатомічних місць був залучений до регуляції широкого спектру метаболічних параметрів. Абдомінальне ожиріння з надмірною підшкірною абдомінальною та внутрішньочеревною ВАТ, наприклад, пов'язане з підвищеною резистентністю до інсуліну. Однією з гіпотез є те, що внутрішньочеревна ВАТ має непропорційно несприятливий вплив на гомеостаз глюкози (7, 10, 27, 42, 44), і ця концепція підтверджується кількома дослідженнями на людях (12, 15, 37), але оскаржується в інших (1, 2, 18, 30), які свідчать про те, що підшкірна абдомінальна ВАТ більш тісно пов’язана з резистентністю до інсуліну.
Хірургічне видалення WAT, тобто за допомогою ліпосакції або ліпектомії, було використано для вивчення взаємозв’язку між абдомінальним ожирінням та резистентністю до інсуліну у людей та гризунів. Ліпосакція жінок, що страждають ожирінням, що спричиняє значне зменшення підшкірного жиру в животі, не призводить до покращення чутливості до інсуліну, рівня глюкози в плазмі та рівня інсуліну (25). Поліпшення інсулінорезистентності після видалення певних складів WAT у моделей із ожирінням на щурах забезпечує пряме підтвердження причинно-наслідкової ролі цих жирових прокладок у спричиненні резистентності до інсуліну. Наприклад, одночасне видалення як гонадної епідидимальної WAT (EWAT), так і внутрішньочеревної перинефричної WAT у стареючих ожирілих самців щурів призводить до помітного зниження резистентності до інсуліну (5, 16). Чоловіки та жінки по-різному розподіляють жир в організмі, причому жінки мають відносно більше підшкірного жиру, а чоловіки мають більший відсоток вісцерального жиру (22, 26, 44), а чоловіки мають більший ризик виникнення метаболічних розладів, пов’язаних з ожирінням. Це робить необхідним розуміння того, як конкретні жирові депо можуть сприяти гомеостазу глюкози та іншим метаболічним параметрам і чи відрізняються чоловіки та жінки принципово.
Метою поточного дослідження було визначити внесок конкретних індивідуальних депо WAT у гомеостаз глюкози у дорослих мишей чоловічої та жіночої статі та середнього ожиріння, які харчувалися дієтою на основі жирного масла (HFD). Ми оцінили толерантність до глюкози до та після видалення порівнянної кількості черевної підшкірної пахової ВАТ (IWAT), внутрішньочеревної заочеревинної ВАТ (RWAT), чоловічої статевої залози EWAT або жіночої гонадної параметричної ВАТ (PWAT). Оскільки жирові тканини в різних місцях досить різні за розміром, ми видалили еквівалентну кількість жирової тканини у кожної статі та дієтичної когорти, на відміну від цілих жирових прокладок; таким чином можна безпосередньо порівняти ефекти та внесок окремих місць жирової тканини. RWAT менше у жінок, ніж у чоловіків, тоді як загальний рівень жиру в тілі порівнянний між чоловіками та жінками. Таким чином, у жінок було видалено менший відсоток загального жиру, ніж у чоловіків. Як наслідок, всі прямі порівняння проводяться в межах кожної статі.
Тварини.
Визначення циклічності.
Вагінальні мазки проводили відразу після IPGTT та IPITT у інтактних самок мишей C57BL/6J, що годувались чау, і фарбували набором для фарбування DipQuick (Jorgensen Laboratories, Loveland, CO) для визначення фази естрального циклу на основі моделі клітинні типи мазків (6).
Хірургічні процедури.
Таблиця 1. Кількість жирової тканини, вилученої з мишей, що харчуються чау чи HFD, у самців чи самок мишей
Значення є середніми ± SE. HFD, дієта на основі жирного масла; RWATx, ретроперитонеальна ліпектомія білої жирової тканини; E/PWATx, епідидимна/параметриальна ліпектомія білої жирової тканини; IWATx, ліпектомія білої пахової жирової тканини.
Третина підроблених тварин отримувала аналогічну процедуру, як IWATx, RWATx або E/PWATx, відповідно, оскільки відповідне депо WAT було візуалізовано, але не видалено (підроблене). Зокрема, для фіктивних операцій IWAT був зроблений розріз і локалізована пахова паличка, але подальшого розсічення та різання не було. Для підставних операцій RWAT був зроблений розріз і надріз м’яза, щоб можна було візуалізувати RWAT, але жир не маніпулювали. Для підроблених операцій E/PWAT пару тканинних щипців використовували для підняття кінчика подушки E/PWAT, а потім подушку повертали у початкове місце. Оскільки між цими фіктивними контрольними групами не було відмінностей, їх дані об'єднували для аналізів. Після всіх операцій черевну очеревину зашивали стерильними розсмоктуючими вікриловими швами, а шкіру закривали стерильними затискачами для рани.
IPGTT та IPITT.
IPGTT та IPITT проводили під час світлової фази за попередньо встановленими процедурами (40). Мишей голодували протягом ночі протягом 16 год, і всі зразки крові отримували з кінчика хвостової вени мишей, що вільно рухаються. Після взяття зразка крові (0 хв) вводили 1,5 г/кг 20% г-глюкози (Phoenix Pharmaceutical, St. Joseph, MO) або 1 од./Кг маси тіла інсуліну (Novolin; Novo Nordisk). Подальші проби крові відбирали через 15, 30, 45 та 60 хв після введення глюкози або інсуліну, а глюкозу вимірювали на повторюваних зразках за допомогою глюкометрів FreeStyle та тест-смужок (FreeStyle, Alameda, CA). Додатковий зразок крові відбирали з хвостової вени через 13–15 хв після введення глюкози для вимірювання інсуліну в плазмі за допомогою наборів імуноферментних аналізів для інсуліну щурів (Crystal Chem, Downers Grove, IL). Коефіцієнти варіації внутрішньо-аналізу та взаємовипробування становлять 5,5 та 6,1% відповідно. Для оцінки толерантності до глюкози, розрахунки площі під кривими глюкози (AUC) проводились на основі вихідних рівнів глюкози через 0 хв. Для оцінки чутливості до інсуліну розраховували нахил зміни рівня глюкози, що представляє швидкість зникнення глюкози після введення інсуліну між початковим значенням 0 і 45 хв.
Статистичний аналіз.
Дані виражаються як середні значення ± SE. Порівняння між кількома групами проводили за допомогою одностороннього дисперсійного аналізу. Постійні тести окремих груп проводились за допомогою тестів Тукі (SigmaStat 3.1, Сан-Рафаель, Каліфорнія). Значимість була встановлена P 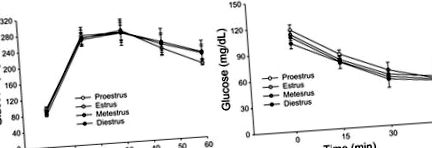
Рис. 1.Внутрішньочеревні тести на толерантність до глюкози та внутрішньочеревні тести на толерантність до інсуліну інтактних самок мишей C57BL/6J, що годуються чау. A: толерантність до глюкози не відрізнялася протягом естрального циклу; проеструс ( n = 5), еструс ( n = 5), метеструс (n = 18), і діеструс (n = 12). B: чутливість до інсуліну не відрізнялася протягом естрального циклу; проеструс (n = 3), еструс (n = 19), метеструс (n = 13), і діеструс (n = 5).
Статистичний аналіз потужності.
Аналіз потужності проводили, використовуючи розмір ефекту 35% для AUC та стандартне відхилення (SD) від нашої фіктивної групи, розмір групи 9 та α 0,05. Зокрема, для чоловічої когорти C57BL/6J, що харчується чау-чау з різницею середніх значень 2500, а SD - 1500, потужність дорівнює 0,812; для жіночої когорти C57BL/6J з чау-кормом з різницею середніх значень 3000 і SD 1500, потужність становить 0,941. Для чоловічої когорти FVBN з чау-кормом з різницею середніх значень 1800 та SD 1200, потужність дорівнює 0,710; для жіночої когорти FVBN з чау-кормом з різницею середніх значень 2000 і SD 1200, потужність дорівнює 0,812. Для чоловічої когорти C57BL/6J, що харчується HFD, з різницею середніх значень як 2000 і SD як 800, потужність становить 0,996; для жіночої когорти, що харчується HFD C57BL/6J з різницею середніх значень 1500 і SD 800, потужність становить 0,904. Таким чином, конструкція поточного дослідження була потужною, щоб знайти розумні розміри ефекту. Хоча можливість упустити деякі ефекти неможливо усунути, ці ефекти порівняно невеликі.
Миші, яких годують чау.
Підроблені самці мишей C57BL/6J та FVBN мали подібні криві кліренсу глюкози до і після хірургічного втручання з порівнянними рівнями глюкози в усі моменти часу під час IPGTT (рис. 2A та 3A). Середній вихідний рівень глюкози у самців мишей C57BL/6J, що годувались чау, був нижчим після підробленої операції (таблиця 2). Самки мишей C57BL/6J, яких годували чау, також мали однакові параметри глюкози у всі моменти часу до та після ін’єкції глюкози між двома тестами (рис. 2B). У самок мишей FVBN підроблені миші мали підвищений рівень глюкози до і через 15 хв після ін'єкції глюкози після дооперації, і рівні під час двох тестів були порівнянними після цього (рис. 3B). AUC та рівні 13–15 хв інсуліну після ін’єкції глюкози були подібними у до- та післяопераційних підставних чоловіків та жінок (таблиці 2 та 3). Таким чином, IPGTT, проведені через 3 тижні, не відрізнялися у підроблених худих мишей C57BL/6J або FVBN. Ні фіктивна хірургічна процедура, ні тритижневий період чау-годування суттєво не впливали на толерантність до глюкози. Таким чином, до- та післяхірургічні ІПГТТ порівнювали в групах для худих мишей.
Рис.2.Внутрішньочеревні тести на толерантність до глюкози у підроблених штучних або епідидимальних/параметриальних білих ліпектомій жирової тканини (E/PWATx) на самцях чи самках мишей C57BL/6J. Ні чоу-корм C57BL/6J чоловік (A; n = 8) ні жінки (B; n = 9) миші змінили толерантність до глюкози після фіктивних операцій. Обидва чоловіки C57BL/6J, що харчуються чау (C.; n = 9) та жінки (D; n = 10) миші мали нижчий рівень глюкози після видалення WAT гонад (EWATx у самців або PWATx у жінок). *P
Рис.3.Внутрішньочеревні тести на толерантність до глюкози у підроблених штучних або E/PWATx мишей чоловічої чи жіночої статі FVBN. Ні чоловіки FVBN, що харчуються чау (A; n = 12) ні жінки (B; n = 8) миші змінили толерантність до глюкози після фіктивних операцій. Обидва чоловіки FVBN, що харчуються чау (C.; n = 9) та жінки (D; n = 10) миші мали нижчий рівень глюкози після видалення WAT гонад (EWATx у самців або PWATx у самок). *P
Таблиця 2. До- та післяхірургічний ІПГТТ мишей C57BL/6J, що годуються чау-самками
Значення є середніми ± SE. IPGTT, внутрішньочеревний тест на толерантність до глюкози; AUC, площа під кривою глюкози.
* Статистично значуща різниця до та після лікування (P † статистично значуща різниця порівняно з фіктивною групою в межах статі (P
Таблиця 3. До- та післяопераційний ІПГТТ мишей FVBN-самців чи самок, яких годували чау
Значення є середніми ± SE.
* Статистично значуща різниця до та після лікування (P
Таблиця 4. До- та післяхірургічний ІПІТТ мишей чоловічої чи жіночої статі C57BL/6J або FVBN, що годуються чау
Значення є середніми ± SE. IPITT, внутрішньочеревний тест на толерантність до інсуліну. Нахили рівнів глюкози представляють швидкість зникнення глюкози після введення інсуліну між початковим рівнем 0 та 45 хв. Ніякої суттєвої різниці до і після будь-яких операцій ні у самців, ні у самок мишей не було помічено.
Миші, що харчуються HFD.
Миші підтримували HFD протягом усього дослідження. Як у самців, так і у самок мишей, які годували HFD, після фіктивних операцій значно збільшилася AUC глюкози (табл. 5), що свідчить про те, що збільшення часу, витраченого на споживання HFD, погіршувало толерантність до глюкози, як повідомляли інші (9, 17, 43). Крім того, у самок мишей рівень глюкози був вищим через 30, 45 та 60 хв під час ІПГТТ після підробленої операції (рис. 4B). Оскільки кумулятивне погіршення толерантності до глюкози маскує будь-яке покращення толерантності до глюкози, спричинене видаленням жиру, ми порівнювали постхірургічну толерантність до глюкози між фіктивними та хірургічними групами, ретельно узгоджуючи мишей різних груп з дозуванням AUC та глюкозою натще (табл. 5).
Рис.4.Внутрішньочеревні тести на толерантність до глюкози підроблених дієт на основі жиру на маслі (HFD) або мишей типу C57BL/6J на самцях чи самках E/PWATx. Обидва чоловіки C57BL/6J, що живляться HFD (A; n = 9) та жінки (B; n = 10) у мишей розвивалася непереносимість глюкози після фіктивних операцій. C.: самці мишей мали подібну толерантність до глюкози після операції EWATx (n = 10) ніж фіктивних самців (n = 9). D: самки мишей мали кращу толерантність до глюкози після операції PWATx (n = 9) ніж фіктивних самок (n = 10). *P
Таблиця 5. До- та післяопераційний ІПГТТ мишей чоловічої та жіночої статі C57BL/6J, що харчуються HFD
Значення є середніми ± SE.
- Траєкторії розвитку агресивних та депресивних симптомів у дітей із надмірною вагою у чоловіків та жінок
- Хірургічне видалення черевного жиру зменшує рак шкіри у мишей
- Хірургічне видалення черевного жиру зменшує рак шкіри у мишей, показує дослідження
- Лікований уретрит через; Гонорея (Чоловік)
- Чому їжа на смак така смачна науково-американська