Вплив розвантаження з наступним перевантаженням на експресію колагену та пов’язаних з ним факторів росту в сухожиллі та м’язах щурів
Анотація
Механізми механічної регуляції експресії колагену, здається, пов'язані з певними факторами росту, що реагують на стрес, включаючи трансформуючий фактор росту-β1 (TGF-β1) та фактор росту сполучної тканини (CTGF), які виражаються у відповідь на механічні подразники і в свою чергу призводять до до індукції експресії колагену у багатьох типах клітин (16, 25, 32, 44, 50). Також відомо, що інсуліноподібний фактор росту-I (IGF-I) індукує синтез колагену в клітинах сухожиль (1, 37), і останні дані підтверджують роль IGF-I та TGF-β1 як медіаторів індукованої навантаженням експресії мРНК колагену в сухожиллі щурів in vivo (23). Виходячи з цього, можна припустити, що зменшення механічного навантаження може вплинути на експресію цих факторів росту в тканині сухожилля.
У скелетних м’язах численні дослідження підтверджують значний шкідливий вплив розвантаження як на біомеханічний, так і на біохімічний рівні (51). Щодо змін у експресії генів, ці дослідження зосереджувались в основному на експресії факторів, пов’язаних із скорочувальними та метаболічними функціями, але є вказівки на те, що на експресію генів, пов’язаних з матрицею, також впливає знижений рівень механічного навантаження (3, 20, 24, 47). Проте скоординована регуляція експресії генів ECM м’язів та експресії генів тканин сухожиль була вивчена лише у відповідь на тривалу денервацію (6). Таким чином, рання реакція на невикористання не вивчалася в цих тканинах одночасно. Крім того, вплив наступного періоду перезавантаження на експресію факторів росту та генів, пов’язаних з матрицею, ніколи не вивчався у сухожиллі, а також щодо цього м’язові дані обмежені.
У цьому дослідженні ми використовували модель підвіски задньої кінцівки для дослідження ефекту втрати активного навантаження м’язової та сухожильної тканин без супутньої втрати серцево-судинного стресу. Клінічною паралеллю до цього може бути ситуація з травмою, не пов'язана з м'язовою та сухожилковою тканинами, така як розтягнення щиколотки, при якій уникається тяга тяжкості пошкодженої ноги. Підвіска задньої кінцівки супроводжувалась періодом нормальної ваги, що відповідає періоду реабілітації.
На основі попередніх досліджень, які вказують на негативний вплив розвантаження на експресію колагену I і III типу в скелетних м'язах (3, 20, 24, 47), ми припустили, що розвантаження задніх кінцівок призведе до зменшення експресії фібрилярних колагенів у м’язи, а можливо і в сухожиллі, з подальшим збільшенням вираження під час перезавантаження.
У тій же моделі ми вивчали вплив на експресію факторів росту, пов'язаних з регуляцією експресії колагену, включаючи TGF-β1, варіанти сплайсингу IGF-I [IGF-IEa та фактор механоросту (MGF)] та CTGF. Беручи до уваги позитивну кореляцію між механічним навантаженням, експресією фактора росту та експресією колагену, можна припустити, що розвантаження призведе до зменшення цих факторів росту, що реагують на стрес, а також до зниження експресії колагену як у сухожиллі, так і в м’язах. Однак дослідження на кістковій та скелетній м'язовій тканині вказують на те, що може не існувати негативної кореляції між розвантаженням тканин та місцевою експресією анаболічних факторів (2, 7, 18, 19, 24, 41). Таким чином, на основі попередніх висновків, ми не очікували зменшення експресії факторів росту в м'язах у відповідь на підвішування задніх кінцівок, тоді як реакцію сухожилля було важко передбачити. Як і при експресії колагенів, ми очікували, що період перезавантаження призведе до підвищення рівня експресії фактора росту.
Нарешті, ми дослідили експресію міостатину, важливого негативного регулятора росту м’язів. Попередні дослідження показали посилення регуляції цього фактора в м’язах у відповідь на суспензію задніх кінцівок (17), тоді як навантаження на опір знижує експресію міостатину (29). Таким чином, ми очікували початкового збільшення експресії міостатину в м'язах під час підвішування задніх кінцівок з подальшим зниженням регуляції під час перезавантаження. У сухожиллі ми раніше спостерігали відносно низький рівень транскрипту міостатину та відсутність реакції на збільшення навантаження. Однак ефект розвантаження раніше не вивчався в цій тканині, і не можна виключати, що це може впливати на експресію міостатину.
Підвіска задньої кінцівки та підготовка тканин.
Суспензію задньої кінцівки (HS) індукували у самок щурів Sprague-Dawley вагою 265 ± 2,5 г (означає ± SE) за допомогою неінвазивної методики відливання хвоста, як описано раніше (46). Коротко кажучи, поворотна система джгутів у поєднанні з литим хвостом була прикріплена до гачка у верхній частині клітки. Це заважало щурам торкатися землі задніми кінцівками, але дозволяло тваринам рухатися по клітці, використовуючи передні кінцівки. Суспензія продовжувалась протягом 14 днів, після чого виливки були вилучені і послідувало 16 днів перезавантаження (RL). Щури тут у 12: 12-годинному циклі світло-темряви і мали вільний доступ до стандартних чау-чау та води. Дослідження було проведено згідно з "Керівними принципами догляду та використання тварин" Американського фізіологічного товариства ", а протокол затверджено Університетським комітетом з догляду та використання тварин в Ірвіні в Каліфорнії.
Підошвенний м'яз, включаючи ахіллове сухожилля, був видалений двосторонньо після періоду призупинення протягом 7 днів (день 7 HS) або 14 днів (день 14 HS), або через 2 (день 2 RL), 4 (день 4 RL), 8 (день 8 RL), або 16 (день 16 RL) днів перезавантаження (n = 8 у кожній групі). Елементи контролю за віком для день 0 (день 0 кон), день 14 HS (день 14 con), та день 16 перезавантажити (день 16 RL con) були включені (n = 8 для кожної групи). Тканину швидко заморожували і зберігали при -80 ° C до подальшого використання.
Вилучення РНК.
РНК екстрагували з тканини, що походить із середнього живота м’яза підошви та з ахіллового сухожилля, за допомогою TRI-реагенту (MRC), згідно з методом, описаним Хомчинським та Саккі (10). Після виділення водної фази РНК осаджували із застосуванням ізопропанолу. Потім гранулу РНК промивали етанолом і згодом розчиняли у воді без РНКази. Всі зразки зважували перед екстракцією РНК. Концентрації РНК визначали за допомогою спектроскопії при 260 нм. Хороша якість РНК забезпечувалась гель-електрофорезом.
RT ПЛР у режимі реального часу.
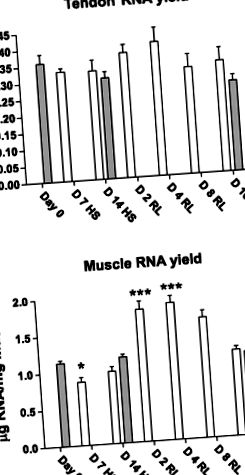
Рис. 1.Вихід РНК (мкг/мг) з ахіллового сухожилля (A) та підошва (B) після підвішування задніх кінцівок (HS) та перезавантаження (RL) (відкриті бруски) порівняно з контрольними щурами (сірі смуги). Самки щурів Спрег-Доулі піддавали HS протягом 7 або 14 днів (D 7 HS або D 14 HS), а потім 2, 4, 8 або 16 днів RL (D 2 RL, D 4 RL, D 8 RL, або D 16 RL). День 0, День 0 контроль. Значення є середніми ± SE. *P
Таблиця 1. ПЛР-праймери
COL1A1 та COL3A1, колаген I та колаген III відповідно; TGF-β1, трансформуючий фактор росту -β1; CTGF, фактор росту сполучної тканини; IGF-IEa, інсуліноподібний фактор росту I-Ea; MGF, фактор механоросту; RPLP0, великий рибосомний білок P0.
Кількість зразків у кожній групі.
У кожну групу було включено вісім щурів. Для сухожиль задовільний аналіз мРНК був досягнутий для всіх щурів, за винятком день 14 Група ГС і день 16 RL con group, в якій успішно аналізували сухожилля семи щурів. Аналогічно для м'язів, дані для день 14 Група ГС і день 16 RL con групують на основі шести та семи щурів відповідно, тоді як усі інші групи включають дані восьми щурів.
Статистика.
Усі дані мРНК були перетворені в журнал перед статистичним аналізом і представлені у вигляді геометричних середніх значень ± перетворена СЕ. Інші дані представлені як середні арифметичні ± SE. Ефекти лікування аналізували за допомогою одностороннього аналізу ANOVA, і коли проводили значущий пост-хост тест Бонферроні на наступних відповідних порівняннях: 1) порівняння між контрольними групами (день 0 кон, день 14 con, та день 16 RL con); 2) порівняння між кожною групою втручання (HS та RL) та найбільш відповідною контрольною групою (день 7 ГС проти. день 0 шахрайство; день 14 HS, день 2 RL, день 4 RL та день 8 RL проти. день 14 шахрайство; день 16 RL проти. день 16 RL con); і 3) порівняння суміжних часових точок (наприклад,., день 14 ГС порівняно з день 7 ГС і с день 2 RL). Непараметричний тест Крускала-Уолліса застосовували для даних мРНК сухожильного міостатину, оскільки ці дані зазвичай не розподілялись. Всі статистичні тести проводили за допомогою програмного пакету Prism 4.01 (GraphPad, Сан-Дієго, Каліфорнія, США). Відмінності вважалися суттєвими, коли P
Таблиця 2. Волога маса підошви, ахіллового сухожилля і всього тіла
Значення - середні значення ± SE; n = 8 для всіх груп, крім день 14 підвіска задньої кінцівки (HS), де n = 7. RL, перезавантажити; кон, контроль.
* Значно відрізняється від день 0.
† Значно відрізняється від день 14 кон.
‡ Значно відрізняється від день 16 RL кон.
§ Значно відрізняється від попереднього моменту часу. Рівень значущості, P 0,05) (рис. 1A). Однак у м'язах вихід РНК знизився через 7 днів HS [з 1,13 ± 0,03 мкг/мг при день 0 до 0,86 ± 0,07 мкг/мг при день 7 HS (P 0,05) (рис. 1B).
Референтні гени.
Як згадувалося в розділі методів, мРНК RPLP0 повинна була служити фактором нормалізації для генів, що нас цікавлять, а мРНК GAPDH була включена в аналіз для підтвердження стабільної експресії мРНК RPLP0. Однак співвідношення RPLP0/GADPH не було стабільним (дані не наведені), і при нормалізації маси тканини спостерігалися суттєві зміни для обох генів як у сухожиллі, так і в м'язах у відповідь на призупинення та перезавантаження (P
Рис.2.Великий рибосомний білок P0 (RPLP0; A, B) та GAPDH (C, D) мРНК, нормалізована до маси тканини, представлена як складчасті зміни відносно день 0 контролю, в ахілловому сухожиллі (A, C) та підошва (B, D). Сірі смуги, контрольні групи; відкриті бари, групи HS і RL. Значення є геометричними середніми ± SE. Істотна відмінність від найбільш відповідної контрольної групи: *P
Експресія колагену.
У тканинах сухожиль не було помічено змін у відповідь на суспензію для мРНК колагену I або III (P > 0,05) (рис.3, A і C.). Однак через 4 дні перезавантаження спостерігалося значне збільшення (у 2–3 рази) для обох типів колагену (P 0,05) (рис.3, A і C.).
Рис.3.Колаген I (COL1A1; A, B) та колаген III (COL3A1; C, D) мРНК, нормалізована до маси тканини, представлена як складчасті зміни відносно день 0 контролю, в ахілловому сухожиллі (A, C) та підошва (B, D). Сірі смуги, контрольні групи; відкриті бари, групи HS і RL. Значення є геометричними середніми ± SE. Істотна відмінність від найбільш відповідної контрольної групи: *P
МРНК м’язового колагену I типу не змінювалася у відповідь на ГС, тоді як перезавантаження призводило до помітно підвищеного рівня експресії при день 2 RL, день 4 RL та день 8 RL (до 13 разів порівняно з день 14 кон, P 0,05) (рис.3B). Для колагену типу III у м’язах спостережувані зміни були дуже схожими на зміни колагену типу I, і хоча експресія колагену III, як видається, зменшувалася через 7 днів ГС, це не було суттєвим (P > 0,05) (рис.3D).
Експресія IGF-IEa та MGF.
Високо значне збільшення у 2 рази спостерігалось як у IGF-IEa, так і у мРНК MGF при день 7 ГС у тканинах сухожиль порівняно з день 0 (P 0,05). У м'язах на експресію мРНК IGF-IEa не впливав HS (P > 0,05), тоді як MGF помірно збільшувався через 14 днів призупинення (P 0,05) (рис.4, B і D). Посилення регуляції у відповідь на перезавантаження було особливо помітним для MGF (~ 9-кратний) (рис. 4D).
Рис.4.Інсуліноподібний фактор росту I-Ea (IGF-IEa; A, B) та фактор механоросту (MGF; C, D) мРНК, нормалізована до маси тканини, представлена як складчасті зміни відносно день 0 контролю, в ахілловому сухожиллі (A, C) та підошва (B, D). Сірі смуги, контрольні групи; відкриті бари, групи HS і RL. Значення є геометричними середніми ± SE. Істотна відмінність від найбільш відповідної контрольної групи: *P
Експресія TGF-β1.
Експресія TGF-β1 не змінювалася в тканині сухожилля (P > 0,05) (рис.5A), тоді як суттєве збільшення в два-три рази спостерігалося в м’язах день 2 RL [щодо день 14 con і to день 14 HS (P
Рис.5.Трансформуюча мРНК фактора росту-β1 (TGF-β1), нормалізована до маси тканини, представлена як складчасті зміни щодо день 0 контролю, в ахілловому сухожиллі (A) та підошва (B). Сірі смуги, контрольні групи; відкриті бари, групи HS і RL. Значення є геометричними середніми ± SE. * Істотна відмінність від найбільш відповідної контрольної групи: ***P
Експресія CTGF.
Специфічних змін у експресії CTGF у сухожиллі не спостерігалося, хоча спостерігався загальний ефект лікування (одностороння ANOVA, P
Рис.6.ІРНК фактора росту сполучної тканини (CTGF), нормалізована до маси тканини, представлена у вигляді складчастої зміни щодо день 0 контролю, в ахілловому сухожиллі (A) та підошва (B). Сірі смуги, контрольні групи; відкриті бари, групи HS і RL. Значення є геометричними середніми ± SE. Істотна відмінність від найбільш відповідної контрольної групи: **P
Експресія міостатину.
Істотних змін у експресії мРНК міостатину в м’язах або сухожиллях не виявлено (P > 0,05) (рис. 7), і, як було встановлено раніше, рівень транскрипту мРНК міостатину був дуже низьким (дані не наведені) і дуже мінливим у тканині сухожилля (23).
Рис.7.МРНК міостатину, нормалізована до маси тканини, представлена у вигляді складчастої зміни щодо день 0 контролю, в ахілловому сухожиллі (A) та підошва (B). Сірі смуги, контрольні групи; відкриті бари, групи HS і RL. Значення є геометричними середніми ± SE. Істотних змін не спостерігалося.
У цьому дослідженні вперше досліджено одночасну реакцію сухожильної та скелетної м’язової тканини на розвантаження з наступним перезавантаженням. Наші результати показують чітку різницю у відповіді сухожиль у порівнянні з м’язами та вказують на дивно помірну реакцію тканини сухожилля на розвантаження щодо експресії генів, пов’язаних з матрицею. Крім того, наші висновки підтверджують попередні результати скелетних м'язів і кісток, які показують, що розвантаження тканин не призводить до зниження експресії анаболічних факторів, що, як відомо, викликаються механічним навантаженням.
М’язова і сухожильна маса.
Експресія колагену.
Наскільки нам відомо, єдине дослідження, опубліковане щодо експресії мРНК сухожильного сухожилля у відповідь на невживання, вказує на можливе, хоча і незначне, зниження рівня мРНК колагену I та III у передньої сухожилки великогомілкової кістки щура 5 тижнів після денервації м'язів задніх кінцівок (n = 4) (6). Ми не побачили жодного значного впливу 14-денної суспензії задніх кінцівок на експресію колагену сухожиль, але наші дані не можна порівняти з роботами Arruda et al. (6) через різницю в часовому інтервалі використання сухожилля. Крім того, є вказівки на те, що ефект денервації на експресію колагену, принаймні в м'язовій тканині, суттєво відрізняється від ефекту чистого використання (42). Кілька досліджень на тваринах та одне недавнє дослідження на людях виявили збільшення як синтезу, так і розщеплення білка колагену у відповідь на розвантаження сухожиль (5, 11, 21). Ці висновки підтверджують, що розвантаження сухожиль не зменшує транскрипцію гена колагену і що зміни, виявлені в механічних властивостях сухожиль (4, 34), можуть бути пов'язані зі збільшенням обороту колагену, можливо, пов'язаним із зменшенням розміру колагенових волокон (36, 38).
У скелетних м'язах суттєве зниження експресії колагену III було продемонстровано через 48 годин без використання м'язів у людини (47), а у щурів як підвіска задніх кінцівок, так і іммобілізація призвели до зниження експресії колагену I та/або колагену III (20, 24 ). Однак у цих дослідженнях на щурах зменшення спостерігалося лише через 3 дні розвантаження, а через 7 днів розвантаження рівні мРНК колагену були нормальними. Таким чином, зниження експресії колагену могло бути присутнім у момент часу, що передував нашому першому вимірюванню через 7 днів суспензії. Крім того, слід зазначити, що рівень експресії колагену III мав тенденцію до зниження при день 7 HS у цьому дослідженні, і при порівнянні лише цього моменту часу з день 0 контрольна група за допомогою простого т-тесту, помітна значна різниця в рівні мРНК колагену III (P = 0,01). Іншими словами, слабкою стороною даного проекту дослідження є те, що безліч часових моментів призводять до великої кількості порівнянь post hoc і, отже, до високої жорсткості. Це може спричинити помилки типу 2, а фактичні відмінності можна не помітити.
Експресія IGF-I та MGF.
Інтуїтивно можна очікувати зменшення експресії анаболічних факторів росту, таких як IGF-I та MGF, у відповідь на порушення роботи скелетних м'язів. Однак у цьому дослідженні не виявлено змін у експресії мРНК IGF-IEa в м'язах, а щодо MGF спостерігалося помірне збільшення через 14 днів ГС. Ці результати підтверджують попередні докази того, що розвантаження м'язів як у тварин, так і у людей не обов'язково змінює експресію ізоформ IGF-I або навіть призводить до збільшення експресії IGF-I (2, 12, 18, 19). Це вказує на те, що реакція на розвантаження м'язової тканини не просто протилежна реакції навантаження і що виражена втрата м'язової маси, ймовірно, спричинена механізмами, відмінними від зміненого рівня експресії анаболічних факторів (13, 51).
- Вплив 30-денного розвантаження задньої кінцівки та гіпергравітації на стромальних родоначальників кісткового мозку в C57Bl6N
- П'ять змінних факторів ризику розвитку каменів у нирках - Medivizor
- Чи є в курячих шийках колаген
- Оцінка впливу позначення меню калорій на калорії, придбані у великому ресторані
- Крива зростання ваги добермана та середні ваги; Планета Добермана