Високоспецифічна роль нейронів гіпокретину (орексину): диференціальна активація як функція добової фази, посилення операнта проти уникнення операнта та рівень освітленості
Рональд Макгрегор
1 Адміністрація ветеранів, Велика система охорони здоров'я Лос-Анджелеса, дослідження нейробіології (151A3), Норт-Гіллс, Каліфорнія, 91343, та
2 Відділ психіатрії та біологічних поведінкових наук і
3 Інститут досліджень мозку Каліфорнійського університету в Лос-Анджелесі, Лос-Анджелес, Каліфорнія 90095
Мін-Фун Ву
1 Адміністрація ветеранів, Велика система охорони здоров'я Лос-Анджелеса, дослідження нейробіології (151A3), Норт-Гіллс, Каліфорнія, 91343, та
2 Відділ психіатрії та біологічних поведінкових наук і
3 Інститут досліджень мозку Каліфорнійського університету в Лос-Анджелесі, Лос-Анджелес, Каліфорнія 90095
Грейс Барбер
1 Адміністрація ветеранів, Велика система охорони здоров'я Лос-Анджелеса, дослідження нейробіології (151A3), Норт-Гіллс, Каліфорнія, 91343, та
2 Відділ психіатрії та біологічних поведінкових наук
3 Інститут досліджень мозку Каліфорнійського університету в Лос-Анджелесі, Лос-Анджелес, Каліфорнія 90095
Лаліні Раманатан
1 Адміністрація ветеранів, Велика система охорони здоров'я Лос-Анджелеса, дослідження нейробіології (151A3), Норт-Гіллс, Каліфорнія, 91343, та
2 Відділ психіатрії та біологічних поведінкових наук
3 Інститут досліджень мозку Каліфорнійського університету в Лос-Анджелесі, Лос-Анджелес, Каліфорнія 90095
Джером М. Зігель
1 Адміністрація ветеранів, Велика система охорони здоров'я Лос-Анджелеса, дослідження нейробіології (151A3), Норт-Гіллс, Каліфорнія, 91343, та
2 Відділ психіатрії та біологічних поведінкових наук і
3 Інститут дослідження мозку Каліфорнійського університету в Лос-Анджелесі, Лос-Анджелес, Каліфорнія 90095
Вклади авторів: R.M., M.-F.W. та J.M.S. розроблені дослідження; R.M., M.-F.W., G.B. та L.R. виконані дослідження; R.M., M.-F.W., G.B., L.R. та J.M.S. проаналізовані дані; R.M., M.-F.W., G.B., L.R. та J.M.S. написав роботу.
Анотація
Вступ
Порушення функціонування системи гіпокретину (Hcrt; орексин) у людей, мишей, щурів та собак спричиняє нарколепсію (Chemelli et al., 1999; Lin et al., 1999; Peyron et al., 2000; Thannickal et al., 2000; Сінтон, 2011). У звичайних тварин введення Hcrt у різні ділянки мозку (Nakamura et al., 2000; España et al., 2001; Korotkova et al., 2003; Mieda et al., 2004; Deadwyler et al., 2007) є збудження та ураження клітин Hcrt (Геращенко та ін., 2001) викликає сонливість. Нейрони Hcrt досягають максимальної активності під час неспання і мінімально активні під час сну (Lee et al., 2005; Mileykovskiy et al., 2005). Показано, що засіб, який блокує обидва рецептори Hcrt, ефективний як снодійне (Brisbare-Roch et al., 2007). Значна кількість робіт свідчить про те, що вивільнення Hcrt пов’язане з прийомом їжі (Sakurai et al., 1998), але деякі останні роботи викликали сумнів у специфіці цього відношення (Wu et al., 2002; Siegel, 2004; Funato та ін., 2009).
Загалом, попередні дослідження поведінкової ролі Hcrt у гризунів вивчали функцію Hcrt лише під час світлової (нормальний сон) або темної (нормальне неспання) фази, а не обох, і часто під час лише одного завдання. У поточному дослідженні ми вивчали як поведінкові можливості мишей, що нокаутують Hcrt (KO), так і активність нейронів Hcrt, на що вказує експресія Fos у їх нормальних односеменних підстилках. Ми порівняли ці змінні під час світлової та темної фаз (тобто 12-годинних періодів, коли освітлення вмикалося або вимикалось). Ми тестували цих тварин на завданнях, мотивованих підсиленням їжі чи води, на завданнях, мотивованих уникненням шоку, а також у відповідь на винагороду чи покарання, що не залежить від поведінки.
Дивно, але ми виявляємо, що мишам Hcrt KO недостатньо працювало лише для отримання позитивної винагороди у легкій фазі. Вони вчаться з такою ж швидкістю, як і їх однокласники, і їм було абсолютно незручно працювати за ту саму винагороду в темну фазу.
Відповідно до даних в КО, активність цих клітин у їх односеменних підводних тваринах, як вказує вираз Фоса, була максимальною при роботі на позитивну винагороду під час світлової фази, але ці клітини не активувалися при виконанні одного і того ж завдання в темряві фаза. Крім того, активація клітин Hcrt залежала від світла, так що ці клітини не активувалися тим самим завданням у циркадній світловій фазі, до якої вони були пристосовані, за відсутності освітлення. Клітини Hcrt не активувались лише винагородою. Під час світлової фази, коли тварини отримують очікувані або несподівані винагороди, не залежно від поведінки натискання на штангу (оперант), але розподіляються за тією ж схемою та кількістю, що і на сеансах пресової штампу, у клітинах Hcrt не спостерігалося активації Fos. Клітини Hcrt не активувались під час уникнення шоку ні в світлій, ні в темній фазі, незважаючи на максимальний рівень збудження ЕЕГ. Ми припускаємо, що активність нейронів Hcrt пов'язана зі збудженням, необхідним для роботи за винагороду у світлій фазі.
Матеріали і методи
Предмети
Апарат
Кількісна оцінка споживання їжі
Що стосується стану пресової їжі, тварин підтримували на рівні 85–90% від їх початкової маси тіла, обмежуючи споживання їжі. Їжа (LabDiet, PMI Nutrition) була розподілена відповідно до добової ваги кожної тварини. Як тільки вага тварини стала стабільною, споживання їжі обмежували та вимірювали протягом 120 хв між 11:00 AM. та 13:00 кожен день протягом 2 тижнів у домашній клітці. Вода була доступна за бажанням.
Кількісна оцінка споживання води
Що стосується стану преса з водою, для тварин обмежували воду, дозволяючи доступ двічі на день протягом 90 хв. Питні сеанси були розділені на два періоди: 60 хв (з 11:00 до 12:00), а потім 30 хв (з 15:00 до 15:30). Після того, як тварини адаптувались до режиму пиття, споживання води вимірювали протягом 60 хв між 11:00. та 12:00 вечора використовуючи градуйований циліндр щодня протягом 2 тижнів у домашній клітці. Їжа була доступна за бажанням.
Контроль палати
Мишам обмежували їжу, щоб вони підтримували 85–90% від своєї початкової маси тіла, дотримуючись тієї самої процедури, що і для харчового операційного завдання. Як тільки вага тварин стабілізувався, мишей поміщали в оперантні кондиціонуючі камери щодня на 120 хв, починаючи через 2 год після настання світлової фази (між 9:00 та 13:00) або через 2 години в темну фазу (між 21:00 та 01:00). Під час світлових сеансів горіли як світло будинку, так і світло репліки. Усі експериментальні сеанси тривали 120 хв і тривали 5 тижнів. Під час сеансів не давали їжі, води та ударів.
Хірургічні процедури: імплантація електродів ЕЕГ та ЕМГ
Вісім тваринам, 5 KO і 3 WT, імплантували коркові ЕЕГ та електроміограми м'язів шиї (EMG) в асептичних умовах. Наркоз індукували сумішшю кетамін/ксилазин (100 мг/кг/15 мг/кг, внутрішньовенно), а потім підтримували газовою сумішшю ізофлурану в кисні (0,6–1,2%) після того, як тварин поміщали в стереотаксичний пристрій. Температуру тіла підтримували за допомогою нагрівальної подушки з циркуляцією води (Gaymar Industries). Голова була розміщена в стереотаксичній рамі, а череп був оголений. Чотири гвинтових електрода з нержавіючої сталі, два в лобових кістках [передньозадній (AP): +1 мм; латеральна: ± 1,5 мм щодо брегми) та дві в тім’яній кістці (AP: +1 мм; латеральна: ± 1,5 мм щодо лямбда) були імплантовані для реєстрації ЕЕГ. Два інші багатожильні електроди з нержавіючої сталі були поміщені в м'язи шиї для запису активності ЕМГ. Всі шість електродних відведень були вставлені в пластикову головку (SL6C/SB, Plastics One), яка потім була закріплена на черепі стоматологічним цементом. Постхірургічний період відновлення становив 2 тижні, перш ніж проводити будь-яке навчання.
Записи ЕЕГ та ЕМГ
Записували мишей як під час виступу в оперантній камері, так і під час спонтанного циклу сну/неспання в домашніх клітках. Коркова ЕЕГ відфільтровували від 0,3 до 100 Гц і відбирали проби зі швидкістю 128 Гц. ЕМГ фільтрували між 30 Гц і 3 кГц і відбирали проби на частоті 1 кГц. Сигнали ЕЕГ та ЕМГ були оцифровані за допомогою інтерфейсу CED1401 Plus (Cambridge Electronic Design) та записані на комп’ютері за допомогою програмного забезпечення Spike2 (Cambridge Electronic Design).
Тренінг поведінки
Завдання операнта
Позитивне підкріплення, харчова винагорода.
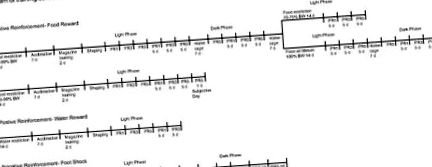
Графіки тренувань для всіх поведінкових та гістологічних експериментів зображені на схемах рис. 1 (оперантні завдання) та рис. 2 (неоперативні завдання). Мишам обмежували їжу, щоб вони підтримували 85–90% від початкової маси тіла (кількість їжі: приблизно 3–3,5 г/день проти регулярної порції 4–4,5 г/добу), і їх щодня піддавали 20 мг харчових гранул (Dustless Precision) Пелети F0071, BioServe). Всі тренувальні заняття та більшість експериментів проводились у межах цього діапазону ваги. У вибраних експериментах, описаних вище, тварин утримували на рівні 70–75% або 100% від їх початкової ваги.
Схема графіків тренінгів для оперантних умов для тварин із ЗТ та КО. Умови операції: 1а, графік тренувань для зміцнення їжі для світлої та темної фаз при 85–90% маси тіла, різні рівні маси тіла (70–75% та 100%) у світлій фазі, 100% маси тіла у темряві фаза; 1б, суб’єктивний день; 2, графік тренувань з підкріплення водою; 3, графік тренувань щодо уникнення шоку. FR, фіксований коефіцієнт; PR, прогресивний коефіцієнт.
Схема графіків дресирування для непеперантних умов для тварин, що страждають на ВТ та КО. Неопераційні умови: 1, очікувана та несподівана винагорода; 2, неминучий поштовх; 3, управління камерою; VI-4, змінний інтервал-4 хв (доставка їжі без непередбачених ситуацій при натисканні важеля); FI-5 фіксований інтервал-5 хв.
Для тварин, які завершили сеанс 120 хв, для аналізу використовували остаточне співвідношення пресів для пелети, досягнуте в кінці сеансу. Для тварин, які не пройшли 120-хвилинний сеанс PR5 (дострокове припинення), точка розриву (BP) була оперативно визначена як останнє завершене співвідношення (що призводить до доставки кормової винагороди) до закінчення сеансу. АТ або остаточне відношення останніх трьох досліджень PR5 були усереднені та використані для статистичного порівняння. Харчові добавки отримували після кожного сеансу, щоб утримувати всіх тварин з відповідною масою тіла (70–75%, 85–90% або 100% від їх початкової ваги).
Сеанси оперантів за винагороду за їжу проводились як у світлу, так і в темну фази. На сеансах світлової фази тварин запускали, починаючи через 2 год після настання світлової фази (між 9:00 та 13:00). Для сеансів темної фази тварин запускали через 2 год після настання темної фази (з 9:00 до 13:00).
Позитивне підкріплення, водна винагорода.
Негативне підкріплення, уникнення ударів.
Мишам давали 1 тиждень (120 хв на день) для адаптації до оперантних кондиціонуючих камер. Потім ми визначили поріг удару для кожної миші, змінюючи рівні удару від 0,06 до 0,4 мА (з кроком 0,05 мА), використовуючи модифікований метод титрування Turner et al. (1967). Спочатку ми виконали висхідний ряд інтенсивності удару, потім низхідний ряд і, нарешті, випадкову послідовність для кожної миші. Кожен поштовх тривав протягом 1 с з інтерстимулювальним інтервалом 15 с і 30 с паузою між серіями. Сліпий за величиною стимулу спостерігач кількісно оцінив реакцію за шкалою від 0 до 4 (0 = відсутність відповіді, 1 = здригання, 2 = стрибок/рух вперед або назад, 3 = біг та 4 = стрибок). Інтенсивність вибирали для кожної тварини, яка давала відповідь шкали 2.
Сеанси операнту для уникнення ударів проводили як у світлу, так і в темну фази. На сеансах світлової фази тварин запускали, починаючи через 2 год після настання світлової фази (між 9:00 та 13:00). На сеансах темної фази тварин запускали, починаючи через 2 год після настання темної фази (між 9:00 та 13:00).
Неоперантні завдання
Очікувана і несподівана нагорода за їжу.
Мишам давали тиждень аклімації (120 хв на день) до камер реєстрації при включеному домашньому освітленні під час світлової фази з подальшим щоденним впливом 20 мг харчових гранул. Тоді було розпочато нормування їжі, щоб підтримувати 85–90% від початкової маси тіла. Як тільки вага тварин стабілізувався протягом 14 днів, розпочались експериментальні сеанси, і тварин розділили на дві групи. В очікуваному винагороді групу тварин щодня поміщали в кондиціонуючу камеру, а харчові гранули доставляли через VI-4 хв. Сеанси проводились щодня протягом 4 тижнів. У групі несподіваних винагород тварин щодня поміщали в кондиціонуючу камеру, але гранули доставляли через VI-4 хв лише в день, коли тварин вбивали. Для цієї групи гранули доставляли на піддон для їжі на підлозі клітки, а не у звичайне продовольче корито, щоб тварини могли бачити гранули, коли їх доставляли. В обох випадках для отримання гранул не вимагалося або виконувалось пресування штангою. Усі експериментальні сеанси тривали 120 хв.
Неминучий поштовх.
Мишам давали 1 тиждень (120 хв/добу) для адаптації до оперантних камер. Потім ми визначили поріг удару для кожної миші, використовуючи ту саму процедуру, яка описана в групі уникнення шоку. Інтенсивність (діапазон 0,25–0,4 мА) вибирали для кожної тварини, яка давала відповідь шкали 2. Потім тварин поміщали в камеру щодня (120 хв) протягом 4 тижнів. Тільки в день вбивства тварин, неминучий поштовх (1 с) був доставлений з фіксованим інтервалом 5 хв (FI-5 хв) протягом 120 хв сеансу.
Імуногістохімічні процедури
Подвійну імуногістохімію для виявлення білка Fos та Hcrt проводили тваринам після 120 хв оперантних завдань, неоперантних завдань або перебування в камері. Було використано одинадцять різних експериментальних груп; 8 під час світлової фази та 3 під час темної фази. Для завдання харчового посилення був використаний графік PR3.
Для легкої фази використовувались такі умови: (1) їжа для PR (див. Рис. 6 aL1); (2) уникнення удару (див. Рис. 6 aL2); (3) управління камерою (див. Рис. 6 aL3); (4) очікувана їжа; (5) несподівана їжа; (6) шокове вимирання (тварини, навчені уникати нагального удару, поки вони не досягнуть графіка PR3–10, але з шоком, що не відбувся в день вбивства); (7) неминучий шок; та (8) суб'єктивний день (їжа PR у світлій фазі без домашнього освітлення в день вбивства).
Для темної фази використовувались такі умови: (1) їжа для PR (див. Рис. 6 aD1); (2) уникнення удару (рис. 6 aD2); та (3) управління камерою (рис. 6 aD3).
Відразу після закінчення сеансів тваринам глибоко знеболювали Нембуталом (100 мг/кг, в/в) і перкардировали перфузію 0,03 л гепаринізованого (1000 од/л) PBS (0,1 м, рН 7,4), а потім 0,07 л 4% параформальдегіду. у фосфатному буфері (PB; 0,1 м, рН 7,4). Мозок видаляли і занурювали на 15 хв у 4% параформальдегід у PB. Після постфіксації тканину переносили у 20%, а потім у 30% розчин сахарози для кріозахисту. Через сорок вісім годин мозок був заморожений і розрізаний на ділянки розміром 35 мкм за допомогою кріостата (модель 1800 Cryocut, Reichert Jung). Кожну секцію поміщали в одну лунку 6-лункового лотка, що містив PBS. Імуногістохімічні процедури проводили негайно.
Виявлення Fos проводили шляхом послідовної інкубації вільно плаваючих секцій. Зрізи спочатку інкубували у кролячій анти-Фос-сироватці (PC-38, Calbiochem), 1: 10000 у PBS, 0,3% Triton X-100 (PBST). Потім їх піддавали дії біотинільованих козячих анти-кролячих IgG (Jackson Immunoresearch) 1: 600 в PBST, з подальшою інкубацією в стандартній ABC (Vector Laboratories), 1: 400. Тканину обробляли методом посиленого нікелем діамінобензидину тетрагідрохлориду (DAB), який полягав у зануренні тканин у 0,6% сульфату амонію нікелю, 0,02% DAB та 0,03% перекису водню у 10 мл PBS протягом 4–5 хв. Після маркування Fos тканину промивали у PBST та інкубували у кролячих анти-Hcrt B (H-003–32, Phoenix Pharmaceutical), 1: 10000 та PBST. Згодом тканину занурювали в біотинільований козячий анти-кролячий IgG 1: 600 у PBST з наступною інкубацією у стандартному ABC 1: 400. Потім тканину обробляли методом DAB протягом 4-5 хв.
Кількість та розподіл клітин Hcrt + та Fos +/Hcrt + визначали у кожному третьому зрізі по всьому гіпоталамусу. Було використано мікроскоп Nikon Eclipse 80i з тривісним моторизованим каскадом, відеокамерою, інтерфейсом Neurolucida та програмним забезпеченням Stereoinvestigator (MicroBrightField). Підрахунок клітин проводився за допомогою об'єктива 60 × підготовленим гістологом, який завжди був сліпим до лікування. Критерії, використані в цій роботі для визначення анатомічної парцеляції гіпоталамуса, базувались на атласі Франкліна і Паксіноса (1997) мозку миші. Перифорнічна зона (ПФА) визначалася як область, що оточує форнікс (140 мкм від периметра структури). Інша частина гіпоталамуса була додатково розділена на медіальний підрозділ [медіальний гіпоталамус (МГ)], який охоплював область від медіальної межі видатка до третього шлуночка (3 В), і бічний підрозділ [бічний гіпоталамус (ЛГ) ], яка простягалася від медіальної межі видатка до бічного краю гіпоталамуса (див. рис. 6, б).
Аналіз даних
Дані піддавали або ANOVA, після чого проводили порівняння тестів Ньюмана – Кельса або t-тест. Всі такі випробування були двосторонніми. Результати вважалися статистично значущими, якщо p Рисунок 3 a, b. Спостерігався значний ефект генотипу (F (1,14) = 9,97, p Рис. 3 c). Тварини KO продемонстрували значне зниження співвідношення АТ/остаточне, досягнуте за графіком PR5 (52,3 ± 6,6 проти 141,3 ± 15,8 для WT, p Рис. 3 c). Всі тварини Hcrt KO демонстрували часті паузи під час випробувань, і всі врешті-решт перестали натискати на важіль протягом 15 хв, відповідаючи критерію припинення 120-хвилинних експериментальних сеансів (середня тривалість сеансу KO 45,6 ± 4,7 хв). Детальний аналіз даних показав, що протягом перших 10 хв експериментальних сеансів у легкій фазі KO та WT мали подібну характеристику (рис. 3, d). Проте, по мірі того, як сесії прогресували, КО демонстрували значне і стійке зниження швидкості натискання важеля на відміну від ЗТ. Спостерігався значний ефект генотипу (F (1,16) = 8,13, p Рис. 3 d). Часті паузи в оперантній поведінці були очевидними при аналізі інтервалів інтерпресу; Тварини KO продемонстрували більшу кількість довгих інтервалів інтерпресу, особливо тих, що> 2 с (всі p Рис. 3 e).
- Хоакін Фенікс розповідає про величезну втрату ваги, розвиваючи його сміх за роль Джокера - наслідок
- Метью Макконахі виглядає вражаюче худим після того, як схуд на роль ВІЛ-інфікованого в "Далласі"
- Як правильно харчуватися, коли у вас є хвороба Грейвса - Хоча не існує певної дієти для запобігання чи лікування
- Настійно рекомендується
- IJERPH Безкоштовна повнотекстова поширеність впливу відносного віку в російському футболі Роль хронологічного