Стимуляція норадренергічної передачі ребоксетином корисна для мишачої моделі прогресуючого паркінсонізму
Предмети
Анотація
Вступ
Хвороба Паркінсона (БП) - друге за поширеністю нейродегенеративне розлад, що вражає до 3% людей похилого віку (> 65 років). PD характеризується руховим дефіцитом, таким як тремор, ригідність та брадикінезія 1. Ці симптоми в основному спричинені втратою дофамінергічних нейронів, розташованих у чорній речовині (SN) та вентральній тегментальній ділянці (VTA). Оскільки понад 90% випадків ПД мають спорадичне походження, у лікуванні захворювань досягнуто незначних успіхів. Протягом останніх 40 років дослідники зосереджувались на фармакологічному посиленні передачі дофамінергічного препарату, яке зазвичай здійснюється, коли більшість нейронів вже немає.
Це дослідження мало на меті зрозуміти, чи може фармакологічне посилення норадренергічної передачі, досягнуте або хронічним застосуванням селективного інгібітора зворотного захоплення NA (ребоксетин, REB), або антагоністом альфа2-AR (атипамезол, APM) може полегшити рухові ефекти прогресуючої втрати дофамінергічних нейронів та чи може ця норадренергічна стимуляція мати якийсь сприятливий вплив на виживання дофамінергічних нейронів та вміст дофаміну в смугастих тканинах у мишачої моделі прогресуючого паркінсонізму.
Для перевірки цієї гіпотези ми використали умовну нокаутовану модель миші, у якій відсутній фактор ініціації транскрипції-IA (TIF-IA), що характеризується індуцируемим пригніченням основної клітинної функції, такої як синтез рРНК у дофамінергічних нейронах, щоб викликати їх прогресивну нейродегенерацію 11 . Ці миші-мутанти імітують багато ознак PD, включаючи прогресивну та селективну вразливість нейронів SN, дефіцит рухової координації, а також посилення дисфункції мітохондрій та збільшення пошкодження окисного стресу 11. Важливо, як було показано раніше, деякі ефекти цієї мутації можуть бути частково врятовані введенням L-DOPA 11, а також інгібуванням проапоптотичних сигнальних шляхів, таких як p53, та посиленням головного регулятора синтезу білка, механістичної мішені. рапаміцину (mTOR) 11,12, що підтверджує їх потенційне використання як моделі для модифікуючої хвороби терапії проти дофамінергічної нейродегенерації.
Матеріали і методи
Тварини
Селективна абляція TIF-IA у дофамінергічних нейронах (миші TIF-IA DATCreERT2) була досягнута за допомогою Cre/loxP підхід. Проведення трансгенних мишей Cre рекомбіназу під промотором допамінового транспортера (DAT) (миші DAT CreERT2) схрещували з тваринами, що містять флоксированний ген TIF-IA, як описано раніше 11. Самців-самців-мутантів мишей утримували з контрольними (Cre-негативними) одноплідниками тієї самої статі в самовентильованих клітинах у стандартних лабораторних умовах (12 год цикл світло/темно, їжа та вода ad libitum). Дослідження проводилось у суворій відповідності з рекомендаціями Керівництва з догляду та використання лабораторних тварин Національних інститутів охорони здоров’я. Протокол усіх поведінкових досліджень був затверджений Комітетом з етичного контролю тварин при Інституті фармакології Польської академії наук (Номер дозволу: 951/2012, виданий: 28.06.2012).
Наркотики та графік експериментів
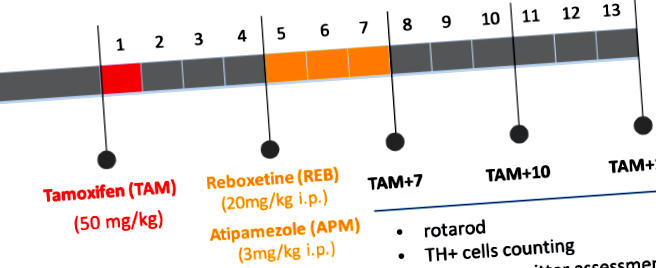
Щоб активувати залежну від тамоксифену рекомбіназу CreERT2 у дорослих мишей (віком 12 тижнів) та викликати мутацію, ми застосували тамоксифен (TAM) (Sigma-Aldrich, США), розчинений у олії в дозі 1 мг/миша, 2 × на день протягом 5 днів поспіль, за 4 тижні до введення досліджуваних препаратів. Контрольні (з масою) тварини отримували лише олію. Ребоксетин (REB) (Tocris Bioscience, США) та атіпамезол (APM) (Antisedan, Orion Pharma, Польща) вводили один раз на день протягом 21 дня поспіль у дозах 20 мг/кг та 3 мг/кг відповідно. Контрольні групи отримували 0,9% NaCl. Всі поведінкові та біохімічні аналізи проводили через 7, 10 та 13 тижнів після ін'єкцій ТАМ (ТАМ + 7, ТАМ + 10, ТАМ + 13), як показано на рис. 1.
Блок-схема, що узагальнює експериментальний дизайн. ТАМ - тамоксифен, РЕБ - ребоксетин, АРМ - атіпамезол; ТАМ + 7, ТАМ + 10, ТАМ + 13: 7, 10, 13 тижнів після індукції мутації (застосування тамоксифену).
Тест Ротарода
Для оцінки координації рухів проводили тест на ротарод. Тест проводили на прискореному ротароді (Уго Базиле, Італія). Оцінюванню передувало тренувальне заняття за день до першого експерименту (5 хв на обертовій штоці з постійною швидкістю). Під час експериментальних сеансів, проведених на 7, 10 і 13 тижнях після ін'єкції тамоксифену, вимірювали час, проведений на прискорювальному стрижні (4 до 40 об/хв протягом 5 хв).
ВЕРХ-аналіз
Імуногістохімія
Процедуру проводили, як описано раніше 14, з деякими змінами. Коротко кажучи, мозок видалили, зафіксували на 48 год у 4% параформальдегіді (PFA), промили та перенесли на 0,4% PFA. Після фіксації мозок розрізали на вібратомі (Leica, Німеччина) на ділянки 30 мкм. Зрізи середнього мозку, включаючи SN/VTA, інкубували протягом ночі при 4 ° C з первинним антитірозингідроксилазою (TH) (1: 500, Millipore, США, кішка № AB1542) антитілом. Візуалізацію зв’язаного з антигеном первинного антитіла проводили з використанням відповідного біотинільованого вторинного антитіла з наступною інкубацією з комплексом Авідін/Біотин (ABC; Vector Laboratories, США) та фарбуванням діамінобензидину (DAB; Sigma, США). Забарвлені зрізи отримували та аналізували під світловим мікроскопом (Nikon Eclipse50i, Японія), оснащеному камерою та програмним забезпеченням NIS Elements. Кількісне визначення TH-позитивних клітин (TH +) проводили вручну, підраховуючи всі клітини TH + на сусідніх зрізах від 6 тварин кожного генотипу/лікування в односліпому експерименті.
Первинні ембріональні культури клітин середнього мозку та медикаментозне лікування
Статистичний аналіз
Статистичний аналіз проводили за допомогою програмного забезпечення Graph Pad Prism 7. Дані оцінювали за допомогою двостороннього дисперсійного аналізу (двосторонній ANOVA, генотип × лікування) з багаторазовим порівнянням біологічно релевантних груп (з урахуванням 3 різних часових точок аналізу) з подальшим тестом ЛСД Фішера після спеціального тесту. Значення Р нижче 0,05 вважали статистично значущими.
Результати
Лікування ребоксетином покращувало рухові порушення у мишей TIF-IA DATCreERT2
Як зазначено на рис. 1, ми викликали умовну абляцію TIF-IA шляхом ін'єкції TAM і розпочали 21-денну терапію REB або APM через 4 тижні після TAM, час, необхідний для ефективної TAM-індукованої рекомбінації. Щоб дослідити, чи може REB або APM мати якийсь позитивний вплив на рухові дефіцити, спричинені поступовою втратою дофамінергічних нейронів у мишей TIF-IA DATCreERT2, ми протестували контрольних та мутантних тварин у три різні часові моменти (7, 10 та 13 тижнів після TAM (TAM + 7, TAM + 10 і TAM + 13) Ротародом. На підставі попередніх експериментів, попередньо показано, що ці стадії призводять до прогресуючого паркінсонізму, починаючи з TAM + 7 (без будь-якої втрати клітин) і розвиваючись у важкому поведінковому фенотипі асоційоване з глибокою дофамінергічною дегенерацією при TAM + 13 11. Як і очікувалось, у мишей TIF-IA DATCreERT2, які отримували VEH, виявлено значне зниження витривалості (на 57,7% порівняно з контролем, тварини, оброблені VEH, двосторонній ANOVA: генотип F (2218 ) = 12,63; p Рисунок 2
Лікування ребоксетином збільшило виживання нейронів DA у мишей TIF-IA DATCreERT2
Для подальшого дослідження запропонованого сприятливого впливу лікування РЕБ на виживання дофамінергічних нейронів ми провели імунофарбування для ідентифікації клітин TH + в області SN та VTA (рис. 3), що підтвердило початкові поведінкові спостереження. Зокрема, миші TIF-IA DATCreERT2, які отримували REB, показали меншу втрату клітин на 10 тижні після індукції тамоксифеном (TAM + 10). Мутантні миші, оброблені VEH, характеризувались майже 50% втратою клітини TH + порівняно з контрольними тваринами, що було значно нижче, ніж у мутантів, оброблених REB (49,7% проти 26,9%; двосторонній ANOVA: генотип F (3,24) = 84,43; p миші DATCreERT2 продемонстрували значну втрату клітин TH +, однак втрата клітин була трохи більш глибокою у тварин, які отримували VEH. Подібна картина кінетики дегенерації спостерігалася у VTA оброблених REB та оброблених VEH TIF-IA DATCreERT2 миші (рис. 3B, D).
Оцінка дофамінергічної нейродегенерації, виявлена за допомогою імунозабарвлення клітин TH +. Імуногістохімічне фарбування клітин TH + візуалізується в (A) SN і (B) Нейрони VTA; кількісне визначення клітин TH +, проведене в (C.) SN і (D) VTA дофамінергічні нейрони. Стовпчики представляють відсоток контролю; ТАМ - тамоксифен, SAL - фізіологічний розчин, REB - ребоксетин; ТАМ + 7, ТАМ + 10, ТАМ + 13: 7, 10, 13 днів після індукції мутації (застосування тамоксифену). Дані є середнім значенням ± SEM; *** p # p DATCreERT2 у відповідний момент часу; n = 4.
Вплив лікування ребоксетином на вміст дофаміну та норадреналіну в смугастому тілі мишей TIF-IA DATCreERT2
Оскільки не було різниці між експериментальними групами через 7 тижнів після індукції TAM (TAM + 7) щодо моторних показників та параметрів підрахунку клітин TH +, через обмежену доступність мутантних мишей, далі ми зосередилися на часових точках TAM + 10 і TAM + 13 для подальшого дослідження корисних ефектів REB на рівень дофаміну (DA) у смугастому тілі мишей TIF-IA DATCreERT2. Як і очікувалося, мутація призвела до значного виснаження DA у всіх тварин через 13 тижнів після індукції тамоксифеном (TAM + 13) (двостороння ANOVA: генотип F (1,39) = 21,86; p мишей DATCreERT2 через 10 тижнів після індукції тамоксифеном) TAM + 10) демонстрував суттєво різні рівні вмісту DA в залежності від лікування наркотиками (двостороння ANOVA: часовий момент F (3,39) = 72,8; p Рисунок 4
Зміни рівня тканин (A) дофамін (DA), (B, C) його метаболіти (DOPAC, HVA) та (D) рівні норадреналіну (NA). Стовпчики представляють фактичне значення кожного нейромедіатора або його метаболіту в тканинах пг/мг; ТАМ - тамоксифен, SAL - фізіологічний розчин, REB - ребоксетин; ТАМ + 10, ТАМ + 13: -10, 13 днів після індукції мутації (застосування тамоксифену). Дані є середнім значенням ± SEM; *** p ## p # p DATCreERT2 у відповідний момент часу; n = 6.
Альфа1-адренергічний агоніст фенілефрин виявив потенціал виживання в первинній культурі клітин середнього мозку ембріона
Щоб перевірити гіпотезу, чи можуть мати спостережувані сприятливі ефекти норадренергічної стимуляції як такі нейропротекторний потенціал, можливо опосередкований альфа1-АР, ми провели додатковий в пробірці експеримент на первинній культурі ембріональних нейронів середнього мозку, отриманих від масової маси мишей C57Bl/6J. Клітини обробляли фенілефрином, селективним агоністом рецептора альфа1-AR. Після додавання препарату та без подальшої зміни середовища клітини з часом почали гинути. Фенілефрин збільшував виживання клітин TH + у порівнянні з необробленими культурами клітин (рис. 5А, Б). Цей ефект був подібний до застосування фактору росту GDNF, слугуючи позитивним контролем. Зокрема, безпосереднє нанесення фенілефрину на культуральне середовище суттєво збільшило виживання клітин TH + до 49% порівняно з необробленими клітинами, тоді як ефективність лікування GDNF досягла 58% (рис. 5B). Лікування REB не виявляло жодних ефектів на кількість клітин TH +, однак важливо зазначити, що REB діє переважно як інгібітор зворотного захоплення норадренергічних препаратів, маючи лише низьку спорідненість до рецепторів альфа1-AR.
Обговорення
Оскільки наші попередні результати показали, що деякі хронічно введені антидепресанти, які діють шляхом посилення норадренергічної передачі, посилюють експресію альфа1-АР 19, і у світлі даних, що свідчать про їх нейропротекторну активність 20, тут ми вирішили визначити, чи хронічне лікування ребоксетином, високоспецифічний інгібітор зворотного захоплення норадренергічного препарату чинить будь-який позитивний вплив на часовий хід прогресування симптомів у новій моделі прогресуючого паркінсонізму. Крім того, ми розширили це дослідження, включивши інший препарат, атіпамезол, антагоніст альфа2-АР, який може посилити передачу норадренергічних засобів, але з іншим фармакологічним механізмом дії, блокуючи авторецептори альфа2-АР. Експериментальні дослідження на тваринах показують, що це може також мати сприятливий ефект для відновлення після пошкодження мозку та посилити антипаркінсонічний ефект дофамінергічних препаратів 21 .
На наш подив, сприятливі ефекти стимуляції норадренергічної системи були обмежені, скоріше, лікуванням REB, а не APM. Серед мишей TIF-IA DATCreERT2, які отримували наркотики, поведінкові характеристики були покращені REB, а не APM, як це відображається на моторних показниках при тестуванні ротарода при TAM + 13 (рис. 2A, B). Ці позитивні ефекти лікування РЕБ були очевидно помітними на внутрішньоклітинному рівні, зокрема на ТАМ + 10, стадії, коли ми виявили менше зменшення кількості дофамінергічних нейронів СН після лікування РЕБ, і це, крім того, відповідає сприятливому впливу РЕБ на рівень дофаміну в стриатум (рис. 3, 4А).
Оскільки доступність трансгенних тварин обмежена, неможливо було провести експерименти з кількома дозуваннями кожної сполуки. Однак дозування REB та APM було обрано на основі власного попереднього досвіду та відомих даних з літератури щодо ефектів цих препаратів 22,23,24,25,26,27. Зокрема, було доведено, що REB є високоефективним у дозі 10 мг/кг 24,27, а АРМ посилює передачу норадренергічних препаратів у дозі 3 мг/кг 23. Однак інші повідомлення показують, що різні антагоністи альфа2-АР можуть мати різний дозозалежний вплив на норадренергічну стимульовану поведінку 28. Примітно, що принаймні у людей APM може мати побічний ефект зменшення багатозадачності, що може перешкоджати здатності більш вразливих тварин-мутантів справлятися з прискореним стрижнем 21. Проте, грунтуючись на первинних поведінкових висновках, що не підтверджують потенціал цього препарату, ми вирішили провести подальший аналіз лише на тваринах, які отримували РЕБ, та їх контрольних однолітках.
Потенційні сприятливі ефекти лікування РЕБ на рухову поведінку в моделі TIF-IA DATCreERT2 були підтверджені аналізом втрати нейронів SN/VTA, як візуалізується підрахунком клітин TH + (рис. 3A – D), особливо через 10 тижнів після індукції мутація (TAM + 10) в області SN. У той час втрата клітин TH + у мишей TIF-IA DATCreERT2, оброблених VEH, була чітко видно, тоді як у мутантів, оброблених REB, вона мало чим відрізнялася від контрольних односмітників. Більше того, між цими двома групами існувала суттєва різниця (рис. 3С). Через 13 тижнів після індукції тамоксифеном (TAM + 13) миші TIF-IA DATCreERT2, які отримували REB та VEH, демонстрували чітку втрату клітин TH + у SN. Подібна картина змін спостерігалась і у ВТА (рис. 3D).
Цікаво, що попередня робота продемонструвала сприятливий вплив REB на немоторні симптоми БД у моделі 6-гідроксидопаміну (6-OHDA) 29. Більше того, L-DOPA не модифікував депресивну та подібну до тривоги поведінку в цій моделі 29. На сьогоднішній день ми не маємо доказів немоторних симптомів у мишей TIF-IA DATCreERT2, і це потрібно буде розглянути в майбутніх експериментах.
Ця ідея також узгоджується із спостереженням, що ліки, спрямовані на норадренергічну та серотонінергічну системи (тобто міртазапін), можуть бути терапевтичними проти нейротоксичності MPTP у мишей, можливо, регулюючи вивільнення DA 35. Для вирішення цього питання ми проаналізували посмертно рівні DA у два моменти часу - через 10 та 13 тижнів після ін’єкцій тамоксифену. Ми змогли побачити диференційовані ефекти лікування REB через 10 тижнів після індукції мутації (TAM + 10), що виявляється за вмістом дофаміну в смугастому тілі мишей, оброблених REB та VEH, мишей TIF-IA DATCreERT2 (рис. 4А). Через 13 тижнів (ТАМ + 13) смугасті рівні дофаміну були глибоко знижені у всіх мутантів з однаковим ступенем, незважаючи на медикаментозне лікування (рис. 4А). Це не дивно, оскільки на цій стадії тварини також мали більш-менш схожі показники втрати клітин TH + (рис. 3A – D), і, як уже було згадано, малоймовірно очікувати, що наслідки мутація може бути відкладена на більш тривалий проміжок часу. Для всіх тварин, які отримували REB, також були характерні більш високі рівні NA, що можна пояснити довготривалими змінами, викликаними хронічним 21-денним лікуванням цим високоселективним інгібітором зворотного захоплення NA (рис. 4D).
Підсумовуючи, можна зробити висновок, що лікування РЕБ може мати сприятливі ефекти при ПД. Однак залишається незрозумілим, чи ці ефекти просто пов'язані з адаптивними змінами у відповідь на стимуляцію норадренергічної системи чи нейропротекторною властивістю норадренергічної стимуляції на дофамінергічні нейрони. На цьому етапі ми не можемо виключити, що покращений PD-подібний фенотип у мишей, які отримували TIF-IA DATCreERT2, які отримували REB, принаймні частково був пов’язаний із адаптивними змінами після 3-тижневого лікування наркотиками та посилив норадренергічну передачу, про що відомо посилюють збудження та пильність і, отже, можуть покращити здатність виконувати завдання на обертовому колесі. Тим не менше, наші результати вказують на можливий вплив норадренергічної системи на дофамінергічні нейрони і підтримують потенціал НС як терапевтичної мішені при БД, що було запропоновано іншими 10,40,41 .
Список літератури
Poewe, W. та ін. Хвороба Паркінсона. Nat Rev Dis Primer 3, 17013 (2017).
Braak, H., Ghebremedhin, E., Rub, U., Bratzke, H. & Del Tredici, K. Етапи розвитку патології, пов'язаної з хворобою Паркінсона. Дослідження клітин і тканин 318, 121–134 (2004).
- SteelSeries Rival 110, Custom TrueMove1, 7200 CPI, 240 IPS, Prism RGB, оптична ігрова миша
- Rumer Willis Драматична модель схуднення Move or Emotional Wreck E! Інтернет
- Поради щодо догляду за шкірою Як гліцерин, рожева вода та лимонний сік корисні для шкіри
- У російської моделі Стефанії Дубровіної ревнива сестра викалює очі
- Жінка восьмого розміру сказала, що вона занадто товста, щоб моделювати нарешті знаходить успіх після того, як здобула три камені!