Статеві гормони, ожиріння та діабет 2 типу: чи є зв’язок?
Алессандра Гамбінері
Ендокринологічний відділ, кафедра медичних та хірургічних наук, лікарня Св. Орсола-Мальпігі, Університет Альма-Матер, Болонья, Болонья, Італія
Карла Пелусі
Ендокринологічний відділ, кафедра медичних та хірургічних наук, лікарня Св. Орсола-Мальпігі, Університет Альма-Матер, Болонья, Болонья, Італія
Анотація
Дисбаланс статевих гормонів має важливий вплив на діабет 2 типу (T2DM), головним чином через залучення вісцеральної жирової тканини. Андрогени мають цікаву статево-диморфну асоціацію з T2DM, оскільки гіперандрогенія у жінок та гіпогонадизм у чоловіків є факторами ризику T2DM. Таким чином, лікування, спрямоване на корекцію гіперандрогенії у жінок та гіпогонадизму у чоловіків, може запобігти розвитку T2DM або допомогти в його лікуванні.
Роль статі та статі у розвитку діабету 2 типу
З'являється все більше доказів того, що стать та гендерні відмінності впливають на епідеміологію, патофізіологію, лікування та результати багатьох захворювань, включаючи діабет 2 типу (T2DM) (1). Термін стать використовується в першу чергу для позначення біологічних відмінностей, а термін стать переважно описує психосоціальні відмінності між статями. Статеві відмінності між жінками та чоловіками включають відмінності в статевих гормонах та їх вплив на системи органів. Гендерні відмінності виникають внаслідок соціокультурних процесів і включають різні форми харчування, спосіб життя чи стрес або ставлення до лікування та профілактики захворювань. Статеві та гендерні відмінності однаково важливі з точки зору розвитку, обізнаності, презентації, діагностики та терапії, а також профілактики СД2, впливаючи один на одного, перш за все через вплив на ожиріння. Існує загальна думка, що ожиріння є основним фактором ризику розвитку СД2 у обох статей, що підтверджується даними про поширеність СД2 в регіонах, які нагадують ожиріння (2).
Цей огляд фокусується на зв’язку між статевими гормонами та T2DM через вплив дисбалансу статевих гормонів на метаболічні тканини, особливо на жирову тканину. Підкреслено статевий диморфізм андрогенів у патофізіології Т2ДМ.
Відмінності статевих гормонів між статями
Той факт, що обидві статі виробляють однакові стероїдні гормони подібним чином, означає, що фізіологічні відмінності обов'язково є кількісними з точки зору (i) кількості андрогену та (ii) якого відсотка цієї кількості перетворюється на естроген. Якщо зосередитись на тестостероні та Е2, двох найпотужніших представниках своїх класів та основних гормонах, синтезованих у статевих залозах, очевидні дві різкі відмінності. Яєчко виробляє приблизно 7000 мкг тестостерону на день і перетворює чверть 1% в Е2, тоді як яєчник виробляє лише 300 мкг тестостерону на день, але повністю перетворює половину його в Е2. Таким чином, чоловіки виробляють принаймні в 20 разів більше тестостерону, ніж жінки; однак відсоток тестостерону, який перетворюється на Е2 у жінки, у 200 разів перевищує показник у чоловіка. В обох статей тестостерон індукує естроген сульфотрансферазу (EST), яка інактивує E2 в сульфаті E2 (E2-S); отже, чим вищі рівні тестостерону, тим вища інактивація Е2 в сульфаті Е2, що сприяє кількісним відмінностям статевих стероїдів між статями (4).
Однак існує також якісна різниця між статями, яка залежить від місця виробництва Е2. У здорових жінок в пременопаузі E2 в основному виробляється яєчниками і функціонує як циркулюючий гормон, який діє на віддалені тканини-мішені. У чоловіків та жінок у постменопаузі Е2 не діє як циркулюючий гормон; швидше, він синтезується в основному в екстрагонадальних ділянках і діє як паракринний та внутрішньокринний фактор (4).
Частина відмінностей статевих гормонів між статями також залежить від глобуліну, що зв’язує статеві гормони (ГСГГ), який регулює біологічну дію статевих стероїдів (5). Андрогени та естрогени транспортуються в кров за допомогою білків, особливо SHBG та альбумінів, які регулюють доступ стероїдних гормонів до клітин-мішеней. Ці білки мають різну спорідненість до лігандів: альбумін пов'язує статеві гормони нечітко і з низькою спорідненістю, тоді як SHBG пов'язує статеві гормони з високою спорідненістю, але спорідненість до тестостерону вдвічі більша за спорідненість до Е2 і відрізняється між статями. Крім того, у жінок кількість тестостерону, який зв’язується з ГСПГ, значно вища, ніж у чоловіків (77 проти 53%). Отже, зміни рівня ГСПГ мають більший вплив на рівень вільного тестостерону (і, отже, на його біологічну експресію), ніж на відповідний рівень вільного Е2, і це особливо видно на рівні вільного тестостерону у жінок щодо чоловіків. Таким чином, сироватковий транспорт андрогенів та естрогенів сприяє різниці залежно від статі, регулюючи відносний рівень вільних гормонів, доступний для тканин-мішеней. Основні відмінності статевих гормонів між статями наведені в таблиці 1 .
Таблиця 1
Основні відмінності статевих гормонів між статями.
| Тестостерон | Чоловіки виробляють у 20 разів більше тестостерону, ніж жінки за день | (3) |
| Естрадіол (Е2) | Чоловіки перетворюють тестостерон в Е2 у відсотках, який у 200 разів нижчий, ніж у жінок Е2 у чоловіків синтезується в екстрагонадальних ділянках і виконує функцію паракринного та внутрішньокринного фактора Е2 у жінок в основному синтезується в яєчниках і функціонує як циркулюючий гормон | (3, 4) |
| Естрогенсульфотрансфераза (EST) | EST є більш активним у чоловіків, ніж у жінок | (4) |
| Глобулін, що зв’язує статеві гормони (ГСГБ) | Тестостерон, зв’язаний з ГСПГ, нижчий у чоловіків, ніж у жінок (53% проти 77%) | (5) |
Статево-диморфна зв'язок між андрогенами та діабетом 2 типу є результатом клінічних досліджень
Статево-диморфна зв'язок між тестостероном і T2DM, яка постійно спостерігається серед расових та етнічних груп, особливо очевидна в клінічних дослідженнях (6). Існує багато перехресних популяційних досліджень, які демонструють, що нижчий рівень тестостерону у чоловіків та вищий рівень тестостерону у жінок пов'язані з T2DM, тоді як нижчі рівні SHBG пов'язані з T2DM, особливо у жінок (7). Таким чином, деякі проспективні популяційні дослідження показують, що ендогенний тестостерон може різним чином впливати на ризик розвитку СД2 у чоловіків та жінок. Зниження рівня тестостерону (як загального, так і вільного) у чоловіків насправді пов'язане з вищим ризиком розвитку СД2, тоді як більш високий рівень тестостерону (як загальний, так і вільний), а також нижчий рівень ГСГ у жінок пов'язані з вищим ризиком розвитку СД2 ( 8).
Цікаво, що проспективні дослідження, проведені на чоловіках, демонструють, що зворотна залежність між тестостероном та ризиком діабету в основному залежить від фенотипу абдомінального ожиріння. Насправді, після регулювання окружності талії, це співвідношення різко послаблюється (9). У жінок ризик розвитку T2DM зростає із загостренням гіперандрогенії (10) і стає особливо очевидним при гіперандрогенних розладах, таких як синдром полікістозних яєчників (СПКЯ).
Подібні висновки, але із зворотним співвідношенням, також були запропоновані для чоловіків. Приблизно у однієї третини чоловіків з Т2ДМ або метаболічним синдромом спостерігався ненормальний рівень загального та вільного тестостерону, головним чином пов'язаний з неадекватно низькими концентраціями ЛГ та ФСГ (21, 22). Цей стан нещодавно було визначено як функціональний гіпогонадизм, що характеризується гормональними рівнями, сумісними з гіпогонадотропним гіпогонадизмом, нормальною реакцією ЛГ та ФСГ на подразник ГнРГ та відсутністю аномальної анатомічної осі гіпоталамус-гіпофіз-яєчка. Незважаючи на те, що гіпогонадотропний гіпогонадизм, як видається, є домінуючим станом, пов'язаним із хворими на Т2ДМ, у літературі також повідомляється, що мінімальний відсоток хворих на цукровий діабет також має низький рівень тестостерону з високими концентраціями гонадотропіну (21). У будь-якому випадку, незалежно від біохімічної форми гіпогонадизму, пов’язаного з T2DM у чоловіків, тобто гіпер- або гіпогонадотропного, у всіх хворих на цукровий діабет із низьким рівнем тестостерону зазвичай спостерігаються такі значущі симптоми, що свідчать про гіпогонадизм, такі як стомлюваність та еректильна дисфункція.
Зв'язок між низьким рівнем тестостерону та T2DM у чоловіків була повністю встановлена і вважається двонаправленою, хоча існує більше літератури, що підтверджує вплив низького тестостерону на розвиток T2DM. Було підраховано, що низький рівень тестостерону на початковому рівні приблизно вдвічі збільшує шанси розвитку Т2ДМ у чоловіків (23, 24). Більше того, метааналіз 2011 року 52 спостережних досліджень, пов’язаних з метаболічним синдромом та детермінантами статусу тестостерону, показав, що чоловіки з найвищим рівнем тестостерону мають нижчий ризик метаболічного синдрому, ніж чоловіки з найнижчим рівнем тестостерону (оцінка RR: 0,38, 95 % ДІ 0,28–0,50). Крім того, у тих чоловіків з більш високим рівнем ГСГ був знижений ризик розвитку метаболічного синдрому (оцінка RR = 0,29, 95% ДІ 0,21–0,41) (25). Можливість того, що особи чоловічої статі з низьким рівнем тестостерону схильні до T2DM, підтверджена лонгітюдними дослідженнями в мета-аналізі з медіаною спостереження 10 років (26).
З іншого боку, кілька досліджень показали, що тривалість та тяжкість гіперглікемії, схоже, не відповідають за низький рівень тестостерону у хворих на СД2 (27), а навпаки, це ожиріння та інсулінорезистентність (24, 28, 29). Це підтверджується порівняно рідкісними випадками гіпогонадотропного гіпогонадизму, описаними у хворих на цукровий діабет 1 типу (30), а також добре встановленим зворотним зв'язком між рівнем загального та вільного тестостерону, що циркулює, з ІМТ (24, 31). Крім того, цитокіни, що виробляються жировою тканиною, можуть безпосередньо сприяти придушенню осі гіпоталамус гіпофіз - гонади (32, 33), а отже, і розвитку гіпогонадотропного гіпогонадизму. Відповідно, зв'язок, що спостерігається між тестостероном або ГСГБ та рівнем глюкози у чоловіків-гіпогонадів з Т2ДМ, значно ослабла після коригування ожиріння (34).
Хоча ожиріння відіграє важливу роль у зниженні рівня тестостерону при СД2, у деяких хворих на цукровий діабет із нормальним ІМТ може спостерігатися гіпогонадотропний гіпогонадизм (31), що свідчить про пряму ключову роль інсулінорезистентності. Деякі дослідження на тваринах та людях довели зворотний зв'язок між тестостероном та резистентністю до інсуліну (35, 36), а також підвищений ризик розвитку СД2 (37). Показано, що миші з нейроноспецифічним порушенням гена рецептора інсуліну (миші NIRKO) розвивають периферичну резистентність до інсуліну та знижують концентрацію ЛГ та тестостерону. Це, таким чином, свідчить про важливу роль сигналізації рецепторів інсуліну в мозку для підтримки функціональної цілісності осі гіпоталамус-гіпофіз-гонади та розподілу енергії (38).
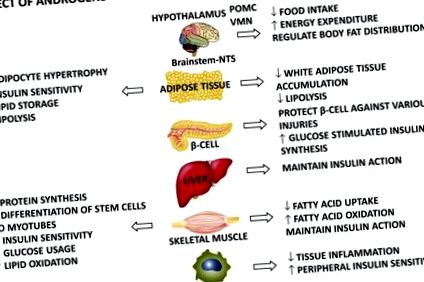
Вплив статевих гормонів на метаболічні метаболічні тканини обох статей.
Існує гіпотеза, що на фізіологічних рівнях андрогенів, пов’язаних зі статтю, чистий ефект на міоцити переважає як у чоловіків, так і у жінок, тоді як на патологічних рівнях андрогенів (гіпогонадизм у чоловіків та гіперандрогенія у жінок) чистий вплив на жирову тканину рухає системним фенотип і породжує метаболічні захворювання.
Цікаво, що нещодавно кілька моделей гризунів, овець та приматів продемонстрували, що андрогени безпосередньо діють на центральну нервову систему, впливаючи на метаболізм статевим диморфним шляхом також на фізіологічних рівнях (42). Андрогени безпосередньо регулюють вихід симпатичної нервової системи до білої жирової тканини (WAT) та споживання їжі завдяки регуляції орексигенного пептиду проопіомеланокортин-POMC, центральної чутливості до лептину та витрат енергії статевим диморфним способом. У жінок андрогени збільшують симпатичний вихід до ВАТ, збільшують споживання їжі, виробляють стійкість до лептину та зменшують витрати енергії, тоді як вони мають протилежний ефект у чоловіків. Цей центральний статевий диморфний ефект андрогенів, ймовірно, сприяє абдомінальному ожирінню, резистентності до інсуліну та T2DM у гіперандрогенних та гіпогонадичних станах у жінок та чоловіків відповідно.
Роль естрогенів у метаболічних тканинах-мішенях: потенційна роль у зв'язку гіпогонадизму та діабету 2 типу у чоловіків
Беручи до уваги всі ці позитивні метаболічні ефекти естрогенів, можна припустити, що гіпоестрогенний стан, що характеризує гіпогонадизм у чоловіків, може брати участь у виробленні та/або посиленні T2DM через його вплив на активацію метаболічних тканин, особливо жирової тканини.
Зв'язок між ожирінням, особливо вісцеральним ожирінням, та діабетом 2 типу
Таким чином, це підтверджує зв'язок між дисфункціями статевих стероїдів (гіперандрогенією у жінок та гіпогонадизмом у чоловіків), ожирінням вісцеральної системи та T2DM у обох статей.
Метаболічний вплив антиандрогенів у гіперандрогенних самок
Що стосується гіперандрогенних самок, в даний час існує мало даних, що підтверджують використання антиандрогенів для профілактики або лікування СД2. Могетті та ін. продемонстрували, що кілька місяців лікування антиандрогеном у жінок, уражених СПКЯ, значно підвищували чутливість до інсуліну, оцінювану еуглікемічно-гіперинсулінемічним затискачем (45). Наша група підтвердила, що 12 місяців антиандрогенної терапії у жінок із СПКЯ із зайвою вагою/ожирінням покращили чутливість до інсуліну та зменшили ПДВ (46). Ми також продемонстрували, що жінки СПКЯ, які довго лікувались пероральними контрацептивами третього покоління (ОК), які можна вважати антиандрогенною терапією, порівняно з тими, хто не лікувався ОК, підтримували стабільну масу тіла, а їх інсулінорезистентність не погіршується, але навпаки, толерантність до глюкози покращується. Ці результати свідчать про те, що ОКП при СПКЯ борються із природним погіршенням обміну речовин протягом усього життя (47). Загалом, ці дані свідчать про те, що антиандрогени можна використовувати для профілактики або лікування T2DM при СПКЯ; однак для підтвердження цих даних необхідні додаткові дослідження.
Метаболічний вплив корекції тестостерону у чоловіків-гіпогонадів
Зараз пацієнтам із функціональним гіпогонадизмом вводять новий клас препаратів, селективні модулятори рецепторів естрогену, що призводить до збільшення концентрацій андрогенів до фізіологічних діапазонів, підтримуючи таким чином їх потенційне використання в якості альтернативного варіанту в цій галузі (57). Зокрема, кломіфен цитрат, діючи як антагоніст естрогену на рівні гіпофіза, індукує вивільнення ЛГ та ФСГ, що, в свою чергу, зумовлює ендогенну стероїдогенну продукцію у функціональних пацієнтів з гіпогонадією (58, 59). На сьогоднішній день лише декілька досліджень оцінювали вплив кломіфен-цитрату на склад тіла та метаболізм глюкози, але всі вони мали багатообіцяючі результати (59, 60). Наша група виявила позитивний ефект кломіфену цитрату на покращення рівня глюкози та інсуліну у пацієнтів із ожирінням із дисметаболічними захворюваннями з низьким рівнем тестостерону (59), підтримуючи тим самим їх потенційне застосування у цих пацієнтів.
Незважаючи на те, що вищезазначені результати настійно свідчать про те, що підвищення рівня андрогену за допомогою добавок тестостерону або інших методів лікування позитивно впливає на T2DM у чоловіків-гіпогонадів, все ж необхідні подальші клінічні випробування для підтвердження цього сценарію та визначення відповідних підходів.
Висновки
Модель, яка пояснює внесок різних факторів у розвиток T2DM, приписує особливо велику роль ожирінню та вісцерально-абдомінальній жировості, за умови наявності генетичної схильності, і це підкреслюється за наявності дисбалансу статевих стероїдів. Статевий диморфізм андрогенів у патофізіології СД2 свідчить про наявність нерівності як у профілактичній стратегії, так і у лікуванні жінок та чоловіків, а також підкреслює потенційне використання гендерно-специфічного ліки. Потрібні подальші дослідження в цій захоплюючій галузі.
Декларація про інтерес
Автори заявляють, що не існує конфлікту інтересів, який міг би сприйматися як шкода неупередженості цього огляду.
Фінансування
Ця робота не отримала жодного конкретного гранту від жодної фінансової установи у державному, комерційному чи некомерційному секторі.
- Ожиріння та здоров'я порожнини рота - чи існує посилання Спостережне дослідження
- Потенційний захист від діабету 2 типу при ожирінні завдяки нижчій експресії та покращенню CD36
- Цукрові підсолоджені напої, ожиріння, цукровий діабет 2 типу та ризик серцево-судинних захворювань
- Нові варіанти лікування ожиріння та цукрового діабету 2 типу (огляд),
- Поліморфізм генів SREBF-1 пов'язаний із ожирінням та діабетом 2 типу у французьких людей із ожирінням та