Накопичення кишкової тканини 3-дезоксиглюкозоном, що послаблює секрецію GLP-1 та його інсулінотропний ефект у щурів
Луронг Чжан
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Сюдао Пісня
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Лян Чжоу
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Гоцян Лян
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Хен Сю
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Фей Ван
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Фей Хуан
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Горонг Цзян
Сучжоуська академія китайської медицини Умен, лікарня традиційної китайської медицини Сучжоу, № 18, Янсу-роуд, Сучжоу, 215003 Китайська Народна Республіка Цзянсу
Пов’язані дані
Набори даних, що підтверджують висновки цієї статті, включені до статті та її додаткового файлу.
Анотація
Передумови
Наші нещодавні результати підтверджують думку про те, що 3-дезоксиглюкозон (3DG), дієтичний склад, був запропонований як незалежний фактор для розвитку переддіабету. Вважається, що секреція глюкагоноподібного пептиду-1 (GLP-1) порушується при T2DM та при станах, пов'язаних з гіперглікемією. Оскільки в одному дослідженні з введенням було зазначено низьку біодоступність 3DG у роті, у цьому дослідженні ми дослідили, чи здатний 3DG накопичуватися в кишковій тканині щурів після двотижневого введення 3DG, а лікування 3DG впливає на секрецію GLP-1 та толерантність до глюкози.
Методи
Щурам вводили шлунковий апарат протягом 2 тижнів. Ми вимірювали вміст 3DG у кишкових тканинах (за допомогою ВЕРХ), рівні загального GLP-1 (методом ІФА), інсуліну та глюкагону (обидва методом радіоімунологічного аналізу) та концентрації глюкози в крові. Експресія субодиниць солодкого рецептора (TAS1R2, TAS1R3) та його молекули TRPM5 у дванадцятипалій кишці та товстій кишці щурів визначали кількісно за допомогою WB. Ми досліджували секрецію GLP-1 в ентероендокринних клітинах STC-1, експонованих 3DG.
Результати
Лікування 3DG протягом 2 тижнів збільшувало вміст 3DG у тканинах кишечника, концентрацію глюкози в крові натще і знижувало концентрацію GLP-1 та інсуліну в плазмі натще і через 15 та 180 хв після навантаження глюкози та пероральної толерантності до глюкози у поєднанні зі збільшенням концентрації глюкагону в плазмі крові. Показано, що експресія TAS1R2, TAS1R3 та TRPM5 знижується, тоді як лікування 3DG не впливає на активність дипептидилпептидази-4 у плазмі крові, що вказує на порушення секреції GLP-1 у щурів, оброблених 3DG. Ця ідея була підтверджена тим фактом, що вплив 3DG безпосередньо зменшує секрецію GLP-1 у STC-1.
Висновок
Це перша демонстрація того, що 3DG здатний накопичуватися в кишковій тканині і тим самим зменшувати секрецію GLP-1 та інсуліну подібним чином. У щурів, оброблених 3DG, розвинулась порушення регуляції глюкози (IGR) з очевидною дисфункцією клітин острівців підшлункової залози. Далі робиться висновок, що зниження біологічної функції GLP-1 внаслідок зменшення секреції GLP-1 є найбільш вірогідним механізмом порушення секреції інсуліну, що в кінцевому підсумку сприяло розвитку ІГР. Ці результати також сприятимуть кращому розумінню значення для відновлення фізіологічної секреції GLP-1.
Електронний додатковий матеріал
Інтернет-версія цієї статті (doi: 10.1186/s13098-016-0194-9) містить додаткові матеріали, доступні для авторизованих користувачів.
Передумови
У поточному дослідженні 3DG вводили шлунком через шлунок щурам Sprague – Dawley (SD) протягом 2 тижнів для дослідження розподілу 3DG у тканинах кишечника. Ми також дослідили ефекти внутрішньошлункового введення 3DG на рівні GLP-1 у плазмі крові, інсуліну та глюкагону та регуляцію глюкози. Крім того, досліджувались експресії субодиниць солодкого рецептора (TAS1R2, TAS1R3) та його молекули TRPM5 нижче за течією в дванадцятипалій кишці та товстій кишці щурів, що пов'язано з секрецією GLP-1. Крім того, ми використовували модель L-клітин STC-1 для дослідження безпосереднього впливу 3DG на секрецію GLP-1.
Методи
Синтез 3DG
Згідно з методом Kato et al. [32], 3DG синтезували з глюкози, як описано раніше [13].
Визначення відповідних доз внутрішньошлункового введення 3DG
Попередні звіти оцінювали середнє споживання 3DG з дієтою приблизно 50 мг/день на основі вмісту 3DG у споживаних продуктах харчування [10]. Для того, щоб досягти однозначного ефекту потенційного споживання 3DG у дозі 50 мг на день, ми розрахували дозу на основі площі поверхні тіла (4,5 мг/кг для щурів). Раніше ми повідомляли, що внутрішньошлункове введення 5 мг/кг 3DG протягом 2 тижнів незначно підвищувало рівень глюкози в плазмі крові при пероральних тестах на толерантність до глюкози у мишей. Таким чином, ми давали 5, 20 або 50 мг/кг 3DG шлунково-кишковим методом.
Тварини
11-тижневі щури SD були придбані у компанії Matt Albert Technology Co. Ltd (Сучжоу, Китай) і розміщені в приміщенні з контрольованою температурою (23 ° C) і темп. Усі експериментальні процедури на тваринах проводились відповідно до Керівництва з догляду та використання лабораторних тварин (Восьме видання, 2011). Дослідження було схвалено місцевим комітетом з етики лікарні традиційної китайської медицини в Сучжоу. Щури мали вільний доступ до стандартної дієти для гризунів гризунів (Shuangshi Laboratory Animal Feed Science Co. Ltd, Сучжоу, Китай) та води. Дієта містила воду (≤10%), сирі білки (≥20,5%), сиру жир (≥4%), сиру клітковину (≤5%), сиру золу (≤8%) та суміш вітамінів та мікроелементів. Через 1 тиждень акліматизації щурів випадковим чином розділили на чотири групи з однаковою концентрацією глюкози натще, і кожна група складалася з шести щурів. Транспортний засіб (контрольний), 5 мг/кг 3DG, 20 та 50 мг/кг 3DG давали шлунково-шлунково-кишковим шляхом щодня з введеним періодом 2 тижні. Вагу тіла вимірювали щодня. Щурів голодували протягом ночі перед експериментами.
Культура клітин STC-1
Клітини STC-1, ентероендокринна кишкова клітинна лінія, були отримані з Клітинного банку Китайської академії наук (Шанхай, Китай). Клітини вирощували в модифікованому Дульбекко середовищі Eagle (DMEM; Gibco; Thermo Fisher Scientific, Inc., Waltham, MA, USA), що містить 15% (об/об) кінської сироватки, 2,5% (об/об) фетальної бичачої сироватки (FBS); Zhejiang Tianhang Biological Technology Co., Ltd., Хучжоу, Китай) та 25 ммоль/л глюкози при 37 ° C у зволоженій атмосфері 5% CO2. Для експериментів клітини вирощували до 70–80% злиття.
Пероральний тест на толерантність до глюкози (OGTT)
Після голодування протягом ночі з хвостової вени відбирали зразок базальної крові для вимірювання рівня глюкози натще, використовуючи глюкометр (ACCU-CHEK, Рош, США). Потім щурів годували глюкозою шлунково-шлунковою системою (2,5 г/кг). А додаткові зразки крові відбирали з хвостової вени через 0, 30, 60, 90, 120 та 180 хв після навантаження глюкозою, і концентрацію глюкози визначали за допомогою глюкометра. Площу під глікемічними кривими (AUC) розраховували для кожної групи щурів.
Вимірювання GLP-1, GIP, інсуліну та глюкагону в плазмі
Зразки крові з аорти черевної порожнини збирали через 15 та 180 хв після навантаження глюкозою для вимірювання інсуліну, глюкагону, GLP-1 (загальна кількість). Рівні інсуліну та глюкагону в плазмі крові аналізували за допомогою відповідних наборів для радіоімуноаналізу (Пекінський північний інститут біологічних технологій, Пекін, Китай). Концентрацію GLP-1 у плазмі крові вимірювали за допомогою наборів ELISA (Millipore, MA, США). Загальний GLP-1 включає як інтактний [GLP-1- (7–36) амід, так і GLP-1- (7–37)] та інактивовані форми GLP-1 (амід GLP-19–36 та GLP-1 9–37 деградований DPP-4).
Вимірювання активності дипептидилпептидази-4 (DPP-4) у плазмі крові
За методикою Педерсона та співавт. [33], активність DPP-4 у плазмі визначали за допомогою колориметричного аналізу, використовуючи H-Gly-Pro-p-нітроанілід (Sigma, Сент-Луїс, Міссурі, США) як субстрату.
Поширення 3DG в тканинах кишечника після лікування екзогенним 3DG
Після 2 тижнів внутрішньошлункового введення 3DG щурів тоді вбивали і кишкові тканини збирали для вимірювання вмісту 3DG за допомогою ВЕРХ. Перед вимірюванням вміст шлунково-кишкового тракту було повністю видалено.
Вестерн-блот-аналіз
У щурів, які отримували 50 мг/кг 3DG, тканини дванадцятипалої кишки та товстої кишки збирали через 2 тижні після внутрішньошлункового введення 3DG. Методи кількісного визначення вмісту цілісного білка та вестерн-блот були описані раніше [13]. Антитіла проти TAS1R2, TAS1R3 та TRPM5 були отримані від Cell Signaling Tech (штат Массачусетс, США).
Аналіз секреції GLP-1 in vitro
Клітини STC-1 висівали в шість лункових планшетів при щільності 2 × 10 5 клітин/лунка протягом 48 год; клітини потім інкубували з L-DMEM (5,6 ммоль/л глюкози), що містить 10% FBS. Через 3 год середовище згодом видалили, і клітини інкубували з 3DG або без нього при кінцевій концентрації 80, 300 та 1000 нг/мл у 0,2% BSA H-DMEM (25 ммоль/л), що містить 5 × 10 −7 М інсуліну протягом 6 год. Після інкубації середовище збирали і центрифугували при 12000 × g протягом 5 хв при 4 ° C для видалення будь-яких плаваючих клітин. Концентрацію GLP-1 у супернатанті вимірювали методом ІФА (Millipore, MA, США).
Статистичний аналіз
Результати експериментальних досліджень виражаються як середнє значення ± SD. Статистичну значимість відмінностей аналізували за допомогою критерію t Стьюдента або одностороннього дисперсійного аналізу. Усі значення р ≤ 0,05 вважали статистично значущими.
Результати
Збільшення вмісту 3DG у кишкових тканинах щурів через 2 тижні після внутрішньошлункового введення 3DG
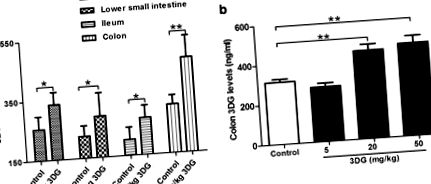
Оскільки в одному дослідженні введення [32] було зазначено нижчу швидкість всмоктування 3DG, ми далі оцінюємо, чи здатний 3DG накопичуватися в кишковій тканині після постійного перорального введення 3DG. Після внутрішньошлункового введення 50 мг/кг 3DG протягом 2 тижнів рівні 3DG значно підвищувались у верхній частині тонкої кишки (1,4 рази), нижній частині тонкої кишки (1,4 рази), клубовій кишці (1,4 рази) та товстій кишці (удвічі) порівняно з базальними рівнями у відповідній контрольній групі. Товста кишка мала найбільший приріст рівня 3DG порівняно з контролем і мала найвищий рівень серед дослідженої тканини (рис. 1 а). Рівень товстої кишки 3DG підвищувався залежно від концентрації введеного 3DG (рис. 1, b). Певна кількість 3DG у кишковій тканині контрольних щурів може відбуватися через надходження екзогенного 3DG та вироблення 3DG у кишечнику, що слід вивчити в наступному дослідженні. Ці спостереження свідчать про те, що 3DG здатний накопичуватися в кишковій тканині після тривалого регулярного прийому дієтичного 3DG.
Збільшення вмісту 3DG у кишкових тканинах щурів через 2 тижні після внутрішньошлункового введення 3DG, n = 6 для кожної групи. Верхня частина тонкої кишки, нижня частина тонкої кишки, клубова кишка (a) і товстої кишки (b) Рівні 3DG вимірювали за допомогою ВЕРХ після 2-тижневого введення 3DG або транспортного засобу. Значення є середніми ± SD. * p 2 a, транспортний засіб проти 20 мг/кг 3DG: 22,698 ± 1,466 pM проти 20,572 ± 1,395 pM, * p 2 a, транспортний засіб проти 20 mg/kg 3DG: 34,048 ± 2,198 pM проти 30,858 ± 1,093 pM, # p # p 2 b), що вказує на зменшення секреції GLP-1 у щурів, оброблених 3DG. Потім ми визначили, чи впливає 3DG безпосередньо на секрецію GLP-1 з L-клітин, ентероендокринні клітини STC-1 миші піддавали впливу 3DG у концентраціях, подібних до концентрацій, отриманих із вмісту кишкових тканин у щурів, оброблених 3DG. Як показано на рис. 2 c, секреція GLP-1 у відповідь на обробку 300 або 1000 нг/мл 3DG у звичайних культуральних середовищах була значно знижена. Крім того, за умов випробуваних 3DG при концентраціях 80, 300 та 1000 нг/мл не вдалося змінити життєздатність клітин STC-1 (рис. 2, d). Ці результати вказували на порушення секреції GLP-1 у щурів, оброблених 3DG.
Знижена експресія TAS1R2, TAS1R3 та TRPM5 як у дванадцятипалій кишці, так і в товстій кишці щурів через 2 тижні після внутрішньошлункового введення 3DG n = 6 для кожної групи. Через 2 тижні внутрішньошлункового введення 50 мг/кг 3DG тканини дванадцятипалої кишки та товстої кишки були свіжовиділені від щурів. Репрезентативний вестерн-блот-аналіз експресії білка в дванадцятипалій кишці (a) і товстої кишки (b) тканини, що використовують специфічні антитіла проти TAS1R2, TAS1R3 та TRPM5
Знижені концентрації інсуліну в плазмі та підвищені концентрації глюкагону в плазмі крові у щурів через 2 тижні після внутрішньошлункового введення 3DG
Висновки
Наше дослідження вперше продемонструвало, що 3DG здатний накопичуватися в кишковій тканині і знижувати секрецію GLP-1 та інсуліну подібним чином у щурів після 2-тижневого перорального прийому 3DG. Ми також виявили, що у оброблених 3DG щурів спостерігалася очевидно дисфункція острівцевих клітин підшлункової залози, що є однією з типових характеристик T2DM. Наші дані вказують на можливість того, що зниження біологічної функції GLP-1 внаслідок зменшення секреції GLP-1 внаслідок накопичення кишкової тканини 3DG є найбільш основним механізмом порушення секреції інсуліну, що в кінцевому підсумку сприяло розвитку ІГР. Ці результати дають уявлення про потенційний шлях дії, який пов'язує вживання деяких не засвоюваних дієтичних інгредієнтів та розвиток діабету. Це також сприятиме кращому розумінню значення для відновлення фізіологічної секреції GLP-1 і може призвести до нової стратегії запобігання розвитку переддіабету або зворотних станів IGR.
Внески авторів
Усі автори внесли свій внесок у концепцію та дизайн дослідження та інтерпретацію даних. LZ, XS, LZ, GL, HX, FW, FH та GJ отримали та проаналізували дані. GJ, LZ та XS склали рукопис. GJ та LZ переглянули рукопис на предмет важливого інтелектуального змісту. Усі автори переглянули статтю та затвердили остаточну версію для публікації. GJ відповідає за цілісність твору в цілому. Усі автори прочитали та схвалили остаточний рукопис.
- Накопичення глікогену в жировій тканині пов’язане із пов’язаним із ожирінням запаленням у людей -
- Калорійне обмеження покращує регенерацію кишкових тканин
- Пілотне дослідження впливу зеленого ківі на кишкову ферментацію людини, виміряне
- Роль жирової тканини De Novo в ліпогенезі в гомеостазі глюкози під час наздоганяючого росту діабету
- Анотація P2023 Периваскулярна жирова тканина сприяє розслабленню артеріального стресу Втрата допомоги у