Сіль, альдостерон та паратиреоїдний гормон: яка важливість для пошкодження органів?
Крістіана Катена
Внутрішня медицина, кафедра медицини, Удінський університет, Удіне, Італія
Джан Лука Колуссі
Внутрішня медицина, кафедра медицини, Удінський університет, Удіне, Італія
Габріеле Брозоло
Внутрішня медицина, кафедра медицини, Удінський університет, Удіне, Італія
Ніколь Бертін
Внутрішня медицина, кафедра медицини, Удінський університет, Удіне, Італія
Маріледа Новелло
Внутрішня медицина, кафедра медицини, Удінський університет, Удіне, Італія
Андреа Паломба
Внутрішня медицина, кафедра медицини, Удінський університет, Удіне, Італія
Леонардо А. Сечі
Внутрішня медицина, кафедра медицини, Удінський університет, Удіне, Італія
Анотація
1. Вступ
Артеріальна гіпертензія є найбільш частим фактором ризику серцево-судинної модифікації. NHANES (Національне обстеження здоров’я та харчування) оцінило поширеність гіпертонії серед дорослого населення 30%, і що приблизно 85% людей у віці від 55 до 65 років розвиватимуть гіпертонію протягом усього життя [1]. Оскільки контроль артеріального тиску серед населення є складним завданням, профілактика та лікування гіпертонії шляхом втручання у спосіб життя пацієнтів пропонуються як економічно вигідна стратегія [2–4]. Серед цих втручань зменшення споживання харчової солі може бути корисним для контролю артеріального тиску та профілактики серцевої недостатності [5].
Все більше доказів вказує на те, що, окрім серцево-судинних ефектів, надлишок альдостерону може впливати також на метаболізм мінералів та мати особливе значення для гомеостазу кальцію [13–15]. Оскільки первинний гіперпаратиреоз пов'язаний з поганим серцево-судинним результатом, роль у серцево-судинних захворюваннях також приписується паратиреоїдному гормону (ПТГ) [13–15]. Недавні дослідження продемонстрували взаємну взаємодію між альдостероном та ПТГ, і все більше доказів того, що статус солі може відігравати роль у цій взаємодії. Ця взаємодія між альдостероном і ПТГ може мати клінічну значимість, оскільки може призвести, з одного боку, до серцевих структурних та функціональних змін, що сприяють розвитку та прогресуванню серцевої недостатності, а, з іншого боку, до зниження мінеральної щільності та міцності кісток. У цьому оглядовому огляді ми викладаємо факти, що підтверджують внесок солі та альдостерону у серцево-судинні захворювання та можливі наслідки взаємної взаємодії солі, альдостерону та ПТГ на ураження серця та скелета.
2. Роль солі
Зв'язок між споживанням харчової солі, гіпертонією та серцево-судинними захворюваннями вже давно є предметом важливих епідеміологічних досліджень. Через значні розбіжності між результатами цих досліджень ця асоціація залишається в стадії дискусії [16].
2.1. Харчова сіль і артеріальний тиск
Дієтичне споживання солі давно пов’язане з регуляцією артеріального тиску. Насправді, пацієнти з гіпертонічною хворобою класифікуються як “солестійкі” або “чутливі до солі” залежно від реакції артеріального тиску на пероральне або внутрішньовенне навантаження солі. Сіль розподіляється в позаклітинній рідині і як така бере участь у регуляції артеріального тиску [17]. Вплив солі на артеріальний тиск, однак, можна пояснити зміною позаклітинного об'єму лише частково, і можуть бути задіяні додаткові механізми, включаючи зміни у реакції судин на вазоактивні речовини та взаємодію з різними гормональними системами [18].
2.2. Харчова сіль і пошкодження серця
3. Альдостерон і серце
Орієнтири досліджень перевірили вплив антагоністів альдостерону на пацієнтів із систолічною серцевою недостатністю, які повідомляють про дуже значне зниження смертності порівняно з плацебо [27] та підтверджують думку, що підвищений рівень альдостерону може бути шкідливим для серця. Пізніше дослідження, проведені у пацієнтів з первинним альдостеронізмом, есенціальною гіпертензією та діастолічною серцевою недостатністю, дали додаткові докази того, що підвищений альдостерон у плазмі може мати неприємні серцеві наслідки [28] і може передвіщати початок серцевої недостатності.
3.1. Первинний альдостеронізм
3.2. Основна гіпертонія та діастолічна дисфункція лівого шлуночка
Через значущість гіпертрофії лівого шлуночка та діастолічної дисфункції у пацієнтів з есенціальною гіпертензією можливий внесок циркулюючого альдостерону у ці серцеві зміни було широко досліджено. Перші спостереження показали, що антагоністи альдостерону зменшують масу лівого шлуночка у пацієнтів з есенціальною гіпертензією та гіпертрофією лівого шлуночка [37, 39] та покращують функції міокарда у пацієнтів з гіпертонічною хворобою з діастолічною серцевою недостатністю [40]. Однак дані перерізу, отримані згодом у пацієнтів із гіпертонічною хворобою, які не отримували лікування, вказують на те, що альдостерон у плазмі не має незалежного зв'язку з діастолічними властивостями лівого шлуночка [41]. Послідовно, недавнє дослідження пацієнтів з гіпертонічною хворобою з діастолічною дисфункцією не повідомляло про зміну структури наповнення шлуночків після додавання спіронолактону до попереднього антигіпертензивного лікування, незважаючи на значне зменшення маси шлуночків [42]. Слід врахувати, що відсутність зв'язку між діастолічною дисфункцією лівого шлуночка та рівнем альдостерону в плазмі може бути пов'язана з обмеженням альдостерону в плазмі як мірилом загальної активності мінералокортикоїдів.
У 44 пацієнтів похилого віку із серцевою недостатністю та збереженою фракцією викиду еплеренон покращував діастолічну функцію лівого шлуночка більше, ніж звичайне лікування [43]. У дослідженні хронічної ниркової недостатності в Бірмінгемі (CRIB II) спіронолактон покращував маркери релаксації лівого шлуночка, що свідчить про те, що блокатори альдостерону можуть бути корисними при лікуванні пацієнтів з діастолічною серцевою недостатністю [44], гіпотеза, яка згодом була перевірена у двох важливих дослідженнях. . У дослідженні Aldo-DHF спіронолактон покращував діастолічну функцію лівого шлуночка, але не впливав на максимальну фізичну навантаження у пацієнтів із серцевою недостатністю та збереженою фракцією викиду [45]. Подібним чином, у підгрупі пацієнтів із серцевою недостатністю та збереженою систолічною функцією, включеною до дослідження TOPCAT (лікування збереженої серцевої недостатності з антагоністом альдостерону), спіронолактон суттєво знижував складну серцево-судинну кінцеву точку [46]. Підводячи підсумок, рівень альдостерону в плазмі здається незначним для діастолічної дисфункції лівого шлуночка у пацієнтів з гіпертонічною хворобою, однак використання антагоністів альдостерону в лікуванні серцевої недостатності зі збереженою систолічною функцією на сьогоднішній день дає обнадійливі результати.
4. Внесок солі у пошкодження серця, пов’язані з альдостероном
Гіпотеза про взаємодію між харчовою сіллю та альдостероном у спричиненні пошкодження серця була широко підтверджена результатами досліджень на тваринах [8, 9]. Деякі неприємні наслідки навантаження солі можуть залежати від активації мінералокортикоїдних рецепторів в результаті змін у внутрішньоклітинному окисно-відновному стані [47, 48]. Альдостерон впливає на окисно-відновний потенціал різних типів клітин, збільшуючи генерацію активних форм кисню, і цей ефект посилюється під впливом високої концентрації солі [49]. Отже, неадекватно високий статус солі може спричинити сенсибілізацію мінералокортикоїдних рецепторів та пояснити, чому сіль взаємодіє з альдостероном при індукції пошкодження серця.
5. Взаємодія солі та альдостерону з метаболізмом кальцію
5.1. Відношення до Кістки
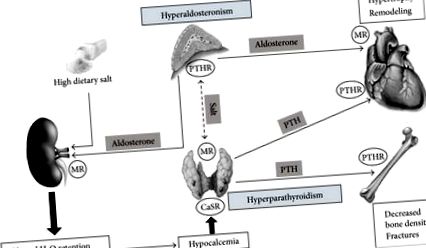
Огляд механізмів, зумовлених взаємодією альдостерону та ПТГ з потенційною роллю солі та відповідним впливом на серце та кістки. МР: мінералокортикоїдний рецептор; PTHR: рецептор паратиреоїдного гормону; CaSR: рецептор, що сприймає кальцій.
На підтвердження тісної взаємодії, яка існує між ПТГ та альдостероном, останні дані свідчать про те, що рецептори ПТГ типу 1 експресуються в аденомах, що продукують альдостерон [63], і пояснює, чому підвищення рівня ПТГ може посилити секрецію альдостерону. З іншого боку, в ядрах паратиреоїдних клітин були виявлені мінералокортикоїдні рецептори, що вказує на можливість того, що альдостерон безпосередньо регулює продукцію ПТГ [63]. У цьому контексті споживання харчової солі може відігравати важливу роль, оскільки неадекватний статус солі спричиняє активацію мінералокортикоїдних рецепторів, що призводить до посилення окисного стресу та сприяє пошкодженню тканин [64]. Також було висловлено припущення, що затримка солі та розширення позаклітинної рідини, спричинені підвищеним циркулюючим альдостероном, можуть зменшити реабсорбцію натрію в дистальних канальцях, що призводить до підвищеної екскреції кальцію з сечею [65].
5.2. Значення для серця
Взаємодія між сіллю, альдостероном і ПТГ отримала надійну підтримку в експериментальних дослідженнях на тваринах. Лікування щурів альдостероном та 1% харчовою сіллю збільшує виведення кальцію з сечею та кишечником, спричинюючи гіпокальціємію та посилену секрецію ПТГ [66]. У цих щурів блокада мінералокортикоїдних рецепторів із застосуванням спіронолактону зменшує втрати кальцію в сечі та фекаліях, відновлюючи нормальний гомеостаз кальцію [67]. Про такий самий ефект спіронолактону повідомляли у пацієнтів із хронічною серцевою недостатністю [68]. Коли здорові суб'єкти піддаються дієтичному надлишку солі, екскреція кальцію з сечею значно збільшується [69], ефект, який є значно виразнішим у пацієнтів з первинним альдостеронізмом, ніж у пацієнтів з есенціальною гіпертензією [70]. З іншого боку, багато досліджень показали, що альдостерон спричиняє втрату кальцію в нирках у здорових суб'єктів при наявності надмірної харчової солі [71], а дані дослідження Штирської гіпертензії вказують, що навіть у пацієнтів з есенціальною гіпертензією взаємодія між альдостероном і кальцієм, а PTH змінюється залежно від споживання харчової солі [13].
6. Висновки
Подяка
Крістіана Катена отримала підтримку від гранту Європейського співробітництва у галузі науково-технічних досліджень (COST-BM1301). Ця робота була підтримана щедрим внеском Фонду П'єр Сілверіо Нассімбені в діяльність Крістіани Катени та Леонардо А. Сечі.
- Перинатальне харчування та гормонально-залежне програмування споживання їжі - Анотація - Дослідження гормонів
- Дослідження Пердю виявляє, що раси по-різному реагують на харчову сіль, кальцій
- Гостра їжа може стримувати тягу до солі Дослідження
- Периферична нейропатія (пошкодження нерва) OncoLink
- Сироїжки, варені, варені, зціджені, без солі Факти харчування та калорії