Орексин: Шляхи до стійкості до ожиріння?
Таммі А. Баттерик
Система охорони здоров'я ветеранів Міннеаполіса, Дослідження 151, One Veterans Drive, Міннеаполіс, Міннесота, США 55417
Чарльз Дж. Біллінгтон
Система охорони здоров'я ветеранів Міннеаполіса, Дослідження 151, One Veterans Drive, Міннеаполіс, Міннесота, США 55417
b Департамент харчової науки та харчування, Університет Міннесоти, 225 Харчові науки та харчування, 1334 Eckles Avenue, Сент-Пол, штат Міннесота, США 55108
c Медичний факультет Медичної школи Університету Міннесоти, Люкс 14-110 Phillips-Wangensteen Bldg, 420 Delaware Street SE, MMC 194, Minneapolis, MN USA 55455
Катерина М. Коц
Система охорони здоров'я ветеранів Міннеаполіса, Дослідження 151, One Veterans Drive, Міннеаполіс, Міннесота, США 55417
b Департамент харчової науки та харчування, Університет Міннесоти, 225 Харчові науки та харчування, 1334 Eckles Avenue, Сент-Пол, штат Міннесота, США 55108
Джошуа П. Ніксон
Система охорони здоров'я ветеранів Міннеаполіса, Дослідження 151, One Veterans Drive, Міннеаполіс, Міннесота, США 55417
b Департамент харчової науки та харчування, Університет Міннесоти, 225 Харчові науки та харчування, 1334 Eckles Avenue, Сент-Пол, штат Міннесота, США 55108
Анотація
Спонтанна фізична активність та орексин
Незважаючи на генетичні впливи та знежирене середовище, схильність до ожиріння у людей та тварин різниться, і деякі особи протистоять ожирінню [1–6]. Стійкість до ожиріння позитивно корелює з підвищеною спонтанною фізичною активністю (СПА), що визначається як усі рухи, не пов'язані з формальними фізичними вправами; SPA сприяє стійкості до ожиріння завдяки збільшенню термогенезу активності без фізичних вправ (NEAT) [Огляд у 7]. Термогенний ефект тонких, але хронічних посилених рухів має важливий вплив на енергетичний баланс, і NEAT суттєво сприяє стійкості до ожиріння [8,5,9,10]. Хоча заслуговують уваги дослідження як на людях, так і на гризунах, продемонстрували, що відмінності в повсякденному житті та схильність до загальних рухів можуть передбачити стійкість до ожиріння [11,12,5,13], основні нервові механізми, що рухають СПА, залишаються відносно невизначеними.
Вважається, що багато областей мозку, нейромедіатори та нейропептиди сприяють SPA та стійкості до ожиріння [14]. Доведено, що нейропептид гіпоталамусу орексин (гіпокретин), який спочатку цікавив енергетичний баланс через його вплив на харчування та збудження, відіграє інтегративну роль в енергетичному балансі та витратах [15,16]. Протягом останнього десятиліття робота в нашій лабораторії та в інших місцях колективно демонструвала важливість орексину у стійкості до ожиріння [17–19,9]. Однак на сьогоднішній день невідомі клітинні сигнальні механізми, за допомогою яких орексин впливає на довго- і короткострокові зміни в СПА. Дані досліджень ішемії та окисного стресу свідчать про те, що передача сигналів орексину може впливати на фактори транскрипції, що беруть участь у стійкості до цих стресових факторів, і що ці шляхи можуть мати критичну участь у впливі орексину на метаболізм. Основною метою цього огляду буде оцінка сигнальних каскадів орексину гіпоталамусу, які потенційно лежать в основі механізмів, завдяки яким орексин надає стійкість до ожиріння.
Стійкість до орексину та ожиріння
Одним з основних висновків, що пояснюють різницю у збільшенні ваги у цій моделі, є те, що АБО тварини виявляють більший SPA, ніж більший контроль за ожирінням [27]. Кілька рядків доказів свідчать, що орексин сприяє фенотипу SPA. Відомо, що ін’єкція орексину A (OXA) у ростральний бічний гіпоталамус (rLH), ядро паравентрикулярної гіпоталамуса, ядро акумулятора або третій шлуночок стимулює SPA як на моногенетичних, так і на полігенетичних моделях гризунів [28–32], а також як на щурах DR, так і на OR демонструють вищу реакцію SPA на орексин, ніж показники контролю ожиріння [19,9]. Непряма калориметрія показує, що окси-індукований SPA призводить до збільшення споживання кисню, вироблення СО2 та термогенезу [29]. Крім того, підвищена чутливість до OXA у щурів АБО частково зумовлена вищими рівнями експресії рецепторів орексину, особливо у rLH [17,9]. Хоча ефекти OXA на SPA можуть виявлятись у кількох конкретних місцях мозку, більша частина нашої роботи, таким чином, зосереджена на rLH.
Дані свідчать, що основні генетичні відмінності сприяють стійкості до ожиріння, що орексин є важливим компонентом цієї мінливості, і що описані вище полігенні моделі гризунів придатні для тестування потенційних орексинових опосередкованих мозкових механізмів стійкості до ожиріння. Робота з цими моделями тварин чітко визначила прямий зв’язок між передачею сигналів орексину та нейромодуляцією СПА; однак клітинні сигнальні шляхи, через які орексин опосередковує SPA та стійкість до ожиріння, все ще залишаються в основному невідомими [9,38]. Ми представляємо тут докази багаторазових досліджень in vitro, включаючи дані нашої постійної роботи та даних інших моделей гризунів, не зосереджених на орексині, щоб окреслити потенційні механізми, за допомогою яких орексин може впливати на стійкість до ожиріння.
Орексини та передача сигналу
Орексини складаються з двох пептидів, OXA та орексину B (OXB; гіпокретин 2); обидва вони отримують шляхом модифікації після перекладу із загального попередника, препро-орексину [39–41]. Експресія препро-орексину в ЦНС, як видається, обмежена підмножиною клітин бічного та перифорнічного гіпоталамуса [40,42], тоді як OXA- та OXB-імунореактивні волокна рясніють як у гіпоталамічній, так і в позагіпоталамічній областях [42– 44]. Пептиди орексину є ендогенними лігандами для двох рецепторів, пов'язаних з G білками, рецепторів орексину 1 та 2 (OX1R та OX2R; відповідно); рецептори орексину широко і диференційовано розподілені по всьому мозку [39,45,46]. Фармакологічні дані підтверджують, що OX1R має вищу селективність щодо OXA, тоді як OX2R пов'язує з подібною спорідненістю до обох орексинів [39]. Хоча, здається, OXB може певною мірою викликати SPA [32], і ми не відкидаємо потенційної ролі OXB у стійкості до ожиріння, але наразі внесок OXB у сприяння витратам енергії незрозумілий. Тому цей огляд зосереджений на OXA; як такий, тут будуть безпосередньо розглянуті лише потенційні механізми передачі сигналу OXA.
Нещодавно було продемонстровано, що OXA активує шляхи активованої мітогеном протеїнкінази (MAPK) [53]. Профілювання сигналів рекомбінантних людських рецепторів OX1R та OX2R продемонструвало, що орексин може активувати позаклітинну рецепторну кіназу 1/2 (ERK1/2) та p38, білкові члени каскаду MAPK [54]. Модель надмірної експресії OX1R у клітинах яєчників китайського хом'ячка показала, що активація орексину ERK1/2 може відбуватися за допомогою PLC/PKC, Ras, Src та PI3K [55]. Дослідження ембріональних клітин нирок людини (HEK-293), трансфікованих людським OX2R, демонструють, що активація ERX1/2 OXA переважно є процесом Gq/11, Gs та Gi, тоді як ініціювання p38 не залежить від активації Gq/11 та Gi [54] . У сукупності ці висновки свідчать про те, що активація субодиниці G-α OX1R та OX2R OXA може регулювати регіонально відмінні та специфічні для тканини реакції на орексин.
Орексинова опосередкована сигналізація та енергетичний баланс
OXA активує MAPK
Можлива роль PGC-1α
OXA активує HIF1α
Хоча конкретна роль PGC-1α у гіпоталамусі та те, як він може сприяти центральному контролю над ожирінням, наразі незрозуміла, дані свідчать про те, що PGC-1α може бути важливою частиною нещодавно описаного зв'язку між OXA та фактором транскрипції індукований гіпоксією фактор 1α (HIF-1α). Нещодавно було показано, що OXA підвищує експресію HIF-1α в тканині гіпоталамусу [70]. Хоча збільшення HIF-1α зазвичай асоціюється з гіпоксією, індукція OXA HIF-1α відбувається в нормальній, негіпоксичній тканині гіпоталамусу [70]. Показано, що OXA є нейропротекторним в корі головного мозку та в культурі клітин гіпоталамусу після окисних стресових факторів [71,38], потенційно завдяки активації HIF-1α. Недавні дослідження показали, що спільно з MAPK PGC-1α є важливим у регулюванні експресії HIF-1α [72,62,73,61]. Як описано вище, ефекти OXA на шляхи MAPK можуть призвести до збільшення PGC-1α. Відомо, що PGC-1α бере участь у регуляції HIF-1α у периферичній тканині [61], і, мабуть, міг би це зробити і в гіпоталамусі.
Кілька рядків доказів припускають, що ефекти OXA на HIF-1α можуть представляти інший зв'язок між орексином та клітинними метаболічними сигнальними шляхами, що стосуються ожиріння. Ми та інші пов'язували OXA з енергетичним метаболізмом, показуючи, що OXA індукує експресію HIF-1α в гіпоталамічній тканині in vitro (рис. 1), і що це призводить до збільшення виробництва АТФ за допомогою окисного фосфорилювання [74,70,38] У окремих дослідженнях на гризунах., миші із специфічною для нейронів втратою інгібітора HIF-1α аспарагінілгідроксилазного фактора (FIH) мали знижену масу тіла та були захищені від збільшення ваги, спричиненого дієтами, що містять жири [75]. Крім того, миші, у яких відсутні функціональні білки HIF-1α та HIF-2α у нейронах дугоподібного ядра пропіомеланокортину (POMC) (миші POMC/HIFβ), погіршують витрати енергії, гіперфагію та збільшують жирову масу [76]. У тому ж дослідженні надмірна експресія HIF-1α у медіобазальному гіпоталамусі призводила до стійкості до ожиріння під час годування HFD. Конкретна роль OXA в цих моделях не була повністю оцінена, але сучасна література свідчить, що ефекти OXA на сигнальні каскади HIF можуть змінити центральні механізми витрати енергії у відповідь на різні метаболічні стресори, такі як дієти з високим вмістом жиру.
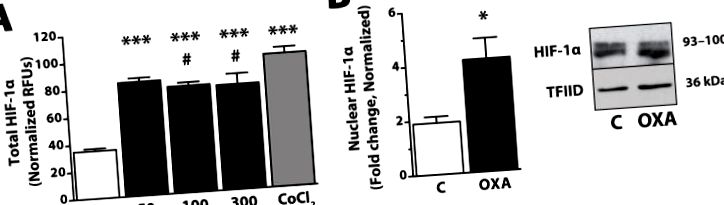
OXA збільшує як загальний, так і ядерний білок HIF-1α протягом 2 год у безсмертній клітинній лінії гіпоталамуса. (A) Рівні білка визначали за допомогою клітинного аналізу ELISA (R&D Systems, Міннеаполіс, Міннесота США) після лікування OXA (Phoenix Pharmaceuticals, Burlingame, CA USA; 50, 100 або 300 нМ) або позитивного контролю CoCl2 (Sigma, St. Луї, Міссурі, США; 150 мкМ). Коротко, інтактні клітини фіксували 4% формаліном після обробки OXA, інкубували з первинним антитілом (анти-HIF-1α або анти-цитохром-С), а потім вторинним антитілом (кожне з яких містило два різних чітко мічених кон'югати). Клітини аналізували шляхом зчитування відносних флуоресцентних одиниць (RFU) для кожного вторинного антитіла. Значення, нормалізовані до домашнього білка цитохрому-С; n = 3–6/група; *** p Рисунок 2, поточні дані з безлічі незалежних моделей in vitro та гризунів підтверджують гіпотезу про те, що опосередковані OXA збільшення витрат енергії, а отже, властивості орексину до стійкості до ожиріння можуть частково залежати від сигнальних каскадів із залученням MAPK, PGC- 1α та HIF-1α. У сукупності ці незалежні докази підтверджують ідею, що дії OXA на чуйні нейрони викликають плейотропні ефекти на експресію генів та шляхи другого месенджера, важливі для регуляції внутрішньоклітинного метаболізму нейронів, що в кінцевому рахунку проявляється у підвищеній стійкості до SPA та ожиріння. Подальше дослідження участі орексину в описаних тут сигнальних шляхах дасть уявлення про механізми, що впливають на метаболічний статус нейронів, що реагують на OXA, і з’ясує, як це врешті-решт впливає на витрати енергії та схильність до ожиріння.
Схематичне зображення гіпотетичних сигнальних шляхів орексину. Орексини A і B (OXA, OXB) діють на орексинові рецептори 1 і 2 (OX1R, OX2R). Відомо, що орексин збільшує активацію (фосфорилювання) MAP-кіназ ERK1/2 та p38 MAPK. Здається, ця активація в основному опосередковується сигналізацією Gq/11, але Gs/Go може бути більш важливою для OX2R. Як OXA, так і p38 MAPK можуть збільшити активацію та експресію HIF-1α; механізм може реагувати на транскрипційний коактиватор PGC-1α. PGC-1α функціонує як прямий зв’язок між зовнішніми фізіологічними подразниками та регуляцією біогенезу мітохондрій та є ключовим фактором, що сприяє виробленню АТФ. PGC-1α активується p38 MAPK і є відомим регулятором експресії HIF-1α в периферичній тканині. Збільшення HIF-1α призводить до змін експресії генів, що призводить до посиленого окисного фосфорилювання та зменшення перекисного окислення ліпідів.
Подяка
Автори отримали підтримку від Департаменту досліджень та розвитку реабілітації у справах ветеранів США, гранту BX001686 та R01 DK078985.
- Інгібітор активатора плазміногену-1, запалення, ожиріння, інсулінорезистентність та судинний ризик -
- Зменшення ожиріння
- Опір пацієнтів при розладах харчування Психіатричні часи
- Роль ниркової мікроциркуляції при прогресуванні хронічної травми нирок при ожирінні - FullText -
- Периваскулярний жир та значення мікроциркуляції для резистентності до інсуліну, діабету та