Роль мікробіома в утворенні каменів у нирках
Мансі Мехта
Нефрологічний відділ, Медичний факультет Нью-Йоркського університету, Нью-Йорк, Нью-Йорк, США
Девід С. Голдфарб
Нефрологічний відділ, Медичний факультет Нью-Йоркського університету, Нью-Йорк, Нью-Йорк, США
b Система охорони здоров'я Нью-Йоркської гавані, Нью-Йорк, Нью-Йорк, США
Лама Наццал
Нефрологічний відділ, Медичний факультет Нью-Йоркського університету, Нью-Йорк, Нью-Йорк, США
Анотація
Нефролітіаз - це складна хвороба із поширеністю у всьому світі, на яку впливають як генетичні фактори, так і фактори навколишнього середовища. Близько 75% каменів у нирках переважно складаються з оксалату кальцію, а оксалат сечі вважається вирішальним фактором ризику. Мікроорганізми можуть відігравати роль у патогенезі та профілактиці сечокам'яної хвороби, і участь мікробіома в кишечнику в цій хворобі нирок є останнім часом цікавим. Oxalobacter formigenes - це грамнегативні бактерії, які розкладають оксалат у кишечнику, зменшуючи екскрецію оксалату з сечею. У цьому огляді ми розглядаємо дані, що вивчають роль Oxalobacter formigenes у сечокам’яній хворобі у людей та тварин, вплив антибіотиків на його колонізацію та потенційну роль пробіотиків та цілих мікробних спільнот як терапевтичних втручань.
1. Вступ
Нефролітіаз - це складне захворювання, на яке впливають генетичні та екологічні фактори. Подвійні дослідження виявили 56% ризику успадкування каменів, тоді як інші фактори, що стосуються цього питання, включають дієту, фізичні вправи, робоче середовище та географію [1]. В останні роки досліджена роль кишкового мікробіома у впливі на склад сечі, в результаті чого отримано дані, що свідчать про те, що він впливає на частоту каменів у нирках. Тут ми розглянемо докази, що підтверджують цю гіпотезу. Тут не розглядається добре описана роль інфекцій сечовивідних шляхів видами Proteus та іншими організмами, що продукують уреазу, пов’язаними з утворенням струвітних каменів.
Величезна кількість мікроорганізмів, які колонізують людський організм і утворюють складні спільноти, називають мікробіомами. Функціонально він взаємодіє з клітинами людини-господаря і виконує різні біологічні процеси. Зростає занепокоєння тим, що «західна» дієта та спосіб життя змінили генетичний склад та метаболічну активність мікробіому кишечника. Наслідки цих змін у популяціях бактерій були пов'язані зі збільшенням частоти захворювань, таких як ожиріння, ішемічна хвороба судин, алергія та метаболічний синдром [2]. Ці ефекти роблять можливим можливість того, що мікробіом кишечника також впливає на всмоктування та секрецію розчинених речовин, що мають значення для утворення каменів у нирках.
На сьогоднішній день порівняно мало відомо про загальну роль мікробіома кишечника в патофізіології нефролітіазу. Нещодавнє дослідження виявило чіткі відмінності у мікробіомі кишечника хворих на камені в нирках порівняно з пацієнтами без каменів [3]. Зразки калу та сечі, зібрані у обох груп пацієнтів, виявили 178 родів, з яких п’ять найбільш поширених ентеротипів, або окремі бактеріальні спільноти, у кожній групі складали понад 50% від виявленого кількості бактерій. Рід Prevotella був найбільш поширеним у контрольній групі, тоді як рід Bacteroides був найбільш поширеним у групі каменів у нирках. Еубактерія обернено корелювала з рівнем оксалату, а ешерихія - з цитратами. Невідомо, чи ці відмінності в кількості бактерій, що спостерігаються у каменеутворювачах та засобах контролю, є причинними у процесі утворення каменів або вторинними щодо інших змінних, таких як вплив антибіотиків чи дієта. Такі широкі характеристики мікробіома потребуватимуть більш широких досліджень, щоб зв’язати їх із конкретними розчиненими речовинами, що утворюють камені в нирках, та конкретними агентами, що впливають на процес кристалізації.
2. Oxalobacter formigenes
2.1. Генетичні та мікробіологічні характеристики
Відкриття в 1985 р. Елісоном та його колегами бактерії, що руйнує оксалат, Oxalobacter formigenes (Oxf) привернуло значну увагу щодо її участі у кам'яно-кам'яній хворобі оксалату [4]. Клінічні дані свідчать про те, що існує прямий зв’язок між відсутністю організму та гіпероксалурією та утворенням оксалатних каменів. Oxf - це грамнегативна, облігатна анаеробна бактерія, яка є частиною нормальної бактеріальної флори в товстому кишечнику людини та інших видів ссавців. Він унікальний тим, що потребує оксалату як як джерела вуглецю, так і для утворення АТФ, який він знаходить у просвіті кишечника [5]. Його виявили в кишечнику людей, гризунів, собак, свиней та великої рогатої худоби. Якщо він присутній, він може погіршити поглинаний оксалат і зменшити всмоктування кишечника, а також стимулювати секрецію оксалату з товстої кишки, забезпечуючи захист від гіпероксалурії.
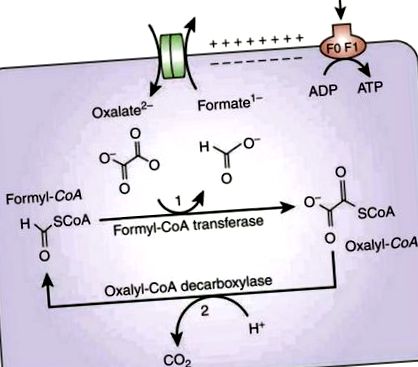
Метаболізм оксалатів Oxf вимагає поглинання позаклітинного оксалату в обмін на форміат мембранним транспортером, який називається OxlT, кодованим геном oxIT (див. Рис. 1). Ген frc кодує трансформазу формил КоА, Frc, яка активує оксалат, додаючи молекулу коферменту А з утворенням оксаліл-КоА. Потім оксаліл-КоА декарбоксилюється до СО2 та форміату, а останній потім використовується оксилТ для поглинання більше оксалату. Реакція декарбоксилювання каталізується ферментом оксаліл-КоА-декарбоксилазою, кодованим геном oxc [6]. Внутрішній градієнт для результатів протонів, що стимулює вироблення АТФ.
Метаболізм оксалату за допомогою Oxf [6]. Відтворено з дозволу.
Хоча вважається, що O. formigenes є найефективнішим деградатором оксалатів, роль інших мікробіоти, що руйнує оксалат, в кишечнику людини не з’ясована до кінця. Багато бактеріальних видів мають як oxc, так і frc і демонструють оксалаторуйнуючу активність in vitro [7]. Нещодавно Hatch et al. продемонстрували, що колонізація Bifidobacterium lactis зменшує оксалат сечі шляхом розкладання дієтичного оксалату та зменшення його кишкової абсорбції на мишачій моделі [8]. У дослідженні південноафриканських чоловіків були виявлені види Lactobacillus з високою здатністю до розкладання оксалатів та пов'язані з меншою поширеністю оксалатно-кальцієвих каменів у нирках [9].
Порівняння профілів клітинних жирних кислот 17 штамів Oxf розділило ці штами на дві основні групи, в даний час позначені як Група 1 (наприклад, штам OXCC13) та Група 2 (наприклад, штам HOxBLS). Послідовність геномів цих 2 штамів у рамках проекту “Мікробіом людини” дало можливість розширити наше розуміння важливих біологічних властивостей організму [10]. Додатковий протеомічний аналіз Oxf у культурах логарифмічних та стаціонарних фаз росту дозволив виявити специфічні білки, важливі для його росту та виживання [11].
Розробка методу виявлення на основі ПЛР, специфічного для генів oxc та/або frc в Oxf, дозволила вивчити роль цього організму в метаболізмі оксалатів. Швидке виявлення Oxf у культурах калу та зразках свіжого стільця можливо з високим ступенем чутливості та специфічності [12]. Вимірювання здатності кишечника до руйнування оксалатів є ще одним способом непрямого визначення присутності або відсутності та активності організму [13].
Дослідження повідомляють про значну різницю в ступені, в якій Oxf колонізує нормальну кишку людини. Рівень бактерії може бути не виявлений, або він може містити 10 7 на грам калу. Рівні Oxf у зразках калу зросли приблизно в 10 разів із 10-кратним збільшенням дієтичного оксалату. Навпаки, чисельність організму зменшувалась із збільшенням споживання кальцію, який зв’язував би оксалат і зменшував його доступність [14].
Нещодавно ми описали поширеність, відносну кількість та стабільність Oxf у мікробіомі кишечника людини, як виявили дані проекту Human Microbiome Project (HMP) [15]. Зразки калу у 242 здорових молодих дорослих аналізували з використанням послідовності цілком геномної рушниці (WGS) та секвенування рРНК V13 або V35 16S. Аналіз набору даних WGS показав, що 29 (31%) з 94 суб'єктів були Oxf-позитивними, тоді як аналіз даних V13 та V35 показав поширеність Oxf на рівні 15% (22/155) та 11% (23/210). Таким чином, виявлення Oxf дослідниками HMP дуже залежало від використовуваних методів: WGS був більш чутливим, ніж секвенування 16S рРНК. Ми виявили, що всі 29 Oxf-позитивних суб'єктів під час аналізу WGS були колонізовані штамом OXCC13. Однак із цих 29 59% були одночасно колонізовані штамом HOxBLS. Таким чином, спільна колонізація з обома штамами була загальним явищем. Не встановлено, чи мають два штами різне клінічне значення.
3. Людські дослідження
3.1. Поширеність O. formigenes у людей
Великий відсоток населення колонізований Oxf. У дорослих американців рівень колонізації Oxf, за оцінками, коливається між 38 і 62%, проте у всьому світі рівень колонізації вищий у популяцій з обмеженим впливом антибіотиків. Наприклад, в Індії повідомлялося про поширеність близько 60%; у Кореї поширеність становила 77% [16,17]. Низькі показники колонізації Oxf були зафіксовані в ряді патологічних станів, включаючи запальні захворювання кишечника, рецидивуючий нефролітіаз, патологічне ожиріння, муковісцидоз та ідіопатичний нефролітіаз кальцію, всі вони пов'язані з оксалатними каменями (табл. 1).
Таблиця 1
Повідомляється про рівень колонізації Oxf у різних дорослих популяцій.
| Індія | Звичайний | 48 | 56 |
| Запальна хвороба кишечника | 48 | 10 | |
| США | Звичайний | 26 | 62 |
| Запальна хвороба кишечника | 16 | 9 | |
| США | Звичайний | 259 | 38 |
| Періодичні формувачі каменю CaOx | 247 | 17 | |
| Німеччина | Звичайний | 61 | 69 |
| Каменоутворювачі CaOx | 145 | 43 | |
| Корея | Звичайний | 233 | 77 |
| Каменоутворювачі CaOx | 103 | 46 |
Колонізація Oxf була досліджена в поперечному дослідженні, що обстежує дітей з України [18]. Ця популяція була обрана через обмежений доступ до рутинного вживання антибіотиків протягом дитинства. Не вдалося виявити організм у немовлят віком до 6–9 місяців, і він почав з’являтися в кишкових шляхах дітей приблизно до 1 року. До 3–4-річного віку всі діти продемонстрували колонізацію, кількість колонізованих дітей зменшувалася у віці від 8 до 12 років. Інша група пацієнтів, що становлять особливий інтерес, - це хворі на муковісцидоз (МВ), які, як відомо, мають підвищену поширеність каменів у нирках. Пацієнти з МВ мають багаторазові курси антибіотиків внаслідок їх підвищеної сприйнятливості до легеневих інфекцій. У дослідженні екскреції оксалатів із сечею у пацієнтів з МВ, 71% з 21 пацієнта, що не контролювали CF, були колонізовані Oxf порівняно з лише 16% з 43 пацієнтів з CF [19]. Усі 7 пацієнтів з МВ, колонізованою бактерією, мали нормальну екскрецію оксалату з сечею, тоді як 53% з 36 пацієнтів, які не були колонізованими, мали гіпероксалурію, що підтверджує гіпотезу про наявність організму, захищеного від гіпероксалурії.
3.2. Асоціація O. formigenes та камені в нирках
Існує безліч епідеміологічних досліджень, які вказують на захисну роль Oxf. Дослідження на людях також показали сильний зворотний зв'язок між колонізацією Oxf та рецидивуючими оксалат кальцію в нирках. У контрольному дослідженні 247 пацієнтів з рецидивуючими епізодами каменів оксалату кальцію та 259 пацієнтів без каменів із урахуванням віку, статі та регіону було виявлено сильну зворотну зв'язок між колонізацією Oxf та рецидивуючими оксалат-каменями із зниженням ризику на 70% [20] . Серед суб’єктів контролю спостерігалось збільшення поширеності Oxf із збільшенням споживання оксалатів; зворотне спостерігалося при застосуванні антибіотиків. Цілодобові збори сечі виявили сильну тенденцію до ризику утворення каменів із збільшенням екскреції оксалатів із сечею. Однак не було різниці в середній екскреції оксалату з сечею у пацієнтів, які мали позитивний чи негативний результат на Oxf.
Ключовим питанням без відповіді є те, чи відсутність Oxf збільшує ризик утворення каменів оксалату кальцію за рахунок збільшення виведення оксалатів із сечею. За контрольованої та стандартизованої дієти, виявлено, що екскреція оксалату з сечею є нижчою у пацієнтів із Oxf-позитивом, ніж у пацієнтів із негативним вмістом Oxf [21]. Результати контрольованого дієтою дослідження у 22 пацієнтів, що не утворюють камені, які були природним чином колонізовані або не колонізовані Oxf, свідчать про те, що на різницю в екскреції оксалатів із сечею можуть впливати відмінності в споживанні кальцію та оксалатів у їжі [14].
Дункан та співавт. показали, що пероральний прийом одноразової дози Oxf з подальшим дієтичним навантаженням оксалатів призводить до зменшення екскреції оксалату з сечею, відновлення оксалаторудливої активності з калом та тривалої колонізації у 3 з 3 учасників. У рандомізованому багатоцентровому дослідженні пацієнтів з первинною гіпероксалурією не вдалося продемонструвати чіткого ефекту лікування Oxf для зменшення екскреції оксалатів із сечею. Доза та життєздатність введеного бактеріального лікування були поставлені під сумнів, хоча результати дійсно свідчать про ефект лікування, коли оксалат сечі нормалізувався на рівень креатиніну [22].
3.3. Антибіотичний ефект на O. formigenes у людей та мишей
В іншому дослідженні вивчався ефект імпульсів антибіотиків на додаток до дієтичних модифікацій на мишах, щоб зрозуміти наслідки фізіологічних збурень [24]. При імпульсному лікуванні антибіотиками (PAT) на моделі мишей раннього віку мишей поділяли на 3 групи. Контрольна група не отримувала антибіотиків, тоді як інші два отримували 3 імпульси тилозину (макроліду) або амоксициліну. Щоб побачити вплив моделі PAT на деградацію оксалатів, з часом вимірювали середню відносну кількість кожного з трьох генів, що беруть участь в метаболізмі оксалатів. Oxc, frc та oxlT не були специфічними для Oxf, але могли походити від інших бактерій, що руйнують оксалати. Рис. 2 показує, що імпульси антибіотиків та дієтичні модифікації спричинили значні зміни у відносному достатку експресії генів oxc, frc та oxlT під час розвитку; однак напрямок змін не був рівномірним. Це може свідчити про диференційний вплив цих змінних на оксалатодеградуючі бактерії, включаючи Oxf.
- Зв'язок між кам'яною хворобою та ожирінням у Йорданії Абу-Газале, Лос-Анджелес, Будайр Z - Саудівська Республіка Нирки
- Дієта на каменях у нирках Не така обмежувальна, як ви можете подумати - Балтимор Сонце
- Urocit-K (цитрат калію), лікування каменів у нирках
- Придушення утворення сечової кислоти з дієтичної нуклеїнової кислоти алопуринолом Американський журнал
- Лікар розповів про роль часнику та імбиру у зміцненні імунітету News News