Роль адипоциту XBP1 у метаболічній регуляції під час лактації
Маргарет Ф. Грегор
1 Відділи генетики та складних захворювань та харчування, а також Інститут широкого загалу Гарварда та Массачусетського технологічного університету, Гарвардська школа охорони здоров'я, Бостон, Массачусетс 02115 США
Емілі С. Міш
1 Відділи генетики та складних захворювань та харчування, а також Інститут широкого загалу Гарварда та Массачусетського технологічного університету, Гарвардська школа охорони здоров'я, Бостон, Массачусетс 02115 США
Лінг Ян
1 Відділи генетики та складних захворювань та харчування, а також Інститут широкого загалу Гарварда та Массачусетського технологічного університету, Гарвардська школа громадського здоров'я, Бостон, Массачусетс 02115 США
Сара Гуммасті
1 Відділи генетики та складних захворювань та харчування, а також Інститут широкого загалу Гарварда та Массачусетського технологічного університету, Гарвардська школа охорони здоров'я, Бостон, Массачусетс 02115 США
Карен Е. Інує
1 Відділи генетики та складних захворювань та харчування, а також Інститут широкого загалу Гарварда та Массачусетського технологічного університету, Гарвардська школа охорони здоров'я, Бостон, Массачусетс 02115 США
Енн-Хві Лі
2 Кафедра патології та лабораторної медицини, Медичний коледж Weill Cornell, Нью-Йорк, Нью-Йорк, 10065 США
Брайан Бірі
3 Інститут біомедичних досліджень Уайтхеда, Кембридж, Массачусетс 02142 США
Гьокхан С. Готаміслігіл
1 Відділи генетики та складних захворювань та харчування, а також Інститут широкого загалу Гарварда та Массачусетського технологічного університету, Гарвардська школа охорони здоров'я, Бостон, Массачусетс 02115 США
Пов’язані дані
Резюме
Адипоцит займає центральне місце в метаболізмі організму та виявляє значну функціональну та морфологічну пластичність під час свого формування та тривалості життя. Чудові трансформації цього органу відбуваються під час ожиріння та лактації - двох метаболічних процесів, де краще розуміння функції адипоцитів є важливим. Розглядаючи критичну важливість клітинного ендоплазматичного ретикулума органел (ER) у адаптації до коливань синтетичних процесів, ми дослідили роль XBP1, центрального регулятора адаптивних реакцій ER, у формуванні та функціонуванні адипоцитів. Несподівано делеція адипоцитів-XBP1 in vivo у мишей (XBP1 ΔAd) не вплинула на формування адипоцитів або системний гомеостатичний метаболізм на регулярній дієті або високожирній дієті. Однак під час лактації дамби XBP1 ΔAd виявляли підвищену ожиріння, зменшували виробництво молока та зменшували ріст посліду порівняно з контрольними дамбами. Більше того, ми демонструємо, що XBP1 регулюється під час лактації, коли він реагує на пролактин, змінюючи експресію ліпогенних генів. Ці результати демонструють невизнану раніше роль адипоциту-XBP1 у регуляції лактаційного метаболізму.
Вступ
Жирова клітина, або адипоцит, є центральним регулятором метаболізму, який зберігається в організмах від мух до людини. В основі функції адипоцитів лежить його здатність накопичувати та вивільняти ліпіди в потоці відповідно до енергетичних потреб організму. Таким чином, життя адипоцита охоплює багато екстремальних коливань ємності для зберігання ліпідів, починаючи з розвитку преадипоцита у зрілий адипоцит, а потім продовжуючи реагувати на метаболічні сигнали. Наприклад, адипоцит повинен виснажувати свій запас ліпідів в умовах дефіциту поживних речовин або високої енергії, таких як голодування або лактація, або збільшувати запаси ліпідів у багатих поживними речовинами умовах, включаючи ожиріння (Attie and Scherer, 2009).
Ми виявили, що генетична делеція адипоциту XBP1, на відміну від очікувань, не впливала на формування та функціонування жирової тканини в умовах гомеостатичного метаболізму. Однак ми повідомляємо про непередбачувану роль XBP1 у регуляції функції жирової тканини під час гомеоретичного або спрямованого метаболізму лактації.
Результати
Делеція in vivo адипоциту XBP1
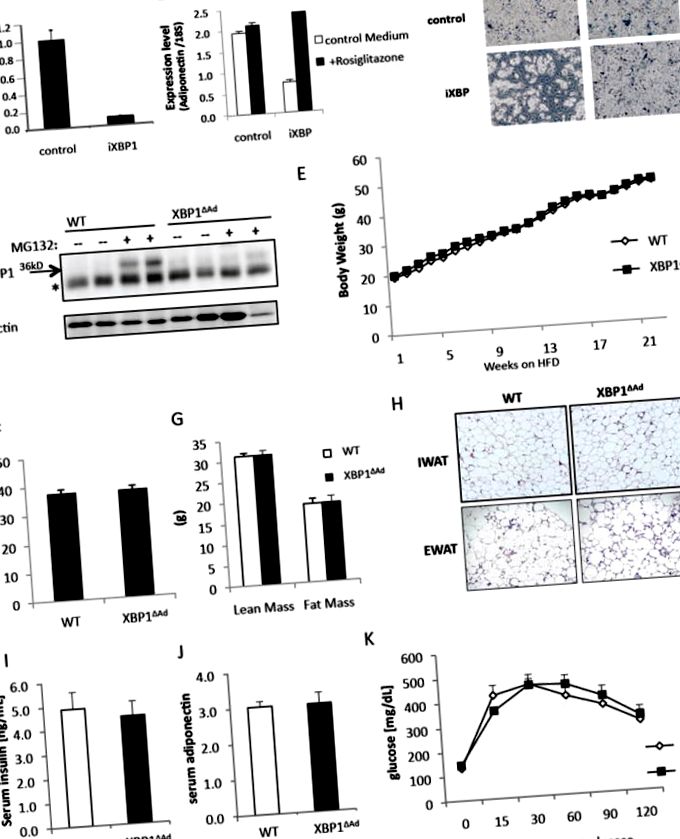
(A-C) Лентивірусна супресія мРНК XBP1 у преадипоцитах 3T3L1. (A) Рівні мРНК Xbp1 вимірювали за допомогою кількісної RT-PCR (QPCR) у реальному часі. Преадипоцити, що несуть контроль або XBP1 shRNA (iXBP1), були індуковані диференціюватися з розиглітазоном або без нього (10 мкМ). (Б) На 8-й день диференціації вимірювали рівні мРНК гена Адіпонектину за допомогою QPCR та знімали яскраво-фазові мікроскопічні зображення. (D) Рівні білка XBP1 у жирових експлантатах від мишей WT та XBP1 ΔAd після обробки інгібітором протеази MG132 (25 мкМ) або без нього протягом 20 годин для стабілізації білка XBP1. Білкові екстракти досліджували за допомогою XBP1 або антитіл до актину (Санта-Крус). * позначає неспецифічну смугу. (E-K) проводили з самцями мишей (n = 7-12) на дієті з високим вмістом жиру (HFD). (E) Маса тіла мишей WT та XBP1 ΔAd з часом на HFD. (F) Відсоток жиру, (G) нежирна маса та жирова маса мишей WT та XBP1 ΔAd (n = 5-11), виміряні за допомогою аналізу DEXA. (H) Фарбування гематоксиліном та еозином (H&E) зрізів жирової тканини від мишей WT та XBP1 ΔAd (збільшення 100x). Пахова або епідидимальна біла жирова тканина (IWAT або EWAT). (I) сироватковий рівень інсуліну та (J) адипонектину у мишей WT та XBP1 ΔAd (n = 5,6). (К) Тест на толерантність до глюкози, проведений через 16 тижнів на ВЧ із (ін’єкцією 1,0 г/кг глюкози, n = 6). Усі рядки помилок позначають +/- SEM. Див. Також Рисунок S1.
XBP1 регулюється під час лактації в адипоцитах
Далі ми протестували ще один екстремальний стан перетворення адипоцитів: лактацію. Протягом вагітності маса тіла матері зростає, і після пологів починається лактація, а запаси ліпідів жирової тканини використовуються як компоненти або енергія для виробництва молока. Для того, щоб досягти такого розподілу поживних речовин, адипоцити зазнають значної трансформації, що включає сильне виснаження ліпідів та придушення поглинання глюкози та ліпідів. Хоча це явище спостерігалося морфологічно (Elias et al., 1973), мало відомо про функціональну роль адипоцита під час лактації або будь-яких молекулярних медіаторів, що беруть участь у цьому процесі.
Однак під час лактації маса жирової тканини суттєво збільшилася у дамбах XBP1 ΔAd, тоді як у дамках WT вона залишалася низькою порівняно з невагітними мишами (рис. 2D, Е). Ми також спостерігали збільшення рівня інсуліну та лептину в сироватці крові, а також тенденцію до збільшення загальної маси тіла у дамбах XBP1 ΔAd, що знову ж свідчить про збільшення ожиріння (рис. 2F, S2I). Вражає те, що підстилки від дамб XBP1 ΔAd набирають меншої ваги під час лактації, ніж дамби дамб WT (рис. 2G). Тоді було критично важливо дослідити, чи генотип матері та плоду був рушієм цього фенотипу та чи змогли дамби WT врятувати цей ефект. Для цього ми провели перехресні експерименти. Вигодовування щенят XBP1 ΔAd дамами WT повністю врятувало фенотип щенят, і навпаки, щенята WT, які годували дамами XBP1 ΔAd, продемонстрували значне зменшення маси тіла під час лактації (рис. 2H). Ці експерименти продемонстрували, що вплив на вагу щенят був результатом генотипу матері під час лактації та не був результатом внутрішньоутробного ефекту. У сукупності ці результати вказують на те, що лактаційні дамби XBP1 ΔAd містять збільшені запаси ліпідів жирової тканини, а недостатня кількість поживних речовин надходить до цуценят під час лактації.
Внесок XBP1 у ефективність лактації є специфічним для адипоцитів
Далі ми проаналізували вагу тканин, а також застосували техніку фарбування цілого кріплення для візуалізації розвитку епітелію молочної залози та альвеол під час лактації. У цих експериментах ми не спостерігали жодних відмінностей у масі тканини, морфології чи ступені розвитку у залозах XBP1 ΔAd порівняно з контролем WT (рис. 3E, F). Поперечні зрізи тканин, забарвлених H&E, також показали подібний розвиток молочної залози між тканинами WT та XBP1 ΔAd (рис. S3C). Ми також не спостерігали жодних великих крапель цитоплазматичного ліпіду, помітних в альвеолярному епітелії, які вказували б на секреторний дефект. Нарешті, як маркер дії пролактину, ми вимірювали передачу сигналів Stat5 у тканинах молочної залози в період лактації від мишей WT та XBP1 ΔAd і не спостерігали значних відмінностей між генотипами (рис. S3D, E). Отже, отримані на сьогодні дані свідчать про нормальну функцію молочних залоз у дамбах XBP1 ΔAd.
Підсумовуючи, результати, отримані при дослідженні тканин, дослідженнях ex vivo та на безлічі незалежних тканин-специфічних моделей делеції in vivo, демонструють, що делеція XBP1 в адипоциті є причинною маніпуляцією, яка виробляє порушений лактаційний метаболізм.
Аналіз складу та кількості молока в дамбах XBP1 ΔAd
Обговорення
Зниження ваги щенят від дефекту лактації пов’язане з низьким рівнем тригліцеридів або підвищеною в’язкістю молока, що ускладнює його виділення (Schwertfeger et al., 2003; Zhu et al., 2005). Інші повідомляють про подібний склад, але зменшення обсягу молока, що пояснюється зниженням ліпогенної активності молочних залоз (Boxer et al., 2006; Rudolph et al., 2010). Ми не бачили жодних змін у складі молока чи доказів зниження ліпогенної активності в молочній залозі, але подальше дослідження цих аспектів може бути плідним. Тому ми припускаємо, що функція молочної залози може бути незмінною у мишей XBP1 ΔAd і що сигнали жирової тканини потрібні для підтримки не цілісності розвитку чи функціональної функції, а рівня продукування молока. Цікаво, що в сироватці крові дамб XBP1 ΔAd під час лактації підвищуються два гормональні сигнали - інсулін та лептин, які також посилюються у жінок із ожирінням. Тому варто дослідити вплив гормонального середовища матері на вироблення молока. Можливо також, що інші дії XBP1, такі як синтез та секреція невідомого медіатора на молочну залозу або імунологічна відповідь, можуть бути залучені до впливу функції адипоцитів під час лактації.
Таким чином, ми пропонуємо, щоб ця робота відкрила новий контекст для вивчення функції адіпоцитів та біології, а також УПО, враховуючи, що більшість досліджень, що стосуються адипоцитів, були зосереджені на метаболічному гомеостазі. Тут ми розкриваємо вплив адипоцитів на спрямований або гомеоретичний метаболізм лактації, і передбачаємо, що майбутні дослідження виявлять подальші основні функції адипоцитів у цьому життєво важливому процесі раннього росту та виживання ссавців.
Експериментальні процедури
Вироблення та розведення мишей XBP1 ΔAd
Мишей C57BL/6, що містять місця loxP навколо екзону 2 XBP1 (Lee et al., 2008), схрещували з мишами, які несли ген рекомбінази Cre під промоторами aP2, адипонектином або LysM, усі три генетичного фону C57BL/6. Стратегії розведення дотримувались таким чином, щоб контрольні (XBP1 flox/flox-no Cre) та експериментальні миші (XBP1flox/flox-Cre) завжди були однолітками. Самки мишей, які використовувались для досліджень вагітності та лактації, походили від схрещувань самок флокс/флокс-но-Cre на самців флокс/флокс Cre і годували їх стандартною племінною чау (PicoLabs, Mouse Diet 20). У всіх експериментах кількість щенят з послідів WT та XBP1 ΔAd було подібним. Інституційний комітет з догляду за тваринами та використання Гарвардської школи охорони здоров'я схвалив усі дослідження.
Мікродісекція лазерного захоплення
Заморожені ділянки тканин молочної залози товщиною 5 мкм з першого дня лактації фарбували H&E за 20 хвилин до мікродисекції лазерного захоплення (LCM). LCM проводили в Спеціалізованому ядрі гістопатології в онкологічному центрі Дани-Фарбер/Гарвард у Бостоні, Массачусетс, використовуючи інструмент Arcturus PixCell II разом із макроскопами CapSure (Молекулярні пристрої). Для кожної тварини один слайд із двох послідовних зрізів захоплювали протягом 50-60 хвилин при розмірі лазерного променя 7,5 мкм потужністю 50 мВт. Виділення РНК ізольованих клітин проводили за допомогою набору для виділення РНК PicoPure (Molecular Devices), і кДНК синтезували із загальної виділеної РНК (Fermentas). Рівні видаленої (праймери, специфічні для екзону 2) та загальної (праймери, не в екзоні 2) мРНК Xbp1 оцінювали кількісною RT-PCR.
Підготовка цілих кріплень молочної залози
Препарати молочних залоз цілком проводили відповідно до протоколу, знайденого на веб-сайті NIH Biology of Mammary Gland (http://mammary.nih.gov/tools/histological/Histology/index.html). Коротко, пахові №4 молочних залоз розсікали, розподіляли на предметне скло і фіксували на ніч у фіксаторі Карноя. Наступного дня тканини зволожували, а потім забарвлювали протягом доби на кармін-алюмінієву пляму. Тканини зневоднювали, очищали ксилолом і встановлювали між двома предметними стеклами за допомогою кріпильних середовищ Permount.
Культура клітин адипоцитів
Преадипоцити 3T3L1 та F442A підтримували в DMEM з додаванням 10% сироватки бичачого теляти. Для індукування диференціації клітини 3T3L1 вирощували до місця злиття і годували індукційним середовищем (DMEM, 10% сироватка Cosmic Calf, 5 мкг/мл інсуліну, 0,5 мМ IBMX, 1 мкМ дексаметазону, з 10 мкМ розиглітазону або без нього). Через два дні середовище змінили на DMEM, 10% CCS і 5 мкг/мл інсуліну. Клітини F442A диференціювали лише в середовищі DMEM-CCS-інсулін. Адипоцити вважалися повністю диференційованими на 8 день.
КТ-візуалізація
Мишей під час лактації 12 днів знеболювали та сканували за допомогою сканера GE explore CT 120 Micro-CT. Збір даних та реконструкція жирової тканини проводилися за допомогою програмного забезпечення Osirix.
Збір та аналіз молока
Після вилучення щенят на ніч, щоб полегшити накопичення молока, мишей знеболювали на 12 день лактації. Молоко збирали м’якою ручною стимуляцією сосків. Лактозу вимірювали відповідно до інструкцій набору (Abcam), а загальний білок вимірювали за допомогою аналізу білків постійного струму (Bio-Rad). Екстракцію ліпідів проводили на 5 мкл зразка молока та тригліцеридів, а вміст вільних жирних кислот визначали за допомогою діагностичних аналізів Sigma та WAKO відповідно. Поглиблений аналіз ліпідоміки проводили, як описано (Cao et al., 2008) компанією Lipomics Inc.
Кількість молока
Кількісне вироблення молока проводили, як описано раніше (Jara-Almonte and White, 1972). Коротко, 10-денних цуценят вилучили з дамб і постили 6 годин. Потім цуценят повертали на дамби на 1,5 години, а підстилку брали до (після швидкого прийому) та після доїння. Різниця у вазі посліду являє собою кількість споживаного молока.
- Роль адипоциту XBP1 в метаболічній регуляції під час лактації - ScienceDirect
- Роль глюкагону у покращенні метаболізму, зумовленому втратою ваги, систематичний огляд та
- Діагностично-оцінний центр регулювання ваги при Harborview UW Medicine
- Вага хвилини 10 знаменитостей, які різко змінили свою вагу на роль
- Втрата ваги та уповільнення метаболізму, частина 2 Палео стрибок