Антигерпетичні ефекти Gynura procumbens
1 кафедра фармакогнозії, фармацевтичний факультет, університет Махідол, 447 Шрі Аюдхья Роуд, район Раджатеві, Бангкок 10400, Таїланд
2 Відділ фармацевтичних та натуральних продуктів, Таїландський інститут наукових і технологічних досліджень, Патхум Тані 12120, Таїланд
3 Відділ дерматології, Медичний факультет, Медичний факультет, лікарня Раматхібоді, Університет Махідол, Rama VI Road, Бангкок 10400, Таїланд
4 кафедра мікробіології, лікарня, лікарня Сірірадж, дорога Праннок, район Бангкок-Ной, Бангкок, 10700, Таїланд
5 Кафедра патології медичного факультету лікарні Раматхібоді, Університет Махідол, Rama VI Road, Бангкок 10400, Таїланд
6 Кафедра медичної хімії, Вікторіанський фармацевтичний коледж, Університет Монаш, Мельбурн, VIC 3052, Австралія
7 Кафедра фармацевтичної та лікарської хімії, Інститут фармацевтичних наук, Фрайбурзький університет, 79104 Фрайбург, Німеччина
Анотація
1. Вступ
Gynura procumbens (Lour.) Merr. згадується в традиційній китайській медицині як місцевий протизапальний засіб [1]. У Південно-Східній Азії, Гінура рослини широко поширені. У Таїланді, G. pseudochina змінний. гіспіда (Тайська назва: Wan Mahakaan) зовнішньо використовується як протисвербіжний, протизапальний та протигерпетичний вірус [2]. У Сінгапурі, Малайзії та Індонезії рослина традиційно використовується як ліки від висипної лихоманки, висипу, хвороб нирок, мігрені, запорів, гіпертонії, цукрового діабету та раку [3]. Екстракт етанолу з листа зменшував набряк вух миші, викликаний олією кротону [4]. Фітохімічні дослідження Росії Гінура рослини виявили відкриття алкалоїдів піролізидину [5–7], спіростанолу [8], кумаринів [7–9] та антоціанів [10]. Оскільки G. procumbens до цих пір не досліджували вірусної активності проти герпесу, з іншого боку, згідно з традиційною тайською медициною, використання рослини може бути пов'язане з вірусною герпетичною інфекцією; проводиться дослідження рослинних компонентів на антигерпетичну активність.
2. Матеріали та методи
Рослинний матеріал. Gynura procumbens було зібрано з провінції Чантабурі, Таїланд, у жовтні 1994 року. Рослина була ідентифікована пані Ліною Фупатпонг, експертом-ботаніком Лісового гербарію (BKF), Королівського лісового департаменту, Міністерство сільського господарства та кооперативів, Бангкок, Таїланд. Зразок ваучера (BKF № 127362) був депонований там же.
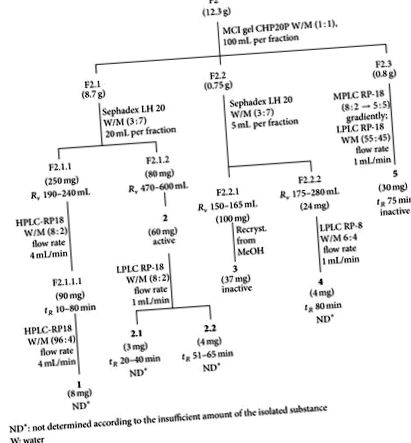
Видобування та ізоляція. Надземні частини рослини (25 кг, свіжі) промивали, розрізали на шматки, сушили у пічі на повітрі (60 ° C) і подрібнювали, отримуючи 1,7 кг порошку грубого порошку. Його послідовно екстрагували в апараті Сокслета з використанням петролейного ефіру (40–60 ° C), дихлорметану та етанолу. Розчинники видаляли при зниженому тиску. Сухий етаноловий екстракт (114 г) додатково відокремлювали за допомогою хроматографічних колон з різними пакувальними матеріалами. Колонка гелю MCI CHP20P фракціонувала екстракт на фракції F1 (вода), F2 (вода-метанол 1: 1), F3 (метанол) та F4 (етилацетат). F2, F3 та F4 були активними щодо вірусу герпесу.
F2 (12,3 г) і F3 (6,4 г) поступово хроматографували на гелі MCI CHP20P, використовуючи водний метанол (1: 1) для F2 і метанол для F3 як системи розчинників, в результаті чого отримували F2,1 (8,7 г), F2,2 ( 0,75 г) та F2,3 (0,8 г) та F3,1 (2,0 г), F3,2 (3,0 г) та F3,3 (0,8 г) відповідно. Сполуки 1, 2, 3, 4, і 5 були виділені з F2 (рис. 1), тоді як сполуки 6, 7, 8, і 9 були виділені з F3 (рис. 2). F4 додатково не вивчався.
Клітинна лінія. Клітинна лінія Vero (клітини нирок африканської зеленої мавпи) вирощувалась і підтримувалась у мінімальному незамінному середовищі Ігл (MEM), доповненому 10% фетальної телячої сироватки та антибіотиків (
Вірус. HSV-1, штам KOS та HSV-2, штам Baylor 186, були отримані з кафедри мікробіології лікарні Siriraj Hospital лікарні Mahidol University, Бангкок, Таїланд. Для експериментів використовували кількість 100 одиниць, що утворюють наліт (PFU) на мл.
Оцінка цитотоксичності. Послідовні 2-кратні розведення досліджуваного зразка в середовищі, що підтримує, додавали до моношару Vero. Після інкубації при температурі 37 ° C протягом 5 днів цитотоксичність визначали шляхом життєво важливого фарбування 1% кристалічно-фіолетовим у 10% формаліні протягом 30 хв. Найвища концентрація досліджуваного зразка, яка не виявляла цитотоксичності, представляла максимальну нетоксичну дозу (MNTD). Для проведення антивірусного аналізу використовували серійні 2-кратні розведення MNTD.
Противірусний аналіз. Противірусну активність визначали за допомогою аналізу зменшення нальоту на злитті клітинах Vero, що ростуть на 96-лункових планшетах для культури тканин. Тест включав три методи лікування, тобто інактивацію та попередню та подальшу обробку.
Інактивація (Для визначення нейтралізуючої активності досліджуваного зразка проти зараженості вірусом (віруліцидна дія)): вірус (100 μL) інкубували з досліджуваним зразком (100 μL) при 37 ° C протягом 1 год. Суміш додавали в продубльовані лунки одношарових клітин і інкубували при 37 ° С протягом 1 години. Після промивання клітин до культур додавали MEM та напівтверде середовище (0,4% трагаканта камеді), які потім інкубували при 37 ° С протягом 3 днів і фарбували кристалічно-фіолетовим.
Попередня обробка (для визначення інгібуючої активності вірусної адсорбції або проникнення): тест-зразок (100 μL) додавали до продубльованих лунок одношарових клітин та інкубували при 37 ° C протягом 24 годин. Після промивання культури клітини заражали вірусом (100 μL) та інкубували при 37 ° C протягом 1 години. Напівтверді середовища додавали до продубльованих лунок одношарових клітин після вимивання неадсорбованого вірусу. Культури інкубували при 37 ° С протягом 3 днів, а потім фарбували кришталево-фіолетовим кольором.
Післялікування (для визначення інгібуючої активності внутрішньоклітинної реплікації вірусу): одношарові клітини інфікували вірусом та інкубували при 37 ° С протягом 1 години. Після промивання клітин досліджуваний зразок (100 μL) і напівтверді середовища додавали в продубльовані лунки, інкубували при 37 ° С протягом 3 днів, а потім фарбували кришталево-фіолетовим.
Контроль. Контроль клітини: одношарова клітина в MEM та напівтвердому середовищі. Як позитивний контроль використовували ацикловір. Контроль за вірусами: одношарові клітини, заражені 100 PFU/мл вірусу, MEM та напівтвердих середовищ.
Розрахунок здатності інгібувати наліт: розраховували відсоток зменшення нальоту в порівнянні з культурою без лікування (контроль вірусів). Концентрація 50% інгібування (IC50) активної речовини або зразка була визначена як найнижча концентрація, яка зменшила кількість нальоту на 50% у оброблених порівняно з необробленими культурами.
Зразки розчиняли в диметилсульфоксиді (ДМСО) і розбавляли середовищем, що підтримує. Кінцева концентрація DMSO у досліджуваному зразку становила 0,3%.
Вірусна культура. Клітини Vero вирощували в ростовому середовищі, MEM (сіль Ерла, JR Scientific, Inc., Woodland, Каліфорнія, США) з добавкою 10% фетальної бичачої сироватки (Gibco, Гранд-Айленд, США) та 100 одиниць/мл пеніциліну G та 100 μг/мл стрептоміцину (M&H Manufacturing Co., Ltd., Таїланд) та 0,01 М HEPES (N-2-гідроксиетил-піперазин-N′-2-етансульфокислота) (Gibco, Гранд-Айленд, США). Підтримуючі середовища готували як рослинні середовища, за винятком того, що концентрація плодової бичачої сироватки була знижена до 2%.
Приготування рослинних екстрактів, рослинних та плацебо-гелів. Рослина мацерували етанолом і випаровували у вигляді сухого екстракту, який стандартизували 7, як специфічне маркерне з'єднання або стандарт. Як лікарський засіб використовували стандартизований етаноловий екстракт, який готували у вигляді 1 та 2% гелів на рослинній основі. Карбопол, гелеутворююча речовина, диспергували у прохолодній кип'яченій воді та нейтралізували розчином гідроксиду натрію. Екстракт рослини розчиняли в пропіленгліколі, додавали до гелю і ретельно перемішували. Гель плацебо готували так само, але замість рослинного екстракту застосовували барвник (карамель).
Пацієнти та метод. Це дослідження є подвійним сліпим випробуванням плацебо при лікуванні рецидивуючого губного герпесу G. procumbens гель порівняно з плацебо. Він був затверджений Комітетом з питань етичного допуску з прав людини, пов’язаного з дослідженнями, що стосуються людських суб’єктів. Клінічне випробування проводилось відповідно до керівних принципів ICH-GCP та Гельсінської декларації. Пацієнтів інформували до початку випробування та надавали письмовий консенсус щодо участі. Він проводився в трьох лікарнях, тобто в лікарнях Раматхібоді, Чулалонгкорн та Пхра Монгкутклао.
Пацієнти, яким брали участь, були віком понад 18 років, діагноз - рецидивуючий губний герпес, і симптом з’явився протягом 48 годин. Критеріями виключення були пацієнти під час вагітності чи лактації та пацієнти з хронічними захворюваннями та ВІЛ-інфекцією.
У перший день (D0) початку випробування реєстрували анамнез та симптоми пацієнтів, а інфіковані ураження фотографували. Для підтвердження діагнозу проводили мазок Цанка та посів вірусів. Базове лабораторне обстеження включало CBC, SGOT, SGPT, BUN креатинін та дослідження сечі.
Пацієнтів розподілили на три групи методом рандомізації блоків. Вони були групою А, яка отримувала 1% рослинного гелю, групою В - 2% рослинного гелю, та групою С - плацебо-гелем. Всім пацієнтам постачали однакові пробірки гелю.
Їм рекомендували тонко наносити гель на інфіковану ділянку кожні дві години в перший день та чотири рази на день у наступні дні, поки ураження не зажило. Виразність болю та свербежу реєструвалась пацієнтом щодня за лінійною візуальною аналоговою шкалою від 0 до 10 від жодної до дуже важкої. Також фіксували дати повної скоринки та повного загоєння. Слідчі оцінювали пацієнтів на 2 або 4 і 7 день, а також на наступний день, після якого ураження повністю зажили. Оцінка кожного наступного візиту включала вираженість болю та свербежу та дні повного утворення корочок та повного загоєння уражень. Також були зафіксовані побічні реакції або будь-які скарги пацієнта. На D2 – D4 та D7 пошкодження фотографували та проводили вірусні культури. Кров та сечу збирали та повторно досліджували під час останнього візиту.
Статистичні методи. Ми підрахували, що якби рівень успіху спостерігався у 80% пацієнтів, які отримували лікування наркотиками, і 50% - у пацієнтів, які отримували плацебо, для того, щоб виявити рівень успіху на рівні 5% значущості з потужністю 80%, потрібно було б 45 пацієнтів, які отримували лікування та 45 пацієнтів, які отримували плацебо. Ми роздули обчислений обсяг вибірки до 50 пацієнтів, щоб компенсувати 10% відсотків подальшого спостереження. Точний тест Фішера був використаний для порівняння показника успіху між групами, які отримували лікування та плацебо. Описова статистика була представлена як середнє із стандартним відхиленням. Статистичний аналіз проводили на основі завершеного дослідження.
3. Результати
Виділення водного метанолу F2 та фракцій метанолу F3 призвело до чотирьох антигерпетичних компонентів, тобто, 2 від F2 (рисунок 1, таблиця 1) та 7, 8, і 9 від F3 (Рисунок 2, Таблиця 1). Флавоноїди (суміш 3.1 і 3.2 і 5), які були виділені з F2 та 6 від F3 не мав противірусної активності. Сполуки 2, 7, 8, і 9 були ідентифіковані за допомогою спектроскопічних методів, особливо ЯМР із методом градієнта поля [11–14].
2: Суміш дикафеоїлкових кислот (2.1 і 2.2)
2.1 (Малюнок 4): 3,5-Ді-О-Кофеоїлхінова кислота. Аморфний жовтий порошок; Р.f 0,55, силікагель 60, CHCl3/MeOH/H2O/оцтова кислота/(21: 15: 3: 1); УФ (MeOH)
326 нм. 1 Н-ЯМР (CD3OD, 300 МГц) δ 7,62, 7,58 (пом, J = 16 Гц, H-7 ′, H-7 ′ ′, кожен) 7,08, 7,06 (d, J = 8,2, H-2 ', H-2', кожен) 6,98, 6,96 (dd, J = 8, 2 Гц, H-6 ′, H-6 ′ ′, кожен) 6,78 (d, J = 8,0, H-5 ′, H-5 ′ ′, кожен) 6,41, 6,30 (d, J = 16 Гц, H-8 ′, H-8 ′ ′) 5,55 (ddd, J = 10,2, 9,7, 6,0, H5ax) 5,38 (ddd, J = 3, 3, 3 Гц, H-3eq) 3,90 (dd, J = 7, 3 Гц, H-4ax) 2,28 (dd, J = 15,1, 3,1 Гц, Н-2).
2.2 (Малюнок 5): 4,5-Ді-О-Кофеоїлхінова кислота. Аморфний жовтий порошок, Р.f 0,50, силікагель 60, CHCl3/MeOH/H2O/оцтова кислота/(21: 15: 3: 1); УФ (MeOH) 326 нм. 1 Н-ЯМР (CD3OD, 300 МГц) δ 7,57, 7,49 (пом, J = 16 Гц, H-7 ′, H-7 ′ ′, кожен) 7,02, 6,98 (d, J = 2 Гц, H-2 ', H-2', кожен) 6,89, 6,86 (dd, J = 8, 2 Гц, H-6 ′, H-6 ′ ′, кожен) 6,73, 6,71 (d, J = 8 Гц, H-5 ′, H-5 ′ ′, кожен) 6,26, 6,18 (d, J = 16 Гц, H-8 ', H-8', кожен) 5,69 (ddd, J = 10,3, 9,7, 7,0 Гц, H-5ax) 5,10 (dd, J = 10,0, 3,0 Гц, H-4ax) 4,31 (ddd, J = 3,0, 4,0, 3,0 Гц, H-3eq) 2,0–2,4 (широка м, H2-2, H2-6).
8: 1,2-біс-додеканоїл-3-α-D-глюкопіранозил-sn-гліцерин (Моноглюкозилдигліцерид, малюнок 13). Безбарвна воскова маса, Р.f 0,15, силікагель 60, CHCl3/MeOH/H2O/(20: 5: 0,5); 1 Н-ЯМР (CD3OD), 300 МГц) δ 5,28 (dddd, J = 7,0, 6,4, 4,0, 4,1 Гц, H-2) 4,77 (д, J = 3,8 Гц, H-1 ′ ′ ′) 4,50 (м, H-1a) 4,14 (dd, J = 12,0, 7,0 Гц, H-1b) 4,00 (dd, J = 10,8, 6,4 Гц, H-3a; ddd, J = 9,8, 9,0, 3,4 Гц, H-5 ′ ′ ′) 3,60 (dd, J = 9,5, 9,0 Гц, H-3 ′ ′ ′) 3,56 (dd, J = 10,8, 6,4 Гц, H-3b) 3,41 (dd, J = 9,7, 3,8 Гц, H-2 ′ ′ ′) 3,28 (dd, J = 14,3, 9,7 Гц, H-6 ′ ′ ′ a) 3,19 (dd, J = 9,7, 9,0 Гц, H-4 ′ ′ ′) 3,00 (dd, J = 14,3, 3,4 Гц, H-6 ′ ′ ′ b) 2,30 (t, J = 7,6, 7,6 Гц, H-2 ′, 2 ′ ′) 1,57 (m, H-3 ′, 3 ′ ′) 1,25 (m, H-4′-13 ′, 4 ′ ′ - 13 ′ ′) 0,84 ( т, J = 6,4, 6,0 Гц, H-14 ′, 14 ′ ′); 13 C-ЯМР (CD3OD, 75 МГц): δ 192,31 (C-1 ′, 1 ′ ′) 99,08 (C-1 ′ ′ ′) 74,00 (C-3 ′ ′ ′, 4 ′ ′ ′) 73,00 (C-2 ′ ′ ′) 71,50 (C-2) 70,00 (C-5 ′ ′ ′) 66,00 (C-3a, 3b) 64,00 (C-1a, 1b) 61,00 (C-6 ′ ′ ′ a, 6 ′ ′ ′ b) 34,69 (C-2 ′, 2 ′ ′ ) 29,52–30,06 (C-4′-11 ′, 4 ′ ′ - 11 ′ ′) 25,27 (C-3 ′, 3 ′ ′) 23,02 (C-13 ′, 13 ′ ′).
Антигерпетична діяльність Росії 1 і 4 не були визначені через хвилинну суму. Сполуки 3, 5, і 6були неактивними. Хімічна структура 1, 3, 4, 5, і 6 були визначені наступним чином.
1: 5-O-кофеоїл-D-хінова кислота (Хлорогенова кислота, Малюнок 3). Безбарвний аморфний порошок; УФ (MeOH) 326 нм, плече при 299 нм; ESI MS (позиційний іонний режим) м/з 355 [М + Н] +; (розраховано для C16H18O9354); 1 H-ЯМР (DMSO-d6, 300 МГц) δ 7.40 (д.), J = 16,0 Гц, H-7 ′), 7,00 (д, J = 2,0 Гц, H-2 ′), 6,94 (dd, J = 8,0, 2,0 Гц, H-6 ′), 6,73 (д, J = 8,0 Гц, H-5 ′), 6,14 (d, J = 16,0 Гц, H-8 ′), 5,10 (ddd, J = 8,0, 7,0, 6,0 Гц, H-5ax), 3,90 (широкий, H-3eq), 3,48 (dd, J = 7,0, 4,0 Гц, H-4ax), 1,97 (m, H-2a), 1,86 (m, H-6), 1,71 (m, H-2b); 13 C-ЯМР (DMSO-d6, 75 МГц): δ 175,00 (C-7), 165,90 (C-9 ′), 148,20 (C-3 ′), 145,47 (C-4 ′), 144,67 (C-7 ′), 125,56 (C-1 ′), 121,18 (C -6 ′), 115,68 (C-5 ′), 114,70 (C-8 ′), 114,45 (C-2 ′), 73.20 (C-1), 71,50 (C-3), 71,19 (C-5), 69,52 (С-4), 36,92 (С-2).
- 10 Формування дієти, ефекти переробки, фактори, що впливають на споживання, та дієтичне тваринництво
- Огляд харчової цінності бобових культур та їх впливу на ожиріння та пов’язане з цим
- Побічні ефекти антибіотиків у дітей - Звіти споживачів
- Антигерпетичні ліки можуть зменшити ризик розвитку деменції - радник з інфекційних хвороб
- Ефекти проти ожиріння екстракту гарячої води та екстракту часнику з високим гідростатичним тиском у щурів