Постнатальний ріст скелета зумовлений епіфізарною нішею стовбурових клітин: потенційні наслідки для педіатрії
Анотація
Поздовжньому зростанню дітей сприяє діяльність ростових пластинок, хрящових дисків, розташованих біля кінців довгих кісток. Для того, щоб подовжити ці кістки, пластини росту повинні постійно генерувати хондроцити. Два останні дослідження показали, що в пластині росту є стовбурові клітини та ніша стовбурових клітин, які регулюють генерацію хондроцитів протягом періоду післяпологового росту. Ніша, яка дозволяє поновлюватися стовбуровим клітинам, з’являється одночасно з тим, як вторинний центр окостеніння (SOC) дозріває до кісткового епіфізу. Таким чином, механізм генерації хондроцитів істотно відрізняється між неонатальним та постнатальним віком, тобто до і після утворення мінералізованих епіфізів. Отже, у новонародженому віці ріст кісток заснований на споживанні хондро-попередників, тоді як в постнатальному періоді - на активності ніші стовбурових клітин. Тут ми обговоримо потенційні наслідки цих спостережень щодо поздовжнього зростання, включаючи ефекти естрогенів, харчування та гормону росту.
Ріст скелета та організація епіфізарного хряща
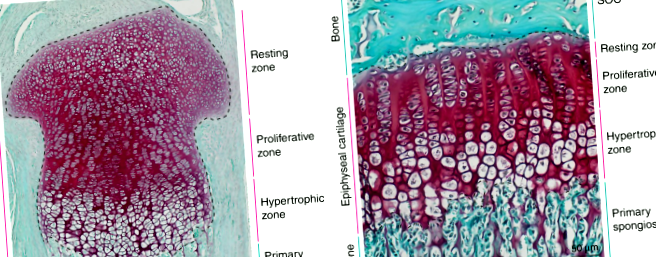
Діти збільшуються у висоті через активність хрящової тканини, розташованої в епіфізах (тобто проксимальному та дистальному кінцях) довгих кісток. Під час розвитку епіфізи повністю складаються з хряща (рис. 1а) і відокремлюються один від одного кістковою тканиною в межах первинної спонгіози. Незабаром після народження велика частка хрящових клітин (хондроцитів) у центрі кожного епіфізу витрачається на формування вторинного центру окостеніння (SOC). SOC розвивається в зрілу кісткову тканину (утворюючи кістковий епіфіз), який залишає лише вузький диск епіфізарного хряща між двома кістковими структурами (тобто SOC і первинною спонгіозою); ці диски називаються (епіфізарними) пластинами росту 1 і залишаються в довгих кістках протягом усього періоду постнатального росту (рис. 1б, див. схему на рис. 2а). Це виділення епіфізарного хряща в просторово відокремлену структуру пластини росту за допомогою SOC необхідно для захисту хондроцитів пластини росту від механічних вимог, пов’язаних з вагою під час росту неповнолітніх. 2 Важливо, що епіфізарний хрящ постійно сприяє зростанню кісток до, під час та після формування пластинки росту.
Гістологічні зображення епіфізарного хряща миші до (a) і після (b) пластинка росту визначається дозріванням центру вторинного окостеніння. Зрізи тканин від 3 днів (a) і 30 днів (b) проксимальні відділи гомілок миші забарвлюються сафраніном О (червоний, хрящ) та швидким зеленим (зелений, кістковий та сполучна тканина).
Схематичне зображення різних стадій росту кісток (a) та механізми генерації хондроцитів до і після формування епіфізарної ніші стовбурових клітин (b).
На всіх етапах росту довгих кісток епіфізарний хрящ можна розділити гістологічно на три окремі зони: зону спокою, проліферацію та гіпертрофічну зону (рис. 1). Зона відпочинку містить круглі хондроцити в найменш диференційованій стадії (хондро-родоначальники), які рідко діляться і потомство яких сприяє проліферативній зоні. 3,4,5 У проліферативній зоні хондроцити швидко діляться і сплющуються, розташовуючись у стовпчики, які вирівнюються паралельно напрямку росту. Після цього хондроцити виходять з клітинного циклу і далі диференціюються у великі гіпертрофічні хондроцити, утворюючи гіпертрофічну зону. Одночасно клітини реконструюють і звапнюють хрящі, що їх оточують. Згодом гіпертрофічні хондроцити зазнають апоптозу або транс-диференціювання в остеобласти, 6,7,8, що залишає порожні лакуни, оточені кальцифікованим хрящем. Лакуни вражаються кровоносними судинами у супроводі остео-попередників, які використовують кальцифікований хрящовий матрикс як підмосток, на якому виробляють кістковий матрикс. Отже, подовження кісток безпосередньо пов’язане з розміром гіпертрофічних хондроцитів. 9 Весь процес називається утворенням ендохондральної кістки і справедливий для всіх довгих кісток в організмі.
Оскільки процес росту довгих кісток вимагає величезної кількості гіпертрофічних хондроцитів, у всіх дітей, що ростуть, постійно генеруються гіпертрофічні хондроцити.
Нові спостереження виявляють новий механізм генерації хондроцитів
У сукупності ці дослідження показують, що існує концептуальна різниця між ростом кісток новонародженого та післяпологовим, перший заснований на споживанні хондро-попередників, тоді як другий заснований на стовбурових клітинах та відповідній ніші стовбурових клітин, що полегшує їх підтримку ( Рис. 2а, б). Це відкриття має кілька наслідків.
Поняття епіфізарної ніші стовбурових клітин
Концепція ніші стовбурових клітин як специфічного мікросередовища, що сприяє відновленню клітин-попередників, була висунута Р. Шофілдом у 1978 р. 17 Ці мікросередовища дуже мінливі для різних ніш стовбурових клітин і можуть впливати на поведінку стовбурових клітин різними способами через взаємодії з сусідніми типами клітин, складними мережами та градієнтами сигнальних молекул, компонентами позаклітинного матриксу та механічними силами. Наприклад, дорослі гемопоетичні стовбурові клітини (HSC) вимагають взаємодії з ендотеліальними клітинами та CXC-хемокіновим лігандом 12 (CXCCL12) - рясними ретикулярними (CAR) мезенхімальними стромальними клітинами для їх відновлення, як високо виражаючих CXCCL12, так і фактор стовбурових клітин, 18,19, 20 міжфолікулярних епідермісів (IFE) стовбурових клітин потребують прикріплення до базальної мембрани, 21 і мезенхімальні стовбурові клітини підтримуються механічними подразниками. 22 Рівний склад однієї ніші може бути дуже складним і включати різноманітні типи клітин та фактори навколишнього середовища, оскільки для ніші HSC поверх КАР та ендотеліальних клітин він включає макрофаги, остео-попередники, низьку напругу кисню, немієлінізуючий Клітини Шванна та симпатична іннервація (огляд див. Посилання 19,20).
У випадку з пластиною росту нішеве мікросередовище виникає одночасно з формуванням кісткового епіфізу (тобто, як тільки SOC дозріє) безпосередньо над шаром хондро-родоначальників (рис. 1b). Таким чином, взаємодія між кістковою тканиною та епіфізарними стовбуровими клітинами може спричинити їх оновлення або безпосередньою взаємодією, змінами позаклітинного матриксу (ECM) або дифузними морфогенами. 11
Формування різних ніш стовбурових клітин відбувається пізно в процесі розвитку або навіть постнатально. Наприклад, у мишей гемопоетичні стовбурові клітини, що перебувають у кістках в ембріональний день E17.5, 23, оновлюються волосяні фолікули з початком циклу волосся приблизно в післяпологовий день 17, 24, ніша зародкових ліній починає нормально функціонувати при статевому дозріванні 25 і відновлення суглобових хондро-родоначальників починається після кавітації суглобів. 26,27 Формування епіфізарної ніші стовбурових клітин при постнатальному розвитку кісткових епіфізів добре вписується в цю модель.
Злиття пластини росту і ніші стовбурових клітин
Гормон росту, харчування та ріст
Гормон росту (ГР) є ключовим стимулятором росту дітей і зазвичай використовується для лікування дітей із затримкою росту. Однак деякі дії GH залишаються поясненими, наприклад, відносно невелике збільшення остаточного зросту та невідповідність терапії у деяких дітей. 38 Деякі з ефектів GH опосередковуються за допомогою інсуліноподібного фактора росту I (IGF1), але також було показано пряму дію на пластину росту 39, яка, як пропонується, має бути саме на клітини зони спокою. 40 Цікаво, що дія GH, що стимулює ріст, з’являється у мишей у віці від 2 до 3 тижнів, 41 збігаючись із появою епіфізарних стовбурових клітин та ніші. 10,11 Поєднуючи всі ці непрямі спостереження, можна припустити гіпотезу про те, що ГР може діяти конкретно на епіфізарні стовбурові клітини або модулювати їх нішу. Дія GH на епіфізарні стовбурові клітини та склад ніші ще не з’ясовані.
Комплекс mTOR 1 (mTORC1) є харчовим датчиком 42 і прискорює диференціацію стовбурових клітин кишечника та нервових стовбурових клітин, 43,44 тоді як він сприяє початковому розширенню гемопоетичних стовбурових клітин. 45 В епіфізарній ніші стовбурових клітин активація mTORC1 сприяє симетричному поділу стовбурових клітин, збільшуючи тим самим їх кількість, 11 швидше за все незалежним від аутофагії способом. 46 У генетичних експериментах активація mTORC1 не призводить до подовження кісток, можливо, через поступову дезорганізацію пластини росту. 47 Однак тимчасова активація mTORC1, наприклад, з високим рівнем амінокислот або IGF1 (обидва основні активатори mTORC1), може теоретично збільшити кількість епіфізарних стовбурових клітин.
Закономірності зростання та еволюція
На закінчення, відкриття епіфізарної ніші стовбурових клітин та епіфізарних стовбурових клітин, які відповідають за поздовжній ріст після пологів, забезпечує нову перспективу регулювання росту як такої, а також забезпечує альтернативний погляд на незрозумілі в даний час клінічні спостереження. Однак пряму екстраполяцію спостережень, проведених від мишей, до фізіології людини слід проводити з обережністю, оскільки їх механізми росту не ідентичні.
Список літератури
Кроненберг, Х. М. Регуляція розвитку пластини росту. Природа 423, 332–336 (2003).
Сі, М. та співавт. Вторинні центри окостеніння еволюціонували, щоб зробити ріст ендохондральної кістки можливим за вагомими потребами земного середовища. bioRxiv 571612 (2019). https://doi.org/10.1101/571612.
Кембер, Н. Ф. Поділ клітин при ендохондральній окостенінні. J. Bone Jt. Хірургічний. Br. 42-Б, 824–839 (1960).
Чагін, А. С. та ін. Стимулююча субодиниця G-білка альфа та G-білки Gq/11α необхідні для підтримки спокійних стовбуроподібних хондроцитів. Нат. Комун. 5, 1–14 (2014).
Абад, В. та ін. Роль зони спокою в хондрогенезі пластини росту. Ендокринологія 143, 1851–1857 (2002).
Ян, Г. та ін. Остеогенна доля гіпертрофічних хондроцитів. Клітинна Res. 24, 1266 (2014).
Чжоу, X. та ін. Хондроцити трансдиференціюються в остеобласти в ендохондральній кістці під час розвитку, постнатального росту та загоєння переломів у мишей. PLoS Genet. 10, e1004820 (2014).
Ono, N., Ono, W., Nagasawa, T. & Kronenberg, H. M. Підмножина хондрогенних клітин забезпечує ранні мезенхімальні попередники у зростаючих кістках. Нат. Клітинна біол. 16, 1157–1167 (2014).
Купер, К. Л. та співавт. Багато фаз збільшення хондроцитів лежать в основі відмінностей скелетних пропорцій. Природа 495, 375–378 (2013).
Mizuhashi, K. та співавт. У зоні спокою ростової пластини знаходиться унікальний клас скелетних стовбурових клітин. Природа 563, 254–258 (2018).
Ньютон, П. Т. та ін. Радикальний перехід у клональності виявляє нішу стовбурових клітин в епіфізарній пластині росту. Природа 567, 234–238 (2019).
Zhou, B. O., Yue, R., Murphy, M. M., Peyer, J. G. & Morrison, S. J. мезенхімальні стромальні клітини, що експресують рецептори лептину, є основним джерелом кістки, утвореної кістковим мозку дорослого. Клітинна стовбурова клітина 15, 154–168 (2014).
Уортлі, Д. Л. та співавт. Gremlin 1 ідентифікує скелетні стовбурові клітини з кістковим, хрящовим та ретикулярним стромальним потенціалом. Клітинка 160, 269–284 (2015).
Чан, К. К. Ф. та ін. Ідентифікація та специфікація скелетних стовбурових клітин миші. Клітинка 160, 285–298 (2015).
Чан, К. К. Ф. та ін. Ідентифікація скелетних стовбурових клітин людини. Клітинка 175, 43–56.e21 (2018).
Debnath, S. та співавт. Відкриття періостальної стовбурової клітини, що опосередковує внутрішньомембранозне утворення кісток. Природа 562, 133–139 (2018).
Schofield, R. Взаємозв'язок між колонієутворюючою клітиною селезінки та гемопоетичною стовбуровою клітиною. Клітини крові 4, 7–25 (1978).
Кіль, М., Моррісон, С., Кіль, М. Дж. І Моррісон, С. Дж. Невизначеність у нішах, що підтримують гемопоетичні стовбурові клітини. Нат. Преподобний Імунол. 8, 290–301 (2008).
Крейн, Г. М., Джеффрі, Е. та Моррісон, С. Дж. Ніші дорослих гемопоетичних стовбурових клітин. Нат. Преподобний Імунол. 17, 573–590 (2017).
Hoggatt, J., Kfoury, Y. & Scadden, D. T. Ніша гемопоетичних стовбурових клітин у стані здоров'я та хвороб. Анну. Преподобний Патол. 11, 555–581 (2016).
Hsu, Y. C., Li, L. & Fuchs, E. Нові взаємодії між стовбуровими клітинами шкіри та їх нішами. Нат. Мед. 20, 847–856 (2014).
Гуілак, Ф. та ін. Контроль долі стовбурових клітин шляхом фізичної взаємодії з позаклітинним матриксом. Клітинна стовбурова клітина 5, 17–26 (2009).
Christensen, J. L., Wright, D. E., Wagers, A. J. & Weissman, I. L. Циркуляція та хемотаксис гемопоетичних стовбурових клітин плода. PLos Biol. 2, E75 (2004).
Blanpain, C. & Fuchs, E. Епідермальні стовбурові клітини шкіри. Анну. Преподобний стільниковий розробник Біол. 22, 339–373 (2006).
Отлі, Дж. М. і Брінстер, Р. Л., Ніша зародкової лінії стовбурових клітин у яєчках ссавців. Фізіол. Преподобний. 92, 577–595 (2012).
Лі, Л. та співавт. Поверхневі клітини - це самовідновлюються попередники хондроцитів, які у неповнолітніх мишей утворюють суглобовий хрящ. Фасеб Дж. 31, 1067–1084 (2017).
Шварц Ю., Вюков С., Короф, С. і Зельцер, Е. Спільна розробка передбачає постійний приплив Gdf5-позитивних клітин. Клітинний представник. 15, 2577–2587 (2016).
Кляйн, А. М. і Саймонс, Б. Д. Універсальні моделі долі стовбурових клітин у циклічних тканинах дорослих. Розвиток 138, 3103–3111 (2011).
Snippert, H. J. et al. Гомеостаз кишкової склепи є результатом нейтральної конкуренції між симетрично розділеними стовбуровими клітинами Lgr5. Клітинка 143, 134–144 (2010).
Hume, W. J. & Potten, C. S. Довгоживучий пул тимідину в епітеліальних стовбурових клітинах. Кінет клітинних тканин. 15, 49–58 (1982).
Кембер, Н. Ф. Кінетика клітин та контроль росту довгих кісток. Кінет клітинних тканин. 11, 477–485 (1978).
Morrison, S. J. & Spradling, A. C. Стовбурові клітини та ніші: механізми, що сприяють підтримці стовбурових клітин протягом усього життя. Клітинка 132, 598–611 (2008).
Чагін, А. С. і Севендаль, Л. Естрогенні рецептори та лінійний ріст кісток. Acta Pædiatrica 96, 1275–1279 (2007).
Сміт, Е. П. та співавт. Резистентність до естрогену, спричинена мутацією гена рецепторів естрогену у людини. Н. Енгл. J. Med. 331, 1056–1061 (1994).
Morishima, A., Grumbach, M. M., Simpson, E. R., Fisher, C. & Qin, K. Дефіцит ароматази у чоловіків та жінок та сестер, спричинений новою мутацією та фізіологічною роллю естрогенів. J. Clin. Ендокринол. Метаб. 80, 3689–3698 (1995).
Emons, J. et al. Епіфізарне злиття в пластині росту людини не передбачає класичного апоптозу. Педіатр. Рез. 66, 654–659 (2009).
Emons, J., Chagin, A. S., Savendahl, L., Karperien, M. & Wit, J. M. Механізми дозрівання пластинки росту та злиття епіфіза. Горм. Рез. Педіатр. 75, 383–391 (2011).
Вонг, С. С. та ін. Зростання та вісь гормону росту-інсулін як фактор росту 1 у дітей із хронічним запаленням: поточні дані, прогалини в знаннях та майбутні напрямки. Endocr. Преподобний. 37, 62–110 (2016).
Isaksson, O. G., Jansson, J. O. & Gause, I. A. Гормон росту безпосередньо стимулює ріст поздовжньої кістки. Наука 216, 1237–1239 (1982).
Ohlsson, C., Nilsson, A., Isaksson, O. & Lindahl, A. Гормон росту викликає розмноження повільно кружляючих зародкових клітин пластини росту гомілки щурів. Proc. Natl Акад. Наук. США 89, 9826–9830 (1992).
Чжоу, Ю. та ін. Модель ссавців для синдрому Ларона, спричинена цілеспрямованим порушенням рецептора гормону росту миші/гена, що зв'язує білок (миша Ларон). Proc. Natl Акад. Наук. США 94, 13215–13220 (1997).
Chantranupong, L., Wolfson, R. L. & Sabatini, D. M. Механізми зондування поживних речовин протягом еволюції. Клітинка 161, 67–83 (2015).
Йільмаз, О. Х. та співавт. mTORC1 в ніші клітин Панета поєднує функцію кишкових стовбурових клітин із споживанням калорій. Природа 486, 490–495 (2012).
Mahoney, C., Feliciano, D. M., Bordey, A. & Hartman, N. W. Увімкнення mTORC1 викликає нейрогенез, але не проліферацію в нервових стовбурових клітинах молодих мишей. Невроски. Lett. 614, 112–118 (2016).
Ган, Б. та ін. mTORC1-залежне та незалежне регулювання відновлення, диференціації та мобілізації стовбурових клітин. Proc. Natl Акад. Наук. США 105, 19384–19389 (2008).
Вуппалапаті, К. К. та співавт. Цільова делеція генів аутофагії Atg5 або Atg7 в хондроцитах сприяє каспазазалежній загибелі клітин і призводить до легкої затримки росту. J. Bone Min. Рез. 30, 2249–2261 (2015).
Newton, P. T., Xie, M., Medvedeva, E. V., Sävendahl, L. & Chagin, A. S. Активація mTORC1 в хондроцитах не впливає на проліферацію або диференціацію, але призводить до того, що зона відпочинку площі росту стає невпорядкованою. Кістковий представник. 8, 64–71 (2018).
Подяка
Ми дякуємо професору Коліну Фаркуарсону (Інститут Росліна та Королівській школі ветеринарних досліджень Едінбурзького університету) за конструктивні дискусії та Ользі Харченко за графічну роботу. A.S.C. дякує Шведській дослідницькій раді (2016-02835), Інституту Каролінської, Внутрішньому гранту Університету імені Сеченова (програма 5 із 100) та Російському науковому фонду (19-15-00241) за фінансову підтримку. P.T.N. дякує Frimurare Barnhuset i Stockholm та Barnavård stiftelse за фінансову підтримку.
Інформація про автора
Приналежності
Кафедра фізіології та фармакології Інституту Каролінської, 17177, Стокгольм, Швеція
Андрій Сергійович Чагін та Філіп Т. Ньютон
Інститут регенеративної медицини, Перший Московський державний медичний університет імені Сеченова (Університет імені Сеченова), Москва, Російська Федерація
Андрій Сергійович Чагін
Відділ жіночого та дитячого здоров'я Інституту Каролінської та відділення дитячої ендокринології, Університетська лікарня Каролінської, 17176, Стокгольм, Швеція
Філіп Т. Ньютон
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
A.S.C. та P.T.N. задумав дослідження. A.S.C. написав проект і P.T.N. допомагав у написанні, обговоренні та критичному розгляді проекту.
Відповідний автор
Декларації про етику
Конкуруючі інтереси
Автори декларують відсутність конкуруючих інтересів.
Додаткова інформація
Примітка видавця Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- Терапія стовбуровими клітинами при болях в колінах - клініка Шнайдера Елькхарт, штат Індонезія
- Зростання теорій змови, як виявляється, зумовлене пробковими дошками, виробниками струн - Бівертон
- Розширювачі м’язів, що розтягують, сприяють росту м’язів у витягнутих положеннях
- Темпи зростання цуценят та зміни ваги племінних самок у двох популяціях дегустаційного породи
- Знаменитий лідер неонацистів; замучені та вбиті; в камері та смерті - фальшиве самогубство, - каже сім'я -