Комбінація екстракту корейського червоного женьшеню та Glycyrrhiza glabra Екстракт L. посилює їхні індивідуальні властивості проти ожиріння у адипоцитах 3T3-L1 та мишах з ожирінням C57BL/6J
Департамент харчової науки та харчування, Університет Халлім, Чунчхон, Корея.
Корейський інститут харчування, Університет Халлім, Чунчхон, Корея.
Департамент харчової науки та харчування, Університет Халлім, Чунчхон, Корея.
Корейський інститут харчування, Університет Халлім, Чунчхон, Корея.
Департамент харчової науки та харчування, Університет Халлім, Чунчхон, Корея.
Корейський інститут харчування, Університет Халлім, Чунчхон, Корея.
Корейський дослідницький інститут корпорації женьшеню, Korea Ginseng Corporation, Теджон, Корея.
Корейський дослідницький інститут корпорації женьшеню, Korea Ginseng Corporation, Теджон, Корея.
Корейський дослідницький інститут корпорації женьшеню, Korea Ginseng Corporation, Теджон, Корея.
Департамент харчової науки та біотехнологій, Національний університет Канвон, Чунчхон, Корея.
Адресна кореспонденція з: Іл-Джун Кан, доктор філософії, Департамент харчових наук та харчування, Університет Халлім, Чунчхон 24252, Корея,
Департамент харчової науки та харчування, Університет Халлім, Чунчхон, Корея.
Корейський інститут харчування, Університет Халлім, Чунчхон, Корея.
Анотація
Вступ
Ожиріння - сучасне хронічне запальне захворювання. 1 Ожиріння впливає не тільки на зовнішній вигляд, а й спричиняє множинні метаболічні синдроми, включаючи гіперліпідемію, серцево-судинні захворювання, діабет 2 типу та неалкогольну жирову печінку. 2 Поточною концепцією лікування ожиріння є управління метаболічним балансом між споживанням та споживанням енергії. 3
При лікуванні ожиріння ефективність та безпека натуральних продуктів є більш обнадійливими завдяки меншій кількості побічних ефектів порівняно з традиційними хімічними синтетичними препаратами, які, як відомо, викликають діарею та блювоту. 4–6 За останні роки багато досліджень повідомляють, що два або більше натуральних продуктів, змішаних при різних співвідношеннях, мають більш виражені функції, ніж окремий натуральний продукт. 7–10 Це може бути пов’язано із синергічним впливом активних сполук, що містяться в різних природних продуктах. 11
Червоний женьшень - це ферментований сорт женьшеню, приготований сушінням на пару. 12 Це може знизити кров'яний тиск і запобігти окисленню. Крім того, він має протипухлинну, проти ожиріння, гіполіпідемічну та гіпоглікемічну дію. 13–16 Ферментований червоний женьшень може збільшити вміст загальних гінзенозидів, поліпшити його біодоступність та посилити фармакологічну активність. 17 Сапоніни належать до основних активних сполук червоного женьшеню. Широко повідомляється, що сапоніни можуть пригнічувати активність ліпази, 18 зменшувати тригліцериди плазми (ТГ) і послаблювати адипогенез. 19 Glycyrrhiza glabra Л. культивується у багатьох країнах 20 і добре відомий у традиційній медицині для лікування захворювань печінки, ангіни, астми, бронхіту та лихоманки. 21 Крім того, було вказано, що Glycyrrhiza glabra Екстракт L. (GG) може зменшити плазмовий TG у моделей щурів із ожирінням. 22
У цьому дослідженні ми безпрецедентно змішали фракцію сапоніну корейського червоного женьшеню (RGS) та екстракт GG та дослідили, чи може суміш у різних пропорціях посилити їх ефект проти ожиріння.
Матеріали і методи
Підготовка зразка
Стандартизовані RGS та GG були придбані у корейської корпорації женьшеню (Теджон, Корея). Стандартизовані екстракти червоного женьшеню фракціонували за допомогою колоночної хроматографії Diaion HP20, використовуючи H2O, 30% етанол (EtOH) і 95% EtOH як елюенти в процесі послідовного елюювання. Потім 95% -ну фракцію EtOH концентрували у вакуумі та сушили розпиленням з отриманням фракції сапоніну. Висушений GG двічі екстрагували 30% EtOH при 80 ° C, фільтрували 1 μм розміру пор, концентрують при зниженому тиску і сушать розпиленням. Потім сухі порошки екстракту RGS та GG змішували при масовому співвідношенні 3: 1 (SG31), 1: 1 (SG11) або 1: 3 (SG13).
Культура клітин та їх диференціація
Преадипоцити 3T3-L1 були придбані в Американській колекції типів культур (CL-173, Манассас, штат Вірджинія, США) і культивовані в модифікованому Дульбекко середовищі Eagle (Biowest, Riverside, MO, USA), що містить 1% пеніциліну/стрептоміцину (P/S; Gibco, Гранд-Айленд, Нью-Йорк, США) та 10% бичачої телячої сироватки (Gibco) при 37 ° C з 5% CO2. Через 2 дні клітини досягли злиття. Потім клітини індукували диференційованим середовищем MDI, яке містило 10% бичачої сироватки плода (FBS; Gibco), 1% P/S, 0,5 мМ 3-ізобутил-1-метилксантину (IBMX; Sigma-Aldrich, St. Louis, MO, США), 1 μМ дексаметазон (Dex; Sigma-Aldrich) та 10 μг/мл інсуліну (Gibco) протягом 2 днів. Через два дні клітини додатково індукували середовищем диференціювання MDI протягом 2 днів (видаляли IBMX та Dex). Після цього регулярне середовище (10% FBS та 1% P/S) оновлювалось кожні 2 дні до 8-го дня. 23
Аналіз життєздатності клітин
Клітини висівали при щільності 5 × 10 4 клітин/лунку разом з екстрактами (0–300 μг/мл) протягом 24 год. Реагент МТТ додавали до середовища та інкубували протягом 2 годин. Середовище спорожнили, а сіль формазану знову розчинили в диметилсульфоксиді (DMSO; Sigma-Aldrich), вимірявши за допомогою ультрафіолетового (УФ) -видимого спектрометра (Multiskan FC; Thermo Fisher Scientific, Inc., Waltham, MA, USA). 570 нм. 23
Аналіз фарбування Oil Red O
Клітини висівали при щільності 5 × 10 4 клітин/лунку і спонукали диференціюватись разом з екстрактами (100 μг/мл). Ці зрілі адипоцити промивали сольовим розчином, забуференним фосфатом (Lonza, Walkersville, MD, США), і закріплювали у 4% параформальдегіді при кімнатній температурі протягом 1 години. Промивши захищені клітини 60% ізопропанолом, їх фарбували розчином Oil Red O (Sigma-Aldrich) (0,35% барвником O Oil red у 60% ізопропанолу) протягом 20 хв, а потім промивали дистильованою водою. Пофарбовані клітини сушили природним шляхом, а потім розчиняли у 100% ізопропанолі. Поглинання вимірювали при 520 нм за допомогою УФ-видимого спектрометра. 24
Дизайн експерименту на тваринах
Самців 5-тижневих мишей C57BL/6J отримували від Central Laboratory Animal Incorporated (Сеул, Корея) та акліматизували до лабораторного середовища (температура 24 ° C ± 2 ° C, відносна вологість 55% ± 5% та чергування 12-годинний світлий/12-годинний темний цикл) протягом 1 тижня. Потім цих мишей випадковим чином розділили на дві групи: (1) контрольну групу (n = 8), мишей годували нормальним жиром (NFD; 10% ккал жиру, Дієта з коригованими калоріями, № TD.06416; Envigo, Медісон, Вісконсин, США) та (2) експериментальна група (n = 64), мишей годували дієтою з високим вмістом жиру (HFD; 60% ккал жиру, дієта з коригуванням калорій, № TD.06414; Envigo). Після індукування ожиріння HFD протягом 2 тижнів мишей експериментальної групи знову випадковим чином розділили на сім груп (n = 8 для кожної групи): (1) група HFD, (2) група GC, позитивна контрольна група з ефектом зниження ваги Гарцинії камбоджійської водний екстракт (ГХ, 100 мг/кг/добу), 25 (3) група RGS, (4) група GG, (5) група SG31, (6) група SG11 та (7) група SG13. Всі екстракти (крім ГХ) перорально вводили мишам протягом 10 тижнів (200 мг/кг/день), і мишам надавали вільний доступ до дієти та води. Вага тіла, споживання їжі та споживання води реєструвались щотижня. Інституційний комітет з догляду та використання тварин (IACUC) Університету Халліма затвердив усі експериментальні плани та програми (Номер затвердження: Hallym 2018-61).
Забір зразків крові та органів
Після процесу перорального введення мишей голодували протягом 12 год і знеболювали 2,2,2-трибромметанолом та 2-метил-2-бутанолом (Sigma-Aldrich), а кров збирали з орбітальних вен. 26 Сироватку отримували центрифугуванням (3000 g протягом 15 хв при 4 ° C; центрифуга 5424R; Еппендорф, Гамбург, Німеччина) проби крові і зберігають при -70 ° C. Після забору зразків крові тканини органів видаляли і промивали фізіологічним розчином. Потім вологу видаляли, а висушені тканини органу зважували.
Аналіз біохімічних показників сироватки крові
Аналіз сироватки проводили, як описано раніше. 26 Аланін та аспартатамінотрансферази (ALT та AST) у сироватці крові тестували, щоб визначити, чи не викликав екстракт токсичність для печінки. TG, загальний холестерин (TC), ліпопротеїни високої щільності (HDL-C) та холестерин ліпопротеїдів низької щільності (LDL-C) вимірювали в сироватці як ліпідні компоненти. Крім того, додатково вимірювали рівень глюкози в сироватці крові (GLU). Всі показники тестували за допомогою автоматизованого аналізатора клінічної хімії (FUJI DRI-CHEM NX500i, Токіо, Японія).
Імуноблот-аналіз
Білки екстрагували з адипоцитів 3T3-L1 та жирової тканини епідидимуму після гомогенізації буфером RIPA (Thermo Fisher Scientific, Inc.). Загальну концентрацію білка визначали за кількісним процесом BCA (Thermo Fisher Scientific, Inc.). Потім 10 μг білків відокремлювали електрофорезом додецилсульфату натрію-поліакриламіду в гелі 10–12% (SDS-PAGE), а виділений білок передавали в мембрани PVDF із застосуванням напівсухої клітини для перенесення (Trans-Blot SD Cell; Bio-Rad, Hercules, Каліфорнія, США) при 15 В протягом 60 хв. Були використані такі антитіла: анти-кролик β-актин, активований проліфератором пероксисом рецептор-гамма (PPARγ), C/EBPα, Адипонектин, AMP-активована протеїнкіназа (AMPK), p-AMPK, ацетил-CoA карбоксилаза (ACC), p-ACC (Cell Signaling Technology, Danvers, MA, USA), SREBP-1c (білок 1c, що зв’язує регулюючий елемент стеролу) та карнітинпальмітоїлтрансфераза I (CPT-1; Санта Круз Біотехнологія, Даллас, Техас, США).
Статистичний аналіз
Дані виражали як середні значення ± стандартні відхилення та аналізували за допомогою одностороннього дисперсійного аналізу з використанням SPSS 25 (Статистичний пакет для соціальних наук, Inc.). Різниця між середніми показниками вважалася статистично значущою на P 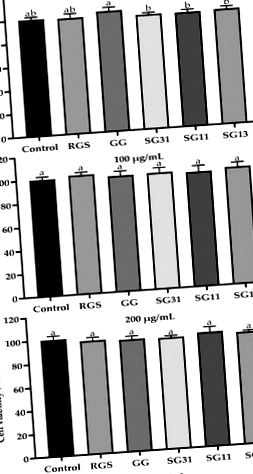
Фіг. 1. Вплив RGS, GG та їх суміші на життєздатність клітин преадипоцитів 3T3-L1. Значення представлені як середнє значення ± SD експериментів (n = 3). Різні букви вказують на суттєві відмінності середніх значень при P
Інгібуючий вплив RGS та/або GG на накопичення ліпідів
Інгібування RGS та/або GG при накопиченні ліпідів у клітинах 3T3-L1 показано на малюнку 2. Не було статистичної різниці між SG31, RGS та SG11. Однак у GG, RGS та їх трьох різних співвідношеннях змішування SG31 найбільш ефективно пригнічує накопичення ліпідів. Може існувати адитивний ефект між RGS та GG, коли співвідношення RGS у суміші було вищим порівняно з GG.
Фіг. 2. Інгібуючий вплив RGS, GG та їх суміші на накопичення ліпідів у адипоцитах 3T3-L1. Значення представлені як середнє значення ± SD експериментів (n = 3). (A) Післяконденсатні преадипоцити 3T3-L1 обробляли кожним екстрактом для накопичення тригліцеридів через 8 днів диференціації. (B) Масляно-червоне фарбування O на 8 день. Різні букви вказують на суттєві відмінності середніх значень при P
Вплив RGS та/або GG на експресію адипогенних та пов'язаних з ліпогену генів у адипоцитах 3T3-L1
Як показано на малюнку 3, лікування RGS або GG дещо знижує рівень експресії PPARγ порівняно з MDI (диференційоване середовище, що містить 10% FBS, 1% P/S, 0,5 мМ IBMX, 1 мкМ Dex та 10 мкг/мл інсуліну). SG31 збільшив ступінь PPARγ зменшення, хоча різниця в PPARγ зменшення між SG31 та RGS або GG не було статистично значущим. Подібним чином, лікування GG додатково знижувало рівень експресії C/EBPα порівняно з лікуванням РГС, хоча статистичної різниці між цими двома групами не було. Однак комбінація RGS і GG у різних пропорціях значно знижувала рівень експресії C/EBPα порівняно з MDI. На відміну від цього, GG не суттєво впливав на рівень експресії SREBP-1c порівняно з MDI, тоді як RGS значно знижував рівень експресії SREBP-1c, а SG31 ще більше знижував експресію SREBP-1c.
Фіг. 3. Вплив RGS, GG та їх суміші на рівні експресії фактора транскрипції адипоцитів 3T3-L1. Вестерн-блот-аналіз PPARγ, C/EBPα, і SREBP-1c проводили на 8 день диференціювання клітин. Значення представлені як середнє значення ± SD експериментів (n = 3). Різні букви вказують на суттєві відмінності середніх значень при P
Вплив RGS та/або GG на зміну ваги тіла, органів та споживання їжі у мишей із ожирінням C57BL/6J
Зміни маси тіла мишей показані на малюнку 4 та в таблиці 1. Не було різниці у масі тіла між кожною групою до початку експериментів. Після 10 тижнів перорального прийому вага групи HFD була в 1,49 рази важчою порівняно з групою NFD. Однак маса тіла груп RGS, SG31 та SG11 була значно легшою, ніж у групи HFD. Група SG31 набрала найменшу вагу, подібно до групи позитивного контролю.
Фіг. 4. Вплив RGS, GG та їх суміші на зміну маси тіла у мишей із ожирінням C57BL/6J, індукованих HFD. Значення представлені як середнє значення ± SD експериментів (n = 8). EtOH, етанол; GC, Гарцинії камбоджійської водний екстракт; GG, Glycyrrhiza glabra Екстракт Л. HFD, дієта з високим вмістом жиру; NFD, нормально-жирна дієта; RGS, корейська фракція червоного женьшеню сапоніну; SG11, суміш RGS і GG з масовим співвідношенням 1: 1; SG13, суміш RGS і GG з масовим співвідношенням 1: 3; SG31, суміш RGS і GG з масовим співвідношенням 3: 1.
Таблиця 1. Вплив фракції сапоніну корейського червоного женьшеню та/або Glycyrrhiza glabra Л. про зміни маси тіла мишей із ожирінням C57BL/6J з високим вмістом жиру
Значення представлені як середнє значення ± SD експериментів (n = 8). Різні літери вказують на суттєві відмінності між засобами на P
Таблиця 2. Вплив фракції сапоніну червоного женьшеню та/або Glycyrrhiza glabra Л. про споживання їжі, споживання води та споживання енергії у мишей C57BL/6J, індукованих дієтою
Значення представлені як середнє значення ± SD експериментів (n = 8). Різні літери вказують на суттєві відмінності між засобами на P
Таблиця 3. Вплив фракції сапоніну червоного женьшеню та/або Glycyrrhiza glabra L. про вагу нутрощів та жирових тканин у мишей із ожирінням C57BL/6J з високим вмістом жиру
Значення представлені як середнє значення ± SD експериментів (n = 8). Різні літери вказують на суттєві відмінності між засобами на P
Таблиця 4. Вплив фракції сапоніну червоного женьшеню та/або Glycyrrhiza glabra L. на сироватковому біомаркері у мишей із ожирінням C57BL/6J, які страждають від дієти
Значення представлені як середнє значення ± SD експериментів (n = 8). Різні літери вказують на значні відмінності між засобами на P
Фіг. 5. Вплив RGS, GG та їх суміші на білки, пов’язані з енергетичним метаболізмом, у мишей із ожирінням C57BL/6J, що страждають ожирінням. Значення представлені як середнє значення ± SD експериментів (n = 3). Різні букви вказують на суттєві відмінності середніх значень при P
Обговорення
Корейський женьшень містить різноманітні гінзенозиди, основними компонентами яких є Rb1, Rg1 та Rb2. 27 Ферментований корейський червоний женьшень не тільки збільшує вміст гінсенозидів, властивий корейському женьшеню, але також виробляє спеціальні гінзенозиди, такі як Rg2 та Rg3. 28,29 Сапонінова фракція женьшеню складається з різних гінзенозидів. 30 Ми збагатили гінзенозиди шляхом фракціонування сапонінів з екстракту червоного женьшеню та видалення цукру та білка. Основною діючою речовиною GG є тритерпеноїдний сапонін, який називається гліциризин (гліциризинова кислота або гліциризинат). 31,32 Він складається з двох молекул глюкуронової кислоти та однієї молекули гліциретинової кислоти. 33 Вміст гліциризину в ГГ становить приблизно 4–20%, залежно від регіону та сорту. 31–33
Основною причиною ожиріння є дисбаланс енергетичного обміну. Надлишок енергії збільшує накопичення ТГ у жировій тканині шляхом ліпогенезу. 34 Обидва PPARγ та C/EBPα є важливими факторами транскрипції, що регулюють диференціацію адипоцитів. 35 Вони точно регулюють диференціацію клітин, регулюючи різні нижні ферменти та гормони, 36 тоді як SREBP-1c регулює синтез ліпідів та холестерину, експресуючи множинні синтези ліпідів. Повідомляється, що 37 гінзенозиду Rg1, 38 Rg2, 39 Rg3, 40 Rb1, 41 та Rb2 42 пригнічують адипогенні фактори (такі як PPARγ, C/EBPα, та SREBP-1c). Система матричної металопротеїнази (ММР) може опосередковувати цю активність гінзенозидів. 42 Так та ін. 43 встановлено, що традиційна рослинна формула Ояксунгі-Сан (що містить гліциризин) може інгібувати утворення ліпідів у клітинах 3T3-L1, пригнічуючи адипогенні фактори. Хоча ці речовини впливають на різні шляхи, вони врешті-решт регулюють експресію адипоцитоспецифічних генів. У цьому дослідженні SG31, комбінація RGS та GG, суттєво пригнічувала накопичення TG в адипоцитах 3T3-L1, регулюючи C/EBPα та SREBP-1c.
SG31 може зменшити синтез та накопичення TG у печінці та жировій тканині за вищевказаним механізмом для зменшення ваги. Зниження рівня ТГ у сироватці крові може також свідчити про зменшення накопичення ліпідів. Зменшення ваги різних органів та жирової тканини в кінцевому рахунку може призвести до втрати ваги у мишей із ожирінням. SG31 не викликає цитотоксичності та не впливає на інші показники ліпідів у сироватці крові.
Суміш RGS та GG у співвідношенні 3: 1 демонструє посилені ефекти проти ожиріння, але ми не виключаємо, що більш різноманітні комбінації матимуть несподівані ефекти. Крім того, ми зробили висновок про можливий механізм проти ожиріння із сполук, що містяться в екстракті, і подальші дослідження потребують з'ясування біологічно активних ефекторів.
На закінчення, співвідношення RGS та GG у співвідношенні 3: 1 виявляло найвищу активність проти ожиріння. SG31 пригнічував накопичення TG в пробірці і в природних умовах. Це також зменшило масу органів, масу жирової тканини та масу тіла у мишей, спричинених ожирінням. Крім того, SG31 знижував експресію адипогенних/ліпогенних факторів транскрипції та активував шлях AMPK, додатково покращуючи баланс енергетичного обміну. Хоча механізм адитивного ефекту між RGS та GG в даний час незрозумілий, наші результати вказують на те, що SG31 може бути розроблений як функціональний харчовий інгредієнт для профілактики ожиріння.
Заява про розкриття інформації про автора
Автори заявляють, що конфлікту інтересів немає.
Інформація про фінансування
Це дослідження було підтримане Фондом досліджень університету Халліма, 2019 (HRF-201907-010).
- Захоплення анорексією серед корейських дівчат викликає занепокоєння
- Ефект проти ожиріння екстракту з ферментованої Curcuma longa L
- Проти ожиріння та протизапальний ефект женьшенного оцту при дієті з високим вмістом жиру, яку годували мишами SpringerLink
- Протидіабетична дія мілдронату окремо або в поєднанні з метформіном у пацуків Цукера із ожирінням -
- Ефекти проти ожиріння екстракту гарячої води та екстракту часнику з високим гідростатичним тиском у щурів