Під шкірою: іксодові кліщі в підшкірній клітковині рудих лисиць (Vulpes vulpes) з Німеччини
Мая Хаут
1 Інститут гігієни тварин та ветеринарного здоров'я, факультет ветеринарної медицини, Лейпцизький університет, An den Tierkliniken 1, 04103 Лейпциг, Німеччина
Ніна Круль
1 Інститут гігієни тварин та ветеринарного здоров'я, факультет ветеринарної медицини, Лейпцизький університет, An den Tierkliniken 1, 04103 Лейпциг, Німеччина
Анна Об'єгала
1 Інститут гігієни тварин та ветеринарного здоров'я, факультет ветеринарної медицини, Лейпцизький університет, An den Tierkliniken 1, 04103 Лейпциг, Німеччина
Йоганнес Сігер
2 Інститут анатомії, гістології та ембріології, факультет ветеринарної медицини, Лейпцизький університет, An den Tierkliniken 43, 04103 Лейпциг, Німеччина
Мартін Пфеффер
1 Інститут гігієни тварин та ветеринарного здоров'я, факультет ветеринарної медицини, Лейпцизький університет, An den Tierkliniken 1, 04103 Лейпциг, Німеччина
Пов’язані дані
Дані, що підтверджують висновки цієї статті, включені до статті. Неопрацьовані дані, використані та/або проаналізовані під час цього дослідження, можна отримати у відповідного автора за обґрунтованим запитом.
Анотація
Передумови
Ixodes spp. є переносниками зоонозних збудників. Для розвитку всіх трьох активних стадій життя (личинки, німфи, дорослі особини) потрібно харчуватися господарем. Зазвичай кліщі паразитують, прикріплені до зовнішньої поверхні шкіри господаря. Цікаво, що в деяких випадках кліщі також можуть бути виявлені в підшкірній клітковині у різних господарів, таких як червоні лисиці (Vulpes vulpes), єнотовидні собаки (Nyctereutes procyonoides) та собаки.
Методи
Вісцеральний бік 126 рудих лисиць з Німеччини оглядали візуально в пошуках кліщів. Локалізація кліщів була зафіксована і призначена для десяти конкретних частин тіла. Морфологічна ідентифікація кліщів проводилась згідно стандартизованих таксономічних протоколів. Кліщів, яких неможливо було ідентифікувати далі, досліджували генетично за допомогою звичайної ПЛР, націленої на ген 16S рРНК та ген cox1. Для гістопатологічного дослідження застосовували фарбування гематоксиліном та еозином (H&E).
Результати
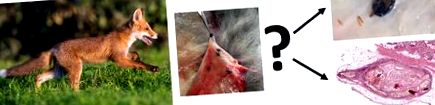
У 111 із 126 (88,1%) обстежених пальто принаймні один кліщ був виявлений у підшкірній клітковині. Загалом з підшкірної клітковини було видалено 1203 кліща. Добре збережених кліщів можна було ідентифікувати на основі морфологічних критеріїв, але більшість кліщів були в прогресуючому стані розкладання. Тут морфологічна ідентифікація видів не була успішною. Крім того, методи ПЛР не призвели до успішної ідентифікації видів. За допомогою морфологічної ідентифікації були виявлені такі види та стадії розвитку: Ixodes ricinus (самка, n = 289; самець, n = 8; німфа, n = 1), I. hexagonus (самка, n = 2), I. canisuga (самка, n = 1). Самці I. ricinus були знайдені поодиноко або копулюються в парі з самками. Підшкірні кліщі локалізувались у трьох переважаючих уражених частинах тіла: вухах, пахвовій та паховій області. Гістологічне дослідження підшкірних кліщів виявило гранулематозний паннікуліт.
Висновки
Наскільки відомо авторам, це перша знахідка дуже поширених підшкірних кліщів у рудих лисиць з Німеччини. Підшкірне розташування кліщів здається дуже поширеним явищем у рудих лисиць, і це правило, а не виняток. Глибоке залягання лонгістростри та тривалий час годування самок, здається, сприяє підшкірному розташуванню. Більшість лисиць були заражені в паховій області, де шкіра тонка і менш волохата.
Передумови
Кліщі, що належать до родів Ixodes та Dermacentor (сімейство: Ixodidae), є найбільш поширеними в Європі [1]. На всіх активних стадіях життя кліщів (шестинога личинка, восьминога німфа та самки) для линьки (незрілі особини) або для яйцекладки (самки) потрібні кров’яні страви, за винятком самців, які харчуються факультативно та локалізуються на господарях головним чином для спаровування цілі [1, 2].
У Німеччині часто лисиць збирають види Ixodes ricinus, I. hexagonus, I. canisuga та I. kaiseri [3–8]. Крім того, іноді виявляли Dermacentor reticulatus та Haemaphysalis concinna, прикріплені до шкіри рудих лисиць [7, 9]. Кліщі зазвичай міцно прикріплюються до зовнішньої поверхні своїх господарів, щоб залишатися на місці для кров’яного борошна. Тим самим ротовий апарат кліща проникає в різні шари шкіри залежно від їх довжини. Кліщі з довгими ротовими апаратами (лонгістростра, наприклад, Амбліома, Гіаломма та Іксодес), вбудовані в глибокі шари дерми, тоді як кліщі з короткими ротовими апаратами (бревіростра, наприклад, Dermacentor, Haemaphysalis та Rhipicephalus) ледве проникають в епідерміс [10, 11]. Личинки Ixodes ricinus прикріплюються протягом 2–4 днів, німфи - 4–6 днів, самки - 6–10 днів [12].
Цікаво, що в деяких випадках кліщі також можуть бути виявлені в підшкірній клітковині у різних господарів, включаючи рудих лисиць. Наявність підшкірних кліщів, таких як I. ricinus, I. hexagonus, I. crenulatus та D. reticulatus, було відзначено у рудих лисиць у кількох тематичних дослідженнях з Великобританії, Польщі, Австрії, Румунії, Словаччини та Чехії [13–20] . У США місцевий вид кліща Amblyomma americanum був також виявлений у підшкірній клітковині рудих лисиць [21].
Окрім рудих лисиць, раніше реєструвались випадки підшкірних кліщів у єнотовидних собак (Nyctereutes procyonoides) з Польщі [22], у собаки зі Швеції [23] та у дитини з Південної Кореї [24].
До цього часу в більшості випадків повідомлялося про невеликі розміри вибірки, а також як про випадкові знахідки [13–17, 21]. На даний момент опублікованих даних про підшкірних кліщів у рудих лисиць та інших тварин з Німеччини не існує. Ось чому це дослідження має на меті оцінити частоту підшкірного кліща у рудих лисиць з Німеччини за допомогою великої кількості зразків. Локалізація підшкірних кліщів на різних ділянках тіла рудої лисиці ще не аналізована; тому ми задокументували локалізацію кожного кліща, щоб визначити чисельність цих кліщів у підшкірній клітковині. Точна ідентифікація видів підшкірних кліщів на основі морфологічних критеріїв можлива лише в обмеженій мірі внаслідок прогресивного процесу деградації в підшкірній клітковині, як це видно з попередніх досліджень [18]. Отже, це дослідження спрямоване на використання методів молекулярної біології для виявлення підшкірних кліщів до видового рівня.
Методи
Колекція тварин
У період з листопада 2018 року по лютий 2019 року місцеві мисливці під час традиційного полювання відстрілювали рудих лисиць та іншу дичину. У співпраці зі скребковою станцією (Фельвехсель, Берлін, Німеччина) місцеві мисливці з усієї Німеччини здавали тушки лисиць у поліетиленові пакети з маркуванням дати та точного географічного розташування в морозильних камерах. Мисливцями відбиралися лише дорослі лисиці з хорошим поживним статусом. Тіла лисиці зберігали при - 80 ° C до лущення. Для проведення гістологічних досліджень одній лисиці зняли шкіру безпосередньо після полювання.
Збір та ідентифікація кліщів
Вісцеральну сторону кожного хутра візуально досліджували на наявність підшкірних кліщів. Локалізацію кліщів реєстрували на заздалегідь намальованій схематичній картинці і призначали десяти конкретним частинам тіла (вуха, шия, пахвова область, плече, спина, живіт, пахова область, аноректальна область, ноги та хвіст) з метою створення тіла карта щільності кліщів (рис. 1), як рекомендували Lydecker et al. [25]. Потім кліщів окремо видаляли з підшкірної клітковини за допомогою щипців із тонкими наконечниками та скальпелем та зберігали при - 20 ° C (рис. 2). Добре збережених кліщів можна було ідентифікувати на основі морфологічних критеріїв згідно зі стандартизованими таксономічними протоколами [26] під бінокуляром із збільшенням 50 × (Motic SMZ-171, Motic Deutschland GmbH, Wetzlar, Німеччина).
Щільність кліщів виражається як відсоток від загальної кількості кліщів залежно від області тіла (n = 111 рудих лисиць). Темніший сірий на малюнку вказує на більшу щільність кліщів
Макроскопічний огляд кліщів з підшкірною локалізацією. a Один кліщ піднімали щипцями з дрібним наконечником та інші кліщі в навколишній тканині. b Кліщі на запущених стадіях розкладання. c Добре збережені кліщі в спинному (чорна стрілка) та черевному положенні (червона стрілка)
Екстракція ДНК та методи ПЛР
Кліщі, яких неможливо було морфологічно ідентифікувати, були додатково оброблені звичайною ПЛР для їх ідентифікації до видового рівня. Для вилучення ДНК до кожного кліща додавали 1 г сталевих гранул (розміром 2,8 мм) та 500 мкл PBS. Потім зразки гомогенізували при 5000 × об/хв протягом 2 × 15 с з інтервалами перерви 15 с у гомогенізаторі тканини Precellys®24 (Bertin Technologies, Montigny Le Bretonneux, Франція).
Геномну ДНК витягували за допомогою набору QIAamp DNA Mini Kit (Qiagen, Hilden, Німеччина), дотримуючись вказівок виробника. ПЛР-ампліфікації гена частково цитохрому с-оксидази 1 (cox1) (710 bp) та гена 16S рибосомної рибонуклеїнової кислоти (rRNA) (455 bp) проводили за допомогою раніше опублікованих протоколів PCR [8, 27]. Продукти ПЛР візуалізували за допомогою гель-електрофорезу на 2% -них агарозних гелях, забарвлених HDGreen Plus DNA Stain (Intas Science Imaging Instruments GmbH, Геттінген, Німеччина).
Гістологічне дослідження підшкірної клітковини
Статистичний аналіз
Довірчі інтервали (95% ДІ) для рівня поширеності підшкірних кліщів та їх стадії життя визначали методом Клоппера та Пірсона з програмним забезпеченням GraphPad (GraphPad Software Inc., Сан-Дієго, Каліфорнія, США). Для порівняння різних областей тіла використовували U-тест Манна-Уітні з рівнем значимості α = 0,05. Незалежність порівняних малих розмірів вибірки (n 3). Загалом з підшкірної клітковини було видалено 1203 кліща. Морфологічні особливості Ixodidae, такі як наявність дорсальної мокроти або ротових відділів, прикріплених спереду та видимих дорсально, були присутні у всіх виявлених кліщів. Більшість кліщів (n = 902; 75%) перебували в стадії розкладання, і стадію розвитку, а також рівень виду визначити не вдалося. Однак були дотримані конкретні критерії, щоб віднести кліщів до сімейства Ixodidae. У цих випадках ідентифікація видів за допомогою молекулярно-біологічних методів не була успішною. Добре збережені кліщі (n = 301; 25,0%) можна ідентифікувати до видового рівня на основі морфологічних критеріїв. Виявлено такі види та стадії розвитку (табл. 1): Ixodes ricinus (самка, самець, німфа); I. hexagonus (самка); I. canisuga (самка). Найпоширенішою стадією життя були жінки (97,0%; n = 292/301, 95% ДІ: 94,40–98,62%), а потім чоловіки (2,7%; n = 8/301, 95% ДІ: 1,15–5,17%) та німфи (0,3%; n = 1/301, 95% ДІ: 0,01-1,84%). Самки найчастіше ідентифікували як I. ricinus (99,0%; n = 289/292, 95% ДІ: 97,03–99,79%). Усі кліщі-самці належали до I. ricinus і в основному були знайдені як пари, що спаровуються з самками (n = 6/8), але також окремо (n = 2/8).
Розподіл вантажу кліщів різнився між 1 і 79, загалом можна було видалити 1203 кліща. Більшість лисиць були заражені лише невеликою кількістю кліщів
Таблиця 1
Види кліщів і стадії життя добре збережених кліщів, що знаходяться в підшкірній клітковині
| I. ricinus | 298 (99,0) | 8 | 289 | 1 |
| І. шестикутник | 2 (0,7) | 2 | ||
| І. canisuga | 1 (0,3) | 1 | ||
| Всього (%) | 301 (100) | 8 (2,7) | 292 (97,0) | 1 (0,3) |
Підшкірна локалізація кліщів
Підшкірні кліщі були локалізовані на всіх 10 визначених частинах тіла. Важливо, що більшість кліщів було виявлено в паховій області порівняно з усіма іншими областями тіла (U (2268) = 262431,00, Z = - 26,629, P 2). Другою та третьою за поширеністю областю тіла були області навколо вух та пахвових западин. Загалом у цих трьох областях тіла спостерігалося 80,2% (n = 964) усіх зібраних кліщів (рис. 1). Подальші регіони продемонстрували значно менший тягар підшкірних кліщів (U (5292) = 2072521,50, Z = - 30,909, P 4). Лише один кліщ був віднесений до категорії 1, 11 належав до категорії 2, а 11 - до категорії 3. Кліщі категорії 1 були оточені помірним гранулематозним запаленням підшкірної жирової клітковини (паннікуліт), що складається з гістіоцитів, макрофагів, багатоядерних гігантських клітин та еозинофілів . Нейтрофіли бачили лише зрідка. Легка шкірна запальна реакція була присутня з легким екзоцитозом запальних клітин в епідермісі. Гістіоцити, макрофаги та еозинофіли були найпоширенішими спостережуваними клітинами. Крім того, були виявлені помірний епідермальний між- та внутрішньоклітинний набряк та помірний пластинчастий ортокератотичний гіперкератоз. Були наявні внутрішньошкірні та внутрішньорогові пустули, наповнені переважно нейтрофілами і рідко макрофагами.
Висока ступінь деформації кліщів була помітна на більшості гістологічних зрізів. Наявність кліщів категорії 2 призвело до легкого гранулематозного паннікуліту, що складається з гістіоцитів, макрофагів, багатоядерних гігантських клітин, еозинофілів та розріджених нейтрофілів.
У внутрішній частині кліщів категорії 1 і 2 не вдалося ідентифікувати жодної м’якої тканини членистоногих, а також ніяких клітинних структур не було впізнано. Розбитий екзоскелет кліщів, що належать до категорії 3, був заповнений змішаним запальним клітинним інфільтратом, що складається з гістіоцитів, макрофагів та багатоядерних гігантських клітин. Ці кліщі були оточені важким гранулематозним паннікулітом без запальних змін дерми та епідермісу.
Гістологічне дослідження кліщів з навколишніми тканинами та шкірою підтвердило підшкірну локалізацію. Спостерігалося посилення еозинофільного гранулематозного запалення з категорії 1 до 3. Під час гістопатологічного дослідження не спостерігалось продуктів розпаду крові.
Обговорення
Лисиці є важливими господарями для різноманітних ендо- та ектопаразитів, а отже, резервуарами для збудників тварин та зоонозів [28]. Спостережувана поширеність підшкірних кліщів (88,1%) у цьому дослідженні вища, ніж у Польщі (38%) [20] та Чехії/Румунії (15,4%) [18]. Більше того, поширеність підшкірних кліщів вища порівняно із поширеністю зовнішніх кліщів у рудих лисиць з Італії (7,4%) [29] та Румунії (53,9%) [30], але збігається з дослідженнями Іспанії (51,1–84,6%) [ 31–33] та Німеччини (76,5–82,6%) [7, 34]. Крім того, інтенсивність зараження підшкірними кліщами (середнє значення = 10,8) у цьому дослідженні подібна до зовнішніх кліщів в іншому дослідженні, яке вивчало 1268 лисиць у Німеччині (середнє значення = 11,7) [34]. У цьому дослідженні 50,9% лисиць були заражені максимум 5 кліщами на їх зовнішній поверхні, тоді як у цьому дослідженні 43,2% лисиць були заражені максимум 5 кліщами. Однак у деяких випадках як підшкірних, так і зовнішніх кліщів багато разів збирали у кількох лисиць (3,6–5,7%) з більш ніж 50 кліщами на лисицю [7].
В Європі відомо, що кілька кліщів родів Ixodes, Dermacentor, Haemaphysalis, Hyalomma та Rhipicephalus паразитують на червоних лисицях [7, 8, 29, 31, 32]. У Німеччині I. ricinus, I. hexagonus, I. canisuga та I. kaiseri зазвичай збирали у лисиць, тоді як D. reticulatus та H. concinna іноді знаходили [7, 9]. Відповідно, ми виявили у підшкірній клітковині три згадані раніше лонгіростральні види (I. ricinus, I. hexagonus та I. canisuga). Подібним чином раніше опубліковані дані США та Чехії/Румунії показують регіональні відмінності видів кліщів у підшкірній клітковині залежно від пануючої фауни кліщів [18, 20, 21].
- Під шкірою іксодові кліщі в підшкірній клітковині рудих лисиць (Vulpes vulpes) з Німеччини
- Картинки діабету та шкіри типу 2, дермопатія, інфекції та багато іншого
- Чому вісцеральний жир гірший за підшкірний жир
- Що спричиняє втрату обсягу обличчя за допомогою лазерного догляду за шкірою
- Як виглядає позитивний тест на туберкульоз