Пероральне доповнення діабетичних мишей прополісом відновлює проліферативну здатність і хемотаксис В і Т лімфоцитів до CCL21 та CXCL12 шляхом модуляції ліпідного профілю, рівня запальних цитокінів та окисного стресу.
Анотація
Передумови
Цукровий діабет 1 типу (T1D) - це хронічне аутоімунне захворювання, спричинене селективним руйнуванням β-клітин підшлункової залози, супроводжуваним гіперглікемією, окислювальним стресом та подальшим значним порушенням функцій імунних клітин, явищем, відповідальним за розвиток хронічних ускладнень діабету. Прополіс, натуральний продукт бджільництва, який широко використовується у харчових продуктах та напоях, суттєво корисний для здоров’я людини. Зокрема, прополіс надає антиоксидантну, протизапальну та знеболюючу дію, що може покращити ускладнення діабету. Для подальшого з'ясування потенційних переваг прополісу в цьому дослідженні досліджено вплив дієтичних добавок прополісом на профілі цитокінів у плазмі крові, рівень вільних радикалів, профіль ліпідів та проліферацію лімфоцитів та хемотаксис у моделі діабетичної миші типу I, спричиненої стрептозотоцином (STZ).
Методи
Тридцять мишей-самців розподілили порівну на 3 експериментальні групи: група 1 - недиабетичні контрольні миші; група 2, миші з діабетом; та група 3, діабетичні миші щодня отримували розчинний у етанолі похідний прополісу (100 мг/кг маси тіла) протягом 1 місяця.
Результати
По-перше, індукція діабету у мишей була пов’язана з гіперглікемією та значним зниженням рівня інсуліну та кількості лімфоцитів. У цьому контексті у діабетичних мишей спостерігалися важкі діабетичні ускладнення, що було продемонстровано значним зниженням рівнів IL-2, IL-4 та IL-7, тривалим підвищенням рівнів прозапальних цитокінів (IL-1β, IL- 6 та TNF-α) та активних форм кисню (АФК) та змінених профілів ліпідів порівняно з контрольними мишами, які не страждають на діабет. Більше того, антигенна стимуляція В і Т-лімфоцитів помітно знижувала проліферативну здатність та хемотаксис цих клітин до CCL21 та CXCL12 у мишей з діабетом у порівнянні з контрольними мишами. Цікаво, що порівняно з індукцією діабету, лікування діабетичних мишей прополісом значно відновлює рівень цитокінів та АФК у плазмі крові та рівень ліпідів до майже нормальних рівнів. Найголовніше, що порівняно з нелікованими мишами з діабетом, у мишей з діабетом, які отримували прополіс, спостерігалося значно посилене розмноження лімфоцитів та хемотаксис до CCL21 та CXCL12.
Висновок
Отримані нами результати виявляють потенційні імуномодулюючі ефекти прополісу, який діє як природний антиоксидант для посилення функції імунних клітин під час діабету.
Передумови
Цукровий діабет 1 типу (T1D) є хронічним Т-клітинним аутоімунним захворюванням, яке призводить до руйнування β-клітин, що секретують інсулін [1]. Цукровий діабет асоціюється з численними порушеннями обміну речовин, що характеризуються гіперглікемією, що супроводжується кількома ускладненнями [2], що виникають в результаті абсолютного або відносного дефіциту секреції або дії інсуліну [3]. Дисліпідемія є загальною рисою діабету, який характеризується підвищеним рівнем тригліцеридів та рівня ліпопротеїдів низької щільності (ЛПНЩ) (ЛПНЩ-С) [4]. Гіперглікемія або дисліпідемія легко спричиняють великий окислювальний стрес, що спричиняє серйозні порушення клітинної функції у хворих на цукровий діабет [5, 6]. Постійна гіперглікемія збільшує продукцію вільних радикалів, особливо активних форм кисню (АФК), у декількох тканинах [7]. Збільшення перекисного окислення ліпідів, що характеризується підвищенням рівня малонового діальдегіду (МДА), призводить до утворення зшивок між окремими молекулами в білках та окислення часток ЛПНЩ; окислений ЛПНЩ є найпоширенішим маркером окисного стресу [8, 9].
Запалення при аутоімунних захворюваннях характеризується дисбалансом між про- та протизапальними цитокінами. Прозапальні цитокіни шкідливо впливають на чутливість до інсуліну та функцію β-клітин [10]. Цікаво, що змінений рівень цитокінів погіршує секрецію інсуліну в β-клітинах [11], і накопичення доказів підтверджує, що діабет є захворюванням вродженої імунної системи [11, 12]. Крім того, діабет збільшує продукцію прозапальних цитокінів, включаючи IL-1α, IL-1β, IL-6 та CXCL10 [13, 14]. Однак основними цитокінами, що беруть участь у патогенезі діабету, є IL-1, TNF-α та IL-6 [15]. Порушення продукування IL-1, IL-6, TNF-α та IFN-γ та підвищена продукція IL-10 у культурах мононуклеарних клітин периферичної крові діабету 1 типу (PBMC) можуть свідчити про дефіцит активації мононуклеарних клітин та адаптації клітин імунної клітини. відповіді [16].
Діабетичні ускладнення та погіршення імунної відповіді є проблемами в клінічному лікуванні T1D; таким чином, необхідна розробка більш ефективних стратегій лікування. Прополіс - смолистий природний матеріал, що виробляється бджолами із зібраних ексудатів і бруньок рослин, змішаних з воском та ферментами бджіл [26]. Прополіс має кілька біологічних та фармакологічних властивостей, таких як імуномодулююча, протипухлинна, протизапальна, антиоксидантна, антибактеріальна та противірусна дії [27–30]. Однак механізми, за допомогою яких прополіс модулює імунну систему під час діабету, залишаються недостатньо вивченими. Тому поточне дослідження було проведене для вивчення безпосереднього впливу добавок прополісу на порушену функцію В і Т-лімфоцитів під час T1D.
Матеріали і методи
Приготування прополісу
Хімікати
Стрептозотоцин (STZ) був отриманий компанією Sigma Chemicals Co. (Сент-Луїс, Міссурі, США). STZ розчиняли в холодному 0,01 М цитратному буфері (pH 4,50), який за необхідності готували свіжо (протягом 5 хв).
Тварини та індукція діабету
Збір зразків
Цілу кров збирали з черевної аорти і негайно переносили в гепаринізовані пробірки. Потім кров центрифугували при 4000 × g протягом 10 хв за допомогою настільної центрифуги (MSE Minor, Англія) для видалення еритроцитів і відновлення плазми. Зразки плазми відокремлювали, збирали за допомогою сухих піпеток Пастера і зберігали при -80 ° C до використання. Після ізоляції плазми РВМС виділяли методом градієнта Фіколя. Свіжоізольовані РВМС культивували в середовищі RPMI 1640, доповненій 10% -ною фетальною телячою сироваткою (FCS) та HEPES (середовище R-10), принаймні за 4 години до початку експериментів.
Аналіз крові
Рівні глюкози в крові визначали за допомогою датчика AccuTrend (Roche Biochemicals; Мангейм, Німеччина). Luminex (Biotrend; Дюссельдорф, Німеччина) використовували для аналізу рівня інсуліну в сироватці відповідно до інструкцій виробника.
Вимірювання рівня вільних радикалів
Рівні АФК визначали в аспіраті кісткового мозку, лізаті тканин селезінки, лізаті тканин крові та печінки, використовуючи 2,7-дихлорідідріфлуоресцеїндіацетат (H2DCF-DA) (Інститут біотехнології Бейотіме, Хаймен, Китай). Окислення 2’-7 ’дихлорфлуоресцину (H2DCF) до 2’-7’дихлорфлуоресцеїну (DCF) досить широко використовується для кількісного визначення H2O2. Діацетатна форма, H2DCFDA та її ацетометиловий ефір H2DCFDA-AM поглинаються клітинами, де неспецифічні клітинні естерази діють на неї, щоб відщепити ліпофільні групи, в результаті чого заряджена сполука потрапляє всередину клітини. Окислення H2DCF методом АФК перетворює молекулу на 2 ’, 7’ дихлорідігідрофлуоресцеїн (DCF), який є сильно флуоресцентним. Повідомлені довжини хвиль для вимірювання флуоресценції DCF становлять 498 нм для збудження та 522 нм для випромінювання.
Аналіз ліпідного профілю
Ліпідні профілі визначали за допомогою наборів BioMerieux за допомогою стандартного методу аналізу. Рівні холестерину оцінювали методом холестеринової естерази. Ліпопротеїни високої щільності ЛПВЩ, ХС ЛПНЩ та хіломікрони осаджували фосфовольфрамовою кислотою. Кількість холестерину, зв’язаного з ЛПВЩ, визначали за допомогою методу холестериноксидази та методу фосфовольфрамової солі магнію за допомогою холестеринового Е-тесту (Wako, Osaka, Japan).
Визначення рівня цитокінів у плазмі крові
Профілі цитокінів у плазмі крові оцінювали у трьох примірниках, використовуючи зразки, які зберігали при -80 ° C. Рівень IFN-α у плазмі вимірювали за допомогою комерційного ІФА (PBL, Piscataway, NJ) відповідно до інструкцій виробника. Рівні IL-1β, IL-2, IL-4, IL-6, IL-7, IL-8, IL-10 та TNF-α у плазмі крові вимірювали методом ІФА із застосуванням набору для аналізу цитокінів на щурах Bio (Ple -Rad, Геркулес, Каліфорнія) відповідно до інструкцій виробника.
Проточна цитометрія
Експресію антигенів клітинної поверхні на ізольованих РВМС визначали за допомогою однопараметричного аналізу сортування клітин, активованого флуоресценцією (FACS), використовуючи наступні моноклональні антитіла (mAbs): (i) кон'югований РЕ анти-CD45R/B220 та РЕ-кон'югований ізотип контрольні mAbs (всі придбані у R&D Systems, Франція) та (ii) ефір карбоксифлуоресцеїну сукцинімідилу (CFSE, Invitrogen). Для збору та аналізу даних використовували проточний цитометр FACSCalibur (BD-Pharmingen). Після встановлення воріт, що включають лише життєздатні клітини, було зібрано та проаналізовано 104 події на зразок. Для кожного маркера поріг позитивності був визначений відносно неспецифічного зв’язування, яке спостерігалося у присутності відповідного контрольного ізотипу mAb.
Аналіз поширення CFSE
Ізольовані PBMC з різних груп мишей збирали, двічі промивали PBS і фарбували 0,63 мкМ CFSE (Molecular Probes, Eugene, OR) протягом 8 хвилин при RT. Залишковий CFSE видаляли за допомогою трьох промивань PBS. Мічені CFSE клітини висівали в 6-лункові планшети і стимулювали або IL-4 і CD40L (для стимуляції В-клітин), або 10 нг/мл стафілококового ентеротоксину В (SEB) (для стимуляції Т-клітин); контрольні клітини не стимулювались. Потім клітини вирощували протягом 4 днів у середовищі для живлення клітин. Через 4 дні в культурі клітини збирали, фарбували кон'югованим РЕ анти-CD45R/B220 mAb і фіксували в 300 мкл 1x PBS, що містить 1% формальдегіду. Інтенсивність флуоресценції CFSE вимірювали за допомогою проточної цитометрії за допомогою проточного цитометра FACSCalibur (BD-Pharmingen).
В пробірці міграційний аналіз
Хемокінозалежну міграцію РВМС, виділених з різних груп мишей, вимірювали, використовуючи в пробірці двокамерний аналіз міграції (з використанням пластин Transwell, придбаних у Costar, Кембридж, Массачусетс) з подальшим проточним цитометричним аналізом. Коротко кажучи, 600 мкл міграційного буфера окремо або доповненого CCL21 та CXCL12 (обидва при 500 нг/мл; Системи досліджень та досліджень) додавали до нижньої камери, а 10 4 клітини, суспендовані в міграційному буфері, додавали до верхньої камери. Потім планшети інкубували протягом 3 годин при 37 ° С, а вхідні клітини та переселені клітини центрифугували, фарбували кон'югованим РЕ анти-CD45R/B220 mAb, фіксували в 300 мкл 1x PBS, що містить 1% формальдегіду, і підраховували протягом 60 секунд за допомогою проточної цитометрії за допомогою проточного цитометра FACSCalibur (BD-Pharmingen). Відсоток міграції обчислювали як відсоток вхідних комірок, які мігрували в нижню камеру. Для розрахунку зміни відсотка міграції, індукованого хемокінами, відсоток клітин, які мігрували лише до середовища, віднімали від відсотка клітин, які мігрували до середовища, що містить хемокіни.
Статистичний аналіз
Дані перевіряли на нормальність (за допомогою тесту Андерсона-Дарлінга) та дисперсійну однорідність перед подальшим статистичним аналізом. Дані зазвичай розподілялись і виражались як середнє значення ± стандартна похибка середнього значення (SEM). Суттєві відмінності між групами аналізували за допомогою одностороннього дисперсійного аналізу (для більш ніж двох груп), за яким слідував посттест Тьюкі із використанням програмного забезпечення SPSS версії 17. Різниці вважалися суттєвими * P + P # P
Результати
Характеристика моделі діабетичної тварини та ускладнень діабету до та після прийому всередину прополісу
Спочатку ми контролювали зміни маси тіла, біохімічних показників крові та кількості лейкоцитів у всіх групах тварин протягом експериментального періоду. Лікування мишей STZ призвело до помітного зниження рівня інсуліну та тяжкої гіперглікемії, яка все ще виявлялася протягом експерименту. Через два тижні після ін’єкції STZ та до прийому прополісу у діабетичних мишей спостерігалося значне зниження маси тіла, рівня лейкоцитів та лімфоцитів порівняно з контрольними тваринами, які не хворіли на діабет (*P Таблиця 1 Вплив індукції діабету STZ та добавок прополісу мишам-діабетикам на масу тіла та біохімічні показники крові
Лікування діабетичних мишей прополісом протягом 4 тижнів було чітким та значущим (# P # P # P # P Таблиця 2 Вплив введення прополісу мишам-діабетикам на рівень глюкози, інсуліну та цитокінів у плазмі крові
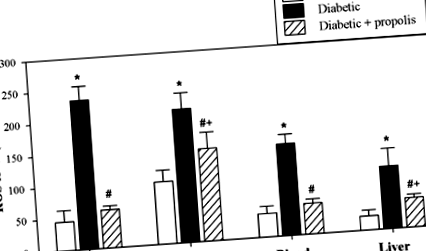
Лікування діабетичних мишей прополісом знижувало рівень вільних радикалів у різних органах
Рівні АФК були виявлені в плазмі та в тканинних лізатах кісткового мозку (первинний лімфоїдний орган та походження всіх імунних клітин), селезінці (вторинний лімфоїдний орган, який є місцем розпізнавання антигену) та печінці. Накопичені дані від 10 індивідуальних мишей з кожної групи наведені на рис. 1. Рівні АФК у діабетичних мишей були значно вищими, ніж у контрольних мишей (*P # P Рис. 1
Діабетичні миші демонструють помітно змінені ліпідні профілі, демонструючи тенденцію до аномального ожиріння
Індукція діабету зазвичай асоціюється з дисліпідемією, явищем, що характеризується зміною ліпідних профілів плазми крові та підвищеним ризиком серцево-судинних захворювань. Тому ми проводили моніторинг ліпідних профілів у 3 групах тварин. Накопичені дані від 10 індивідуальних мишей з кожної групи наведені на рис. 2. Рівень ЛПНЩ і загального холестерину в плазмі крові діабетичних мишей був значно вищим, ніж у контрольних мишей без діабету (*P # P Рис.2
Лікування мишей-діабетиків прополісом посилює антигенну стимуляцію та проліферацію В і Т-лімфоцитів
Добавка мишей з діабетом прополісу посилює хемотаксис, опосередкований CCL21- і CXCL12, у В- і Т-лімфоцитах
Обговорення
Більше того, пероральне введення екстракту прополісу суттєво пригнічувало рівень глюкози в крові та сприяло зменшенню дисліпідемії у діабетичних щурів [47]. Підтверджено, що прополіс, який виявляє сильну антиоксидантну активність, пригнічує рівень МДА та підвищує антиоксидантну активність на моделях тварин із діабетом та у пацієнтів людини [48–50]. Діабетичні ускладнення в першу чергу пояснюються підвищенням рівня АФК через гіперглікемію [51, 52]. Клінічні випробування також показали, що покращення окисного стресу може запобігти прогресуванню обох типів діабету [53, 54].
Важливо, що T1D сприяє тривалому запаленню, яке характеризується порушенням імунної відповіді через підвищений рівень IL-1β, IL-6 та TNF-α [55, 56]. Тому націлювання на медіатори запалення було запропоновано як ефективну стратегію для поліпшення імунної відповіді та модуляції запалення у хворих на цукровий діабет. У цьому дослідженні ми показали, що добавки прополісу скасовували запальний процес, пов’язаний з діабетом, і відновлювали рівні IL-1 β, IL-6 та TNF-α до майже нормальних рівнів. Показано, що прополіс безпосередньо пригнічує вироблення цитокінів імунними клітинами [57]. Хаял та ін. (2003) показали, що введення водного екстракту прополісу для лікування запальних захворювань знижує рівень прозапальних цитокінів (TNF-α та IL-6) [58].
Висновки
Наші дані свідчать про те, що лікування прополісом підвищує ефективність В- та Т-клітинних хемотаксисів у мишей з діабетом. Взяті разом, наші дані свідчать про те, що прополіс послаблює аномальні ліпідні профілі, окислювальний стрес, запалення та порушення проліферації та міграції лімфоцитів до хемокінів, щоб підтримувати ефективну імунну відповідь лімфоцитів. Тому використання прополісу є потенційною стратегією лікування діабетичних ускладнень.
- Добавки олії минтаю модулюють гіперліпідемію та покращують стеатоз печінки у мишей, яких годували
- Нові правила Південна Корея розширює формати прополісу для прийому всередину, скасовує верхню межу функціональних інгредієнтів
- Повні чоловічі миші виробляють більше імунних клітин, що стимулюють захворювання, ніж самки Мічиганської медицини
- N ‐ 3 Дієтично-дефіцитна дієта впливає на просторове навчання мишей у круговому лабіринті Барнса
- Пероперативне лікування гіперглікемії у хворих на цукровий діабет із ожирінням Baruah MP, Ranabir S - J Med