Патологічні ролі окисного стресу в мітохондріях та динаміка мітохондрій при серцевій мікросудинній ішемії/реперфузійній травмі
Хао Чжоу
1 відділення кардіології, китайська загальна лікарня PLA, медична школа китайського PLA, Пекін, 100853, Китай
Сем Тоан
2 Департамент хімічної інженерії, Університет Міннесоти-Дулут, Дулут, Міннесота, MN 55812, США
Анотація
1. Вступ
Гострий інфаркт міокарда (ГІМ) спричинений блокадою однієї або кількох коронарних артерій, що живлять серце [1,2]. Раптове припинення припливу свіжої крові в значній мірі призведе до тканинної гіпоксії або аноксії і, врешті-решт, загибелі клітин через апоптоз або некроз [3,4]. Широко визнано, що повторне впровадження кровотоку за допомогою реперфузійних стратегій є необхідним і плідним для порятунку пошкодженого міокарда. Парадоксально, але реперфузія також спричиняє загибель кардіоміоцитів або ендотеліальних клітин через індукування окисного стресу, перевантаження кальцієм та реакції запалення тканин [5,6]. Слід зазначити, що клінічна реальність ішемічно-реперфузійної (І/Р) травми стає очевидною з появою тромболітичної та інтервенційної реперфузії [7,8].
Мітохондрії історично розглядалися як батарея клітини через споживання кисню та продукування АТФ за допомогою циклу лимонної кислоти [29,30]. Безліч клітинних реакцій на стрес знаходяться під контролем мітохондрій на додаток до їх необхідної ролі в біоенергетиці [29,31]. На відміну від кардіоміоцитів або скелетних м’язів, залежне від мітохондрій вироблення енергії є відносно низьким у судинному ендотелії, який в основному використовує гліколіз для продукування АТФ [32,33]. В даний час визнано, що мітохондрії в ендотеліальних клітинах головним чином відіграють помітну роль у сигналізації клітинних реакцій на екологічні ознаки [34,35]. Що ще важливіше, вміст мітохондрій у клітинах ендотелію є відносно низьким (2–6% від об’єму цитоплазми) порівняно з іншими типами клітин, такими як кардіоміоцити (
32%) [36]. Низький вміст мітохондрій в ендотеліальних клітинах додатково підтверджує неканонічну функцію, яку виконують мітохондрії в регулюванні сигнальних реакцій, а не в метаболізмі глюкози [37]. У відповідь на стрес мітохондріями виробляються активні форми кисню (АФК), які використовуються як другий вісник для перетворення позаклітинного сигналу [38,39]. Злиття мітохондрій [40] і ділення [41,42], разом з мітофагією (видалення дефектованих мітохондрій), також беруть участь у регуляції клітинного гомеостазу, впливаючи на контроль якості мітохондрій [43,44]. Тут ми узагальнюємо та обговорюємо основні регуляторні аспекти мітохондріального окисного стресу та мітохондріальної динаміки при пошкодженні серцево-судинної мікросудинної системи (рис. 1).
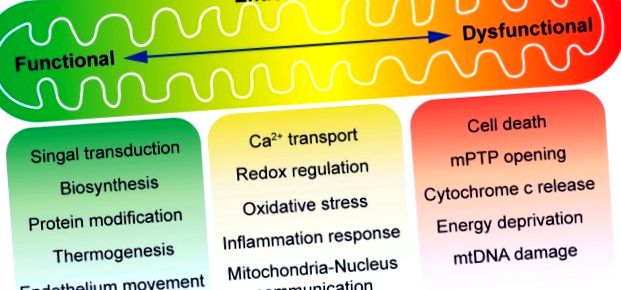
Огляд функції мітохондрій при гомеостазі ендотелію. Мітохондрії відомі як електростанція клітини. У звичайних умовах вироблення енергії, залежне від мітохондрій, є відносно низьким у судинному ендотелії, який в основному використовує гліколіз для продукування АТФ. В даний час прийнято вважати, що мітохондрії в ендотеліальних клітинах головним чином відіграють помітну роль у сигналізації клітинних реакцій на екологічні сигнали. Проміжний метаболізм у мітохондріях виробляє метаболіти для біосинтезу, модифікації білка та термогенезу. Крім того, мобілізація ендотелію знаходиться під контролем мітохондрій. Окисне фосфорилювання поєднується з утворенням активних форм кисню (АФК), які можуть служити або молекулярними сигналами, або спричиняти пошкодження клітин та загибель клітин. Мітохондріальний метаболізм стимулюється кальцієм, але в патологічних умовах перевантаження кальцію може спровокувати відкриття перехідної пори мітохондріальної проникності (mPTP). Вивільнення вмісту мітохондрій, такого як цитохром с, індукує апоптоз або втрату мембранного потенціалу (наслідок тривалого розкриття mPTP), викликає депривацію АТФ і некроз.
2. Мітохондріальний окислювальний стрес
НАДФН-оксидаза (NOX) - ще одне джерело продукції mtROS в ендотеліальних клітинах. NOX - це мембранно-зв’язані ферментні комплекси, а субодиниці NOX gp91 phox, p22 phox, p67 phox та p47 phox були вперше виявлені в культивованому HUVEC Джоунсом та його колегами [63]. Ці ізоформи NOX, експресовані в судинній системі, відрізняються міжклітинною локалізацією, проте всі вони функціонують завдяки переносу електронів від цитозольного NOX до мітохондріального кисню, утворюючи тим самим супероксид або перекис водню [64,65]. Хоча численні дані в різних клітинних лініях ендотелію вказують на мітохондріальний ЕТС як на головне джерело АФК, пов'язаних з I/R, існує ймовірність перехресних розмов між ізоформами NOX та мітохондріями [66]. Слід зазначити, що NOX4 локалізується вздовж внутрішньої мітохондріальної мембрани, і потенційна взаємодія між цими двома джерелами АФК може бути суттєвою детермінантою загальної кількості mtROS в ендотелії [67,68].
У матриксі мітохондрій супероксиддисмутаза (SOD) 2 відновлює O2 - до H2O2, менш токсичної АФК [83]. Потім глутатіонпероксидаза (GPX) каталізує відновлення H2O2 до H2O шляхом окислення відновленого глутатіону (GSH) до окисленої форми (GSSG) [84,85]. Каталаза в матриці мітохондрій також може перетворювати H2O2 у воду та молекулярний кисень [86,87]. Біосинтез глутатіону каталізується глутатіонредуктазою з використанням окислення відновленого нікотинаміду адениндинуклеотидфосфату (НАДФН) до НАДФ і є вирішальним у антиоксидантній активності в мітохондріях [88,89]. У міжмембранному просторі мідь і цинк, що містить SOD1, відновлює O2 - до H2O2, а GPX - H2O2 до H2O [90,91].
Іншим важливим джерелом АФК у реперфузійному серці є дві ізоформи моноаміноксидаз (МАО), МАО-А та МАО-В, які розташовані на зовнішній мітохондріальній мембрані [92]. Було продемонстровано, що активність МАО-А посилюється при пошкодженні введення/виведення і відповідає за осадження перекису водню та прогресування до гіпертрофії лівого шлуночка та серцевого ремоделювання [93]. Збільшений приплив мітохондріального заліза стимулює утворення більш потужних та шкідливих гідроксильних радикальних груп із перекису водню [94,95]. Хоча безперервне вивільнення АФК з мітохондрій у нормальних умовах, як видається, відіграє необхідну роль у підтримці базової клітинної функції, тимчасово підвищений рівень АФК може сприяти селективному синтезу білка, попередньому кондиціонуванню та зміні тонусу судин [96,97]. Однак навіть помірне, гостро підвищене вироблення АФК в мітохондріях може призвести до клітинної дисфункції.
Слід зазначити, що окислювальний стрес пов’язаний із зміненою експресією мітохондріальних та ядерних білків. Наприклад, було продемонстровано, що окислювальний стрес підвищує активність транскрипційного фактора COUP-TFII, який індукує експресію кодованих ядерними ферментами мітохондрій, сприяючи фрагментації мітохондрій [110]. Подібним чином АФК знижують активність комплексів ETC та зменшують споживання кисню у пацієнтів з метаболічним синдромом, що призводить до гіпертрофії лівого шлуночка та серцевої недостатності [111]. Нарешті, АФК провокують структурні зміни в мітохондріальних білках, такі як дисбаланс між мітохондріальною тирозинкіназою Src та фосфатазою SPH2, що зменшує фосфорилювання тирозину в активній області багатьох ферментів мітохондрій [112]. Встановлено, що при пошкодженні серцево-судинної мікросудинної/ІР інгібування генерування АФК перевертає транскрипцію та експресію сурвівіну [113], антиапоптотичного білка.
І останнє, але не менш важливе, погіршення рівня mtROS відповідає за спричинення загибелі/втрати клітин під час серцевого введення/введення. Повідомляється, що може відбуватися двофазна динаміка mtROS, яка включає поступове збільшення mtROS з подальшим спалахом mtROS. Слід зазначити, що базове збільшення mtROS та накопичення може бути сигналом активації спалаху mtROS, який було визначено як добре відоме та важливе явище індукованого ROS-вивільненням ROS, вперше описане Зоровим та співавт. у кардіоміоцитах [114]. Однак цей пункт не підтверджено при пошкодженні серцево-судинної мікросудинної системи. Крім того, молекулярний механізм, що лежить в основі підвищення та накопичення mtROS на базовому рівні, залишається невідомим.
3. Ділення мітохондрій
Роль ділення і злиття мітохондрій при пошкодженні серцево-судинної ішемії/реперфузії (I/R). Збільшення ділення мітохондрій супроводжується пошкодженням мітохондрій, гальмуванням проліферації, апоптозом та запаленням судин. На відміну від цього, злиття мітохондрій підвищує стійкість серцевої мікроциркуляції до пошкодження В/Р.
4. Злиття мітохондрій
5. Мітофагія
Огляд мітохондріального окисного стресу та мітохондріальної динаміки при пошкодженні серцево-судинної мікросудинної системи. Мітохондріальна мережа постійно перетворюється за рахунок антагоністичної активності білків, що опосередковують поділ, таких як фактор ділення мітохондрій (Mff), білок ділення мітохондрій 1 (Fis1) та білок, подібний динаміну 1 (Drp1), та білків, що сприяють злиття, таких як як мітофузин 1 (Mfn), Mfn2 і білок оптичної атрофії 1 (Opa1). Однією з найважливіших ролей поділу є розподіл дисфункціональних мітохондрій, тим самим забезпечуючи їх поглинання автофагічним механізмом і, як наслідок, деградацію в лізосомах. Паркін, паркін RBR E3 убіквітин білкова лігаза; PINK1, індукований PTEN передбачуваний білок кінази 1; Fundc1, Fun14, що містить домен білок 1.
Мітофагія - це селективна деградація пошкоджених мітохондрій шляхом аутофагії. У цьому процесі мітохондрії секвеструються в аутофагосомах і доставляються в лізосоми для гідролітичної деградації [165]. Фізіологічно мітофагія відіграє важливу роль у розвитку, включаючи повне видалення пошкоджених мітохондрій для підтримання гомеостазу мітохондріальної мережі [166]. Аномальна мітофагія посилює пошкодження мітохондрій та загибель клітин шляхом індукції виснаження АТФ та залежного від мітофагії некрозу або загибелі мітофагічних клітин [167,168]. Як і аутофагія, мітофагія поділяє основний молекулярний механізм з аутофагією, яка ініціюється зародком ізоляційної мембрани, а потім ізоляційна мембрана подовжується і закривається, утворюючи аутофагосому [169]. Походження мембран аутофагосом все ще залишається суперечливим, тоді як утворення аутофагосом регулюється двома убіквітин-подібними системами кон'югації [170,171,172], Atg12-Atg5 та Atg8-PE. Однак, на відміну від мітофагії, аутофагія розглядається як неселективний об'ємний процес деградації, коли аутофагосоми випадковим чином поглинають вміст у цитозолі [173,174]. Індукція та регуляція мітофагії регулюються рецепторно-залежними або незалежними шляхами.
Найвідоміший шлях мітофагії в клітинах ссавців опосередковується PINK1 та Паркіном, незалежним від рецепторів шляхом [175]. PINK1, серин/треонінкіназа, конститутивно імпортується до внутрішньої мембрани через її мітохондріальну послідовність-мішень. У нормальних умовах PINK1 в основному розщеплюється внутрішньою мембраною, пов'язаною з пресеніліном, ромбоподібною протеазою PARL, і в кінцевому підсумку протеолітично розкладається [176]. При пошкодженні мітохондрій, такому як деполяризація потенціалу мембрани мітохондрій, деградація PINK1 пригнічується, і таким чином повна довжина PINK1 накопичується на зовнішній мембрані мітохондрій [177]. Згодом PINK1 завербує Паркін з цитозолю в мітохондрії [178]. Після локалізації в мітохондріях паркін убіквітує білки мембрани мітохондрій, такі як мітофузини [179]. p62 також рекрутується Паркіном до убіквітінованих мітохондрій для сприяння доставці убіквітінованих мітохондрій до аутофагосоми через зв'язування з LC3. Варто зазначити, що Паркін також може взаємодіяти безпосередньо з білками, що регулюють аутофагію, такими як Ambra1, щоб полегшити мітофагію [180].
6. Висновок та перспективи на майбутнє
Подяка
Ми вдячні Джуну Рену з Університету Вайомінгу та Юндаю Чену в Загальній лікарні НВАК за їх корисні обговорення.
- Нічні перекуси, стрес та активність при мігрені
- Дитячі серцеві ліки Lasix - дитячі спеціалісти з серця
- Ролі будуть змінені в новому економічному кліматі
- Тиша телят; Безвідмовна відлучка економить стрес і гроші; На пасовищі
- Залежний від SigB загальний стрес-реакція на Bacillus subtilis та пов'язані з ним грампозитивні бактерії