Оцінка впливу фіброміалгії на активність захворювання та ефект лікування при спондилоартрозі
Наталія Белло
Відділення ревматології, лікарня Кочіна, AP-HP, Паріс, Франція
Відділення ревматології, лікарня General Universitario Gregorio Marañón, Мадрид, Іспанія
Адріен Етчето
Відділення ревматології, лікарня Кочіна, AP-HP, Паріс, Франція
INSERM (U1153): Клінічна епідеміологія та біостатистика, PRES Sorbornne Paris-Cité, Париж, Франція
Керолайн Беал
Відділення ревматології, лікарня Кочіна, AP-HP, Паріс, Франція
Максим Дугадас
Відділення ревматології, лікарня Кочіна, AP-HP, Паріс, Франція
INSERM (U1153): Клінічна епідеміологія та біостатистика, PRES Sorbornne Paris-Cité, Париж, Франція
Анна Молто
Відділення ревматології, лікарня Кочіна, AP-HP, Паріс, Франція
INSERM (U1153): Клінічна епідеміологія та біостатистика, PRES Sorbornne Paris-Cité, Париж, Франція
Анотація
Передумови
Фіброміалгія (FM) може співіснувати зі спондилоартритом (SpA), що призводить до діагностичних та лікувальних дилем, особливо при наявності ентезиту. У цьому дослідженні ми мали на меті оцінити поширеність ФМ у SpA та порівняти клінічні особливості/особливості захворювання та інгібітори ФНП (ФНП) у пацієнтів із/без ФМ.
Метод
ЧМ визначався оцінкою => 5/6 Інструменту швидкого скринінгу фіброміалгії (FiRST). Були включені пацієнти SpA (за словами ревматолога) та послідовні консультації в денному стаціонарі, а також в амбулаторії при ревматологічному відділенні університетської лікарні вищої медичної допомоги.
Демографічні показники, характеристики захворювання, активність та тяжкість та лікування TNFi порівнювали у пацієнтів із ФМ та без неї; ступінь утримання першого TNFi та пов'язані з ним фактори були досліджені (регресія Каплана Мейєра та Кокса).
Результати
З 196 зареєстрованих хворих на SpA, 42 (21,4%) були позитивно обстежені на ФМ. Не було виявлено статистично значущих відмінностей у поширеності ФМ як щодо виконання критеріїв ASAS щодо периферичного/осьового SpA, так і щодо виконання візуалізації та клінічної групи критеріїв ASAS. Однак у пацієнтів із співіснуючими ФМ спостерігалося значно більше ентезиту, вищої активності захворювання (BASDAI та VAS) та гірших показників функції (BASFI). Не було виявлено відмінностей щодо початку лікування TNFi (79,0% проти 70,0%, відповідно), але рівень утримання першого TNFi через 2 роки був коротшим у групі пацієнтів з ФМ (28,1% (95% ДІ) 12,5-44,0) проти 41,7% (95% ДІ 32,2-51,3), р = 0,01).
Висновок
Це дослідження підтверджує, що співіснуючий ФМ у SpA може впливати на показники результатів, повідомлених пацієнтом, щодо активності та функцій захворювання, а також на рівень збереження лікування TNFi.
Передумови
Спондилоартроз (SpA) - це захворювання, яке включає спектр хронічних запальних утворень, що охоплюють осьовий скелет (крижово-клубові суглоби та хребет) та периферичні суглоби, і мають низку клінічних ознак, таких як артрит, ентезит, увеїт, дактиліт, псоріаз та запальне захворювання кишечника із загальним генетичним фоном - людський лейкоцитарний антиген (HLA) B27 [1–4]. У 2009 році Міжнародне товариство спондилоартриту (ASAS) запропонувало новий набір критеріїв класифікації з метою розпізнавання пацієнтів з раннім осьовим SpA (axSpA), включаючи вперше візуалізацію крижово-клубових суглобів (SIJ) за допомогою магнітного резонансу візуалізація (МРТ) та аномальний С-реактивний білок (СРБ) [5], а також інший набір для пацієнтів із SpA з переважно периферичними проявами (наприклад, периферичний артрит, ентезит та дактиліт) [6, 7]. Критерії axSpA дозволяють класифікувати пацієнтів з хронічним болем у спині, що триває ≥3 місяців і виникає до 45 років, за двома групами: візуалізаційна група, в якій пацієнти мають сакроілеїт (або на рентгенограмах, або на МРТ) плюс принаймні один додатковий Особливість SpA та клінічна група, в якій пацієнти повинні бути позитивними до HLA-B27 та мати дві або більше характеристик SpA.
Однак клінічна група була піддана критиці і не визнана нашими органами охорони здоров'я та деякими колегами, незважаючи на те, що вона була повністю перевірена [8]. Основним аргументом для такої критики є те, що ця група дозволить класифікувати SpA у пацієнтів без будь-яких об'єктивних ознак запалення (аномальна СРБ або наявність запальних уражень, виявлених на МРТ SIJ) або структурних пошкоджень в SIJ, видно на рентгенограмах тазу [ 6, 9].
Справді, хоча було доведено, що критерії ASAS є високоспецифічними з прийнятною чутливістю як для діагностики, так і для класифікації хворих на SpA [10, 11], можна вважати недоцільним застосовувати їх як діагностичний засіб за відсутності об'єктивних ознак структурних пошкоджень або запалення через потенційний ризик неправильної діагностики або надмірної діагностики SpA у пацієнтів з іншими захворюваннями (наприклад, фіброміалгія (FM), особливо за наявності ентезиту [12].
За відсутності специфічних біомаркерів для ФМ, діагностику в даний час можна проводити за допомогою критеріїв Американського коледжу ревматологів (АКР) (класифікація АКР 1990 року ФМ та АКР 2010 та модифіковані критерії діагностики 2010 (2011)) [14, 22, 23] . Однак ці критерії були розроблені для дослідницьких та класифікаційних цілей, і їх важко застосувати у повсякденній практиці, оскільки вони займають багато часу та потребують певної підготовки [24]. Більше того, такі критерії (наприклад, ACR 1990) включають тендерні точки при фізичному обстеженні, які можуть відображати ентезит у пацієнтів із SpA. Таким чином, з метою виявлення простого та дійсного скринінгового інструменту для полегшення ідентифікації хворих на ФМ у клінічній практиці та дослідженнях, було розроблено Інструмент швидкого скринінгу на фіброміалгію (FiRST) [25], чутливість якого становить 90,5% та специфічність 85,7% [25] для ідентифікації хворих на ФМ.
Все вищезазначене спонукало нас провести це дослідження з метою 1) оцінити поширеність ФМ згідно з FiRST у популяції пацієнтів із SpA та порівняти поширеність з урахуванням плеча, виконаного в межах осьових критеріїв (тобто візуалізація та 2) порівняти демографічні показники/особливості захворювання та лікування інгібіторами TNF (TNF) з точки зору початку та першого рівня утримання TNFi у пацієнтів із ФМ та без нього відповідно.
Методи
Вивчати дизайн
Заповнення опитувальників FiRST, BASDAI та Функціонального індексу анкілозуючого спондиліту ванни (BASFI) було виконано перспективно, а дані про демографічні показники та особливості захворювання ретроспективно отримані з медичних картотек.
Навчання населення
Були включені пацієнти віком ≥18 років, у яких діагностовано SpA (за даними ревматолога) і послідовно відвідували денний стаціонар, а також амбулаторію при ревматологічному відділенні університетської лікарні вищої медичної допомоги.
Збір даних
ЧМ визначали, якщо оцінка становила ≥5/6 у ПЕРШІЙ анкеті [25]. Медичні картотеки кожного пацієнта, який заповнив анкету FiRST, були переглянуті двома зовнішніми слідчими. Була зібрана наступна інформація: вік, стать, статус куріння (минулий, поточний, ніколи), вага та зріст тіла та дата діагностики SpA, всі наявні предмети, що дозволяють розрахувати виконання критеріїв ASAS; Збирали BASDAI [26], глобальну візуальну аналогову шкалу (VAS) за даними пацієнта, наявністю та кількістю опухлих суглобів, діагностованих лікарем та СРБ на день візиту, та оцінювали тяжкість захворювання на момент відвідування за допомогою BASFI [27]; Лікування SpA від початку захворювання, включаючи інформацію про нестероїдні протизапальні препарати (НПЗЗ), звичайні протиревматичні препарати, що модифікують захворювання (cDMARD), а також тип і кількість TNFi, кількість перемикань, дата початку/закінчення та причина припинення для кожен TNFi. Була зібрана інформація про колишнє або поточне використання психотропних препаратів (тобто міорелаксантів, антидепресантів або анксіолітиків), сильних опіоїдів [28, 29] та історії депресії. Спеціально для цього дослідження не проводили візуалізацію (тобто УЗД чи МРТ).
Етичні міркування
Це дослідження не було передано жодному етичному комітету, оскільки воно проводилось із використанням даних, зібраних під час рутинної допомоги. Однак усі пацієнти дали усну згоду на використання своїх даних для цього дослідження (як зазначено в офіційних процедурах Франції щодо неінтервенційних досліджень).
Відсутня обробка даних
У разі відсутності інформації до пацієнтів зверталися по телефону для отримання такої інформації. Якщо CRP була недоступна в день візиту, використовувались останні доступні вимірювання CRP, зібрані протягом попередніх 6 місяців. Крім того, якщо будь-яка з відповідей на опитувальник FiRST відсутня, ми виключили лише тих пацієнтів, для яких відсутні відповіді не дозволяли нам визначити їх групу (з/без ФМ), наприклад, пацієнт, який позитивно відповів на три запитання, але відповів не відповідати на останні три запитання.
Статистичний аналіз
Постійні змінні повідомляли за середнім та стандартним відхиленням (SD), а якісні - за частотою та відсотками. Статистичну значущість встановлювали на p 2) тесті, як підходить.
Відсоток пацієнтів, які коли-небудь піддавалися дії TNFi, середню кількість отриманих TNFi, середню тривалість першого лікування TNFi та причини припинення прийому кожного TNFi оцінювали у загальній популяції та порівнювали у групах FM +/FM– . Швидкість утримання першого лікування TNFi у групах FM +/FM– оцінювали за допомогою аналізу виживання (криві Каплана – Мейєра) та порівнювали за допомогою логарифмічного тесту. Фактори, що схильні до припинення прийому першого TNFi протягом перших 2 років, оцінювались за допомогою регресійних моделей Кокса спочатку однофакторним, а потім багатовимірним аналізом, включаючи в модель лише змінні, які мали тест р значення 2.
Результати
З 213 пацієнтів, які заповнили опитувальник FiRST, 196 було збережено для нашого аналізу: пацієнти без підтвердженого діагнозу SpA (n = 14) та пацієнти, які не повністю відповіли на анкету (n = 3), були виключені. Надійність діагнозу ФМ була хорошою, при цьому PABAK = 0,64 (95% ДІ 0,314; 0,958). У нашій популяції SpA поширеність супутнього ФМ становила 21,4% (42/196).
Поширеність фіброміалгії за критеріями класифікації ASAS
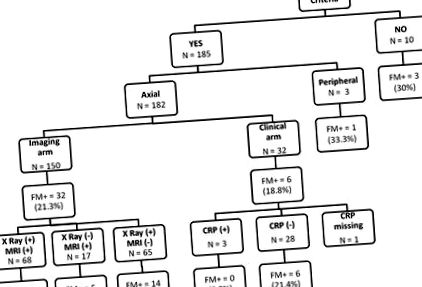
Рисунок 1 узагальнює поширеність ФМ залежно від критеріїв класифікації ASAS. З 196 пацієнтів, включених в аналіз, 185 (94,4%) відповідали критеріям ASAS (182 (98,4%) та 3 (1,6%) осьові та периферичні відповідно). Для критеріїв ASAS для axSpA 150 пацієнтів (82,4%) та 32 пацієнти (17,6%) відповідали візуалізації та клінічному озброєнню відповідно.
Фіброміалгія (ФМ) при спондилоартрозі залежно від оцінки критеріїв класифікації Міжнародного товариства спондилоартриту (ASAS) та виконаної групи. FM + фіброміалгія, визначена опитувальником Інструменту швидкого скринінгу фіброміалгії (ПЕРШИЙ) (тобто ПЕРШИЙ ≥5/6), рентгенологічний сакроілеїт XRay (+), сакроіліт МРТ (+), магнітно-резонансна томографія, CRP (+) аномальний С-реактивний білок (тобто, ≥6 мг/л)
Поширеність супутнього ФМ була більшою у групі пацієнтів, які не відповідали критеріям ASAS, хоча ця різниця не була статистично значущою (21,1% проти 30,0%, незначна). Що ще цікавіше, ніяких відмінностей у поширеності ФМ не спостерігалось у групі пацієнтів, які виконували візуалізацію та клінічну групу критеріїв ASAS для axSpA (21,3% проти 19%, незначно).
Демографічні показники, характеристики захворювання, активність та тяжкість порівнювали у групах FM + та FM– (див. Таблицю 1). Ці дві групи були схожі за віком, середнім віком на початку захворювання та станом куріння. Однак пацієнти, які відповідають визначенню FM +, частіше виявляли ентезит (59,5% проти 39,0%, p = 0,01), більший загальний показник BASDAI (4,7 (± 2,3) проти 2,6 (± 1,9), p 2 узагальнює характеристики лікування TNFi у Відсоток пацієнтів, коли-небудь підданих дії TNFi, не відрізнявся між групами FM + проти FM– (79% проти 70%, відповідно, не суттєво), тоді як відсоток перемикачів був значно вищим у групі FM + (15,2 % проти 4,0%, p = 0,03). Середня тривалість першого TNFi була значно коротшою у групі FM + (1,7 (± 2,4) проти 3,5 (± 4,0) років, p 2).
Таблиця 2
Лікування інгібітором TNF (TNFi) у пацієнтів з фіброміалгією та без неї
Крива Каплана – Мейєра для швидкості утримання першого інгібітора TNF (TNFi) протягом перших 2 років. ФМ фіброміалгія
Однофакторний аналіз Кокса виявив ФМ (коефіцієнт ризику (ЧСС) 1,8, 95% ДІ 1,1; 3,0), ураження периферії (ЧСС 1,6, 95% ДІ 1,0; 2,6) та історію депресії або прийому психотропних препаратів або сильних опіоїдів (ЧСК 0,6, 95 % ДІ 0,4; 0,9) як супутні фактори для припинення першої TNFi; однак при багатофакторному аналізі лише FM (HR 1,7, 95% ДІ 1,0; 2,9) та периферичне ураження (HR 1,6, 95% ДІ 1,0; 2,6) були незалежно пов'язані з припиненням прийому першого TNFi. Причинами припинення прийому кожного TNFi були однакові відсотки у двох групах (значення р не суттєве), неефективність є найчастішою причиною у загальній сукупності.
Обговорення
Наскільки нам відомо, це перше дослідження, що має на меті оцінити поширеність ФМ серед популяції пацієнтів із SpA щодо відповідності критеріям класифікації ASAS, і наші результати показують, що відмінностей між візуалізацією та клінічними групами не виявлено критеріїв ASAS для axSpA. Цей висновок є аргументом на користь обгрунтованості таких критеріїв, особливо для клінічної групи, що все ще не повністю прийняте деякими членами наукової спільноти. Фенотип хворих на SpA із супутніми ФМ частіше був жіночим та частіше проявлявся ентезитом, повідомляючи про більшу активність захворювання та гірші показники функції. Ці результати узгоджуються з попередніми дослідженнями [16, 17, 20, 30, 31].
Оскільки пацієнти SpA із співіснуючими ФМ часто мають більш високий показник активності захворювання, оцінка активності захворювання та ефекту лікування може бути складним завданням і може призвести до непотрібного ініціювання TNFi, збільшення дози або перемикання. У нашому дослідженні відсоток пацієнтів, які ініціювали TNFi, не відрізнявся у групах FM + та FM–, але пацієнти з супутніми FM + захворюваннями частіше переходили на інші методи лікування TNFi. Більше того, рівень утримання першого TNFi був нижчим у групі FM +, і наявність FM було незалежно пов'язане з першим припиненням застосування TNFi. Це підтверджує, що існування супутнього ФМ у SpA може ускладнити оцінку відповіді на лікування [19, 20], і передбачає, що співіснування ФМ слід ретельно перевіряти під час ініціювання TNFi та/або оцінки його ефекту від лікування, особливо за наявності периферичні та/або ентезитні симптоми та при наявності дуже важкої активності захворювання та оцінок, повідомлених пацієнтом. У цьому сенсі опитувальник FiRST являє собою простий у використанні та дійсний інструмент, який може бути використаний у клінічній практиці перед початком TNFi, зокрема у пацієнтів з ентезитом.
У нашому дослідженні є деякі слабкі сторони, але також сильні сторони. Спочатку діагноз ФМ за даними ревматолога не збирався. Однак ми перевірили зовнішню обґрунтованість FiRST у цій установці SpA, підтвердивши більше використання психотропних препаратів або сильних опіоїдів, або історію депресії в групі пацієнтів, позитивно оцінених як FM + [32, 33]. По-друге, нещодавно повідомлялося про нижчу чутливість FIRST при застосуванні у популяції SpA порівняно з початковим дослідженням (66% проти 90%) [34]; однак цих даних на момент початку дослідження не було. Крім того, ми не використовували критерії ACR (1990 ACR класифікація FM [14] - модифіковані попередні критерії ACR 2010 [22]) для підтвердження наших результатів щодо поширеності FM, але це було пов'язано зі складністю застосування таких критеріїв у налаштування щоденної практики [23]. Нарешті, можна було б вважати, що обсяг вибірки нашого дослідження був занадто малим, щоб зробити певні висновки, наприклад, при оцінці рівня утримання першого TNFi лише дев'ять пацієнтів були під загрозою після 18 місяців спостереження в групі FM +.
Тим не менше, наше дослідження також має деякі сильні сторони. По-перше, наші аналізи проводились на репрезентативній кількості хворих на SpA у щоденній практиці. Крім того, наскільки нам відомо, це перше дослідження, яке має на меті оцінити поширеність ФМ відповідно до виконання класифікаційних критеріїв ASAS та його впливу на лікування TNFi.
Висновки
Підсумовуючи, подібний відсоток ФМ у різних підгрупах критеріїв класифікації ASAS може бути вагомим аргументом на користь обгрунтованості цих критеріїв, зокрема клінічної групи. Співіснування ФМ може вплинути на оцінку інструменту, що використовується для оцінки активності та тяжкості захворювання, особливо в оцінках, повідомлених пацієнтом, і, отже, може ускладнити оцінку реакції на лікування. Впровадження опитувальника FiRST може бути корисним у клінічній практиці, особливо за наявності ентезитних симптомів. Інші дослідження, спрямовані на проспективну оцінку впливу супутнього ФМ на SpA на лікувальний ефект TNFi, повинні дозволити нам підтвердити (чи ні) наші висновки.
Подяка
НБ отримав стипендію на перебування за кордоном від Sociedad Española de Reumatologia для проведення цього дослідження.
- Дегенеративне лікування дискових захворювань, причини; Симптоми
- Вплив лікування дапагліфлозином на експресію ниркових транспортерів натрію
- Вплив маси тіла на патогенез індукованої лігатурою хвороби пародонту у щурів Wistar -
- Ліки від жирової печінки можуть не мати ефекту - ScienceDaily
- Спільна інфекція ускладнює діагностику та лікування хвороби Лайма