Нові уявлення про лікування інфаркту міокарда
Петра Сарапульцева
* Інститут імунології та фізіології (ІІП) Уральського відділу Російської академії наук
Олег Чупахін
† Інститут органічного синтезу імені І. Я. Постовського Уральського відділення РАН, лабораторія гетероциклічних сполук
Олексій Сарапульцев
* Інститут імунології та фізіології (ІІП) Уральського відділу Російської академії наук
Максим Ранцев
‡ ГОУ ВПО Уральська державна медична академія
Лариса Сидорова
§ Федеральний державний автономний навчальний заклад вищої професійної освіти Уральського федерального університету імені першого президента Росії Б. Н. Єльцина
Світлана Медведєва
* Інститут імунології та фізіології (ІІП) Уральського відділу Російської академії наук
Ірина Данилова
* Інститут імунології та фізіології (ІІП) Уральського відділу Російської академії наук
Анотація
Досягнення кардіологічної допомоги пацієнтам призвели до зниження рівня госпітальної смертності серед пацієнтів з гострим інфарктом міокарда (ГІМ). Однак постійно високий рівень захворюваності на ішемічну хворобу серця підтримує інтерес до патогенезу та природних наслідків ураження міокарда (Drapkina et al. 2000; Arzamastsev et al. 2003; Saprunova et al. 2003; Golikov, 2004), оскільки це може допомога у розробці нових більш ефективних форм лікування.
В даний час лікування ішемічного ураження серця базується на моделюванні дії природних антистресорів та антиішемічних механізмів. Введення метаболітів або їх синтетичних аналогів, які впливають на різні ділянки патогенетичного ланцюга (Meyerson 1984).
Таким чином, згідно з Настановами робочої групи Європейського кардіологічного товариства (2000) та наступними Російськими настановами (2001), лікування розвиненого ІМ повинно покладатися на використання бета-блокаторів, нітратів, блокаторів кальцієвих каналів та антитромбоцитарних засобів ( аспірин, тієнопіридини, антагоністи рецепторів тромбоцитів глікопротеїну IIb/IIIa). Однак ці ліки не впливають ні на тканини, ні на системний тканинний запальний процес, пов'язаний з ІМ, (Smith et al. 1977).
Запальна реакція є компонентом не тільки ішемії, але й реперфузійного пошкодження міокарда, сприяючи таким чином поширенню некротичної ділянки (Tommasi et al. 1999). Крім того, характер формування некрозу може призвести до аномального ремоделювання лівого шлуночка при ІМ (Chukaeva et al. 2007). Більше того, зменшення розміру рубця пов'язане з профілактикою вторинних хвиль некрозу міокарда (Саркісов, 1979).
Ряд останніх досліджень підтверджує цю думку. Активація клітинних ефекторів запалення негативно впливає на функцію міокарда при ГІМ (Engler et al. 1986; Kuzuya et al. 1991). Розміри зони інфаркту корелюють з показниками реакції гострої фази (Мягков та ін., 1993). Отже, нижчий вихідний рівень СРБ пов’язаний з більш сприятливим прогнозом на шість місяців після ІМ (Hudson et al. 1999). Роль запальної реакції при ІМ додатково підтверджується тим фактом, що видалення нейтрофілів з крові або додавання засобів, що інгібують інфільтрацію лейкоцитів, сприяли зменшенню розмірів області інфаркту в дослідженнях на тваринах (Engler et al. 1986; Dinerman et al. 1990). Тому метою цього дослідження було дослідити вплив сполуки L-17 групи заміщених 5R1, 6H2-1,3,4-тіадіазин-2-амінів, що, як відомо, впливає на міокард, на клітину запалення. інфільтрація та ремоделювання міокарда після гострого ІМ у щурів.
Матеріали і методи
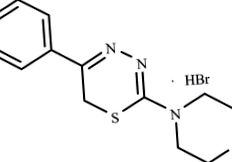
З'єднання L-17 групи заміщених 5R1, 6H2-1,3,4-тіадіазин-2-амінів використовували для лікування експериментального ІМ у щурів (рис. 1).
Структурна формула сполуки L-17 групи заміщених 5R1, 6H2-1,3,4-тіадіазин-2-амінів.
Ця сполука була синтезована в Інституті органічного синтезу Уральського відділення РАН як частина ряду діючих речовин, що впливають на обмін речовин та запалення. З'єднання є зареєстрованим винаходом (патент США № 6313111 від 6 листопада 2001 р., Патент РФ № 2259371 від 27 серпня 2005 р.). Вибір цієї сполуки був обумовлений тим, що, як відомо, сполука L-17 є біологічно активною та, як відомо, має міорелаксуючу (Патент США No 4309426 від 20 листопада 1980 р.), Спазмолітичну та антиагрегаційну активність (Новікова та ін., 1992; Логвінова та ін., 2010). але ще не досліджено в системі патогенетичних моделей in vivo. Результати лікування експериментального ІМ також були захищені патентом (Патент РФ № 2395850 від 27 липня 2010 р.).
Модель гострого ІМ
Моделювання АМІ у щурів проводили, як описано раніше (Патент РФ № 2407062 від 20 грудня 2010 р.). Цей метод заснований на оперативному моделюванні ІМ у щурів, що характеризується послідовністю наступних етапів: шкіра надрізана, а м’язи оголені з лівого боку грудної клітки; грудні м’язи поширюються для оголення реберних дуг та міжреберних м’язів; міжреберні м’язи розсікаються на рівні 4–5 міжребер’я на 1 см; серце візуалізується; а коагуляція проводиться на стандартній обмеженій ділянці гілок лівої коронарної артерії в її середній або нижній третині. Коагуляція проводиться за допомогою Г-подібного інструменту для отримання припікаючої поверхні 2,5 × 3,0 мм, попередньо нагрітої за допомогою спиртової лампи, що дозволяє чітко візуалізувати серце під час коагуляції. Торакотомічну рану закривають запущеним швом за допомогою атравматичної голки; пневмоторакс усувається за допомогою гольового шприца; а розріз шкіри закритий. Цей метод збільшує ймовірність позитивного результату (тобто ГІМ), одночасно мінімізуючи оперативний час та збільшуючи час для самого експерименту. Крім того, цей метод ні порушує серцевий ритм, ні викликає аритмії, пов'язані з ефектом електричного струму.
Протягом 10 хв після моделювання інфаркту поведінкові реакції тварин повністю повертаються до передопераційного рівня. Смертей не зафіксовано. Оцінка поведінки тварин за 24 год не виявила ознак аномальних поведінкових реакцій: тварини були активними; і вони реагують на звукову та світлову стимуляцію без будь-яких затримок.
Підготовка тварин
Використовували дванадцятитижневих самців випадково виведених самців щурів. Їх розміщували при температурі 23–25 ° C у 12: 12-годинному циклі світло-темно з домішками їжі та води.
Гострий ІМ викликаний коагуляцією лівої коронарної артерії, як описано раніше. Щурів знеболювали шляхом внутрішньочеревної ін’єкції кетаміну (50 мг/кг) та ксилазину (10 мг/кг). Їх інтубували та провітрювали, і процедуру виконували, як зазначено вище. Коагуляцію проводили на стандартній обмеженій ділянці гілок лівої коронарної артерії в її середній або нижній третині. Контроль проводили підроблені щури, яким робили ту саму операцію, але без контролю проводили коагуляцію коронарних артерій. Експерименти на тваринах були схвалені та виконувались згідно з Настановою 86/609/ЄЕС (1986) Ради ЄС та Європейською конвенцією про захист хребетних, що використовуються для експериментальних та інших наукових цілей (1990), та НАКАзом МОЗ СРСР від 12 серпня 1977 р. № 755 "Про заходи щодо подальшого вдосконалення організаційної форми використання експериментальних тварин".
Експериментальний протокол
Досліджено 52 випадково виведені самці щурів вагою 180–240 г. Експерименти проводили наступним чином: тварин з експериментальною моделлю ІМ розділили на дві групи, по 15 щурів у кожній групі. До першої групи входили білі щури, які отримували сполуку L-17 внутрішньочеревно у дозі 40 мг/кг кожні 24 год; друга група отримувала розчин хлориду натрію внутрішньочеревно; контрольна група інтактних тварин без експериментальних ГІМ включала 10 щурів.
Тварин приносили в жертву для дослідження в перший, п’ятий та сьомий дні після знеболення Етаміналом-натрієм внутрішньочеревно у дозі 40 мг/кг.
Під час збирання серця для подальшої гістологічної оцінки загальні спостереження у всіх тестових випадках показали наявність чіткої зони інфаркту в міокарді. Ніяких змін легенів та плеврального випоту не зафіксовано. Загальне спостереження не виявило жодних видимих змін в органах черевної порожнини (печінка, селезінка, кишкові петлі) та інших тканинах.
Міокард усіх сердець досліджували, відбираючи як зони інфаркту, так і перифарктні зони міокарда, а також ділянки лівого шлуночка, віддалені від пошкоджених тканин. Парафінові блоки готували із застосуванням стандартних методів. Серійні зрізи (5–6 мкм) по 5–6 мкм фарбували гематоксиліном та еозином згідно з Ван Гісоном та Вейгертом (Lillie 1977; Bancroft & Stevens 1996).
Для біохімічного аналізу 3 мл крові отримували пункцією серця для подальшого центрифугування та відділення сироватки. Сироваткова активність креатинфосфокінази (CPK), аспартатамінотрансферази (AST), ізоферментів 1 і 2 та лактатдегідрогенази (LDH1-2) до і в процесі розвитку ІМ досліджувались з однаковими інтервалами часу.
Лабораторні дослідження крові проводили з використанням наступних приладів та систем діагностики:
Біохімічний аналізатор "Імунохімічні системи" від Beckman Coulter, Inc. (Brea, CA, USA)
Діагностичні системи від DSL, Inc. (Вебстер, Техас, США)
Спектрофотометр "Multiscan" фірми Labsystems Ltd. (Гельсінкі, Фінляндія)
Автоматичний аналізатор «Glycomat DS5» від Drew Scientific Ltd. (Даллас, Техас, США)
Переносимість сполуки L-17
Переносимість сполуки L-17 у тварин оцінювали як цілком задовільну: не було виявлено випадків больових реакцій або некробіотичних змін у місцях ін’єкцій, не було післяопераційних інфекцій рани та емпієм плеври, за винятком уповільнення реакцій тварин на звук та світло стимуляція, яка була відзначена через 20–30 хв після ін’єкцій і тривала 40–45 хв до того, як поведінка тварин знову не відрізнялася від поведінки інтактних щурів. Симптоми дихальної недостатності або порушення прийому їжі та напоїв також не були помічені.
Статистичний аналіз
Таблиця 1
Біохімічні значення сироватки крові під час експериментального гострого ІМ
| CPK (мкмоль/л-хв) | 146,92 ± 22,6 | 234,9 ± 60,1 * | 201,08 ± 28,5 * | 168,54 ± 21,6 * | 103 ± 12,1 † | 248,12 ± 41,5 * | 107,64 ± 19,9 † |
| AST (мкмоль/L-24 год) | 0,193 ± 0,014 | 0,415 ± 0,033 ** | 0,379 ± 0,022 ‡ * | 0,290 ± 0,05 * | 0,184 ± 0,011 † | 0,288 ± 0,023 * | 0,225 ± 0,024 † |
| LDH1-2 (мкмоль/L-24 год) | 165,15 ± 34,6 | 515,82 ± 60,1 * | 403,78 ± 38,4 ** | 262,28 ± 22,1 * | 258,08 ± 31,6 * | 346,46 ± 52,9 * | 229,74 ± 60,6 * |
Надійність відмінностей між інтактними тваринами та тваринами з експериментальним ІМ: * P ** P † P ‡ P Рисунок 2). У сусідніх структурах спостерігався набряк та повнота ендомізіальних судин з утворенням мулу. Виявлені поліморфно-ядерні лейкоцити в зоні деструкції свідчили про реактивне запалення з ексудативною реакцією. У мікросудинах перифокальної області виявлено утворення осаду еритроцитів та вогнищеві крововиливи.
Інфаркт міокарда, 1 день, без введення препарату. Зона некрозу (а) представлена кардіоміоцитами з ознаками каріолізу, плазмолізу та плазморексису; помірна дифузна інфільтрація (b) пошкодженої ділянки з сегментованими лейкоцитами. Фарбування H&E. Збільшення × 400.
Суттєві зміни були помічені не тільки в області некрозу, але і в сусідніх тканинах. Ці зміни включали часткову атрофію міокардіоцитів, виражену дистрофічну реакцію з набряком строми та втрату поперечної та осьової смугастості міофібрил (рис.3).
Інфаркт міокарда, 1 день, без введення препарату. Повнота ендомізіальних судин з муловими утвореннями. Фарбування H&E. Збільшення × 400.
У перший післяопераційний день у експериментальній групі тварин з ІМ, обробленої L-17, площа інфаркту була великою, вогнищевою та виявляла кардіоміоцити з ознаками каріолізу, плазмолізу та плазморексису без чіткої зони розмежування. У інфільтраті була присутня невелика кількість лімфоцитів. Некротична зона була мінімально інфільтрована (рисунок 4).
Інфаркт міокарда, 1 день, із введеним препаратом. Пошкоджена область (а) представлена кардіоміоцитами з ознаками каріолізу, плазмолізу та плазморексису; помірна дифузна інфільтрація (b) пошкодженої області менш помітна; інфільтрат містить невелику кількість лімфоцитів. Фарбування H&E. Збільшення × 400.
На п’яту післяопераційну добу у тварин з необробленим експериментальним ІМ некроїчний ділянку характеризували як переважно трансмуральний. Некротичні кардіоміоцити були оточені демаркаційною лінією; і мало ознак утворення грануляційної тканини: фібробласти та гемокапіляри почали з’являтися. Сусідні структури продемонстрували інфільтрацію ендомізію.
На п’яту післяопераційну добу у експериментальних тварин з ІМ, оброблених сполукою L-17, пошкоджену ділянку замінили грануляційною тканиною, представленою фібробластами, дрібними колагеновими волокнами та множинними синусоїдальними капілярами. Грануляційна тканина була просочена лімфоцитами та макрофагами, але поліморфно-ядерних лейкоцитів було небагато.
На сьомий післяопераційний день у всіх тварин з необробленим експериментальним ІМ некротизована ділянка в стінці лівого шлуночка характеризувалася як трансмуральна. З’явилися гістологічні ознаки стадії формування (тобто формування грануляційної тканини по краях ділянки некрозу з великою кількістю фібробластів, макрофагів та синусоїдальних гемокапілярів, що замінюють пошкоджену ділянку); проте дезінтеграція м'язових клітин та інфільтрація міокарда лімфоцитами та сегментованими лейкоцитами тривали. У деяких випадках маргінація з ознаками лейкопедезу виявлялася всередині судин.
На сьомий післяопераційний день у експериментальних тварин з ІМ, оброблених сполукою L-17, некротичну ділянку повністю замінили грануляційною тканиною, в якій множинні гемокапіляри синусоїдального типу, утворюючи дрібні колагенові волокна, збільшували міжклітинну наземну речовину, у яких значна кількість функціонально активні фібробласти та макрофаги були виявлені. Інфільтрат складався з лімфоцитів з невеликою кількістю поліморфно-ядерних лейкоктів. Ознаки інтерстиціального набряку зберігалися в сусідніх областях міокарда; ендомізіальні судини були розширені і повні.
Обговорення
У цьому дослідженні досліджено вплив сполуки L-17 групи заміщених 5R1, 6H2-1,3,4-тіадіазин-2-амінів на запальну клітинну інфільтрацію та ремоделювання міокарда після гострого ІМ у щурів.
Лабораторні дослідження впливу сполуки L-17 на розвиток та перебіг експериментального ІМ показали, що введення сполуки L-17 суттєво знижує рівень АСТ та КФК у крові. Враховуючи дані про кореляцію між активністю цих ферментів та розмірами некротичної ділянки, це дозволяє зробити деякі попередні висновки щодо ефективності лікування ІМ.
Висновки гістології у тварин з експериментальним ІМ заслуговують на особливу увагу. Виявлено, що сполука L-17 не тільки зменшує площу початкового інфаркту, але й принципово змінює характер запальної реакції в пошкодженому міокарді.
В основному зменшення кількості необоротно пошкодженої тканини саме по собі може бути головним фактором, що визначає клінічну картину ІМ та його прогноз (Голіков, 2004); однак, як виявилося, введення сполуки L-17 призводить до заміщення ексудативного деструктивного запалення, яке головним чином обумовлюється поліморфно-ядерними лейкоцитами, клітинним продуктивним запаленням, що характеризується домінуванням мононуклеарних клітин в інфільтраті. Ймовірно, це розвиток ексудативного деструктивного запалення, яке може посилити ішемію та реперфузійне пошкодження міокарда та сприяти поширенню ділянки некротичної тканини (Tommasi et al. 1999).
Таким чином, дослідження, проведені тут, показали, що сполука L-17 забезпечує принципово новий підхід до лікування ІМ, що означає зміну структури запальної реакції таким чином, щоб забезпечити домінування захисних фізіологічних реакцій організму.
Висновки
Застосування сполуки L-17 в експериментальному ІМ індукує заміщення ексудативного деструктивного запалення клітинним продуктивним запаленням, що призводить до зменшення початкової некротичної площі та зменшення ішемії міокарда та реперфузійної травми та прискорює процес відновлення.
Подяка
Це дослідження було підтримане спеціальним грантом міждисциплінарного проекту Інституту імунології та фізіології та Інституту органічного синтезу Уральського відділення РАН (2009–2011).
- Дитяча жовтяниця Російська Федерація PDF PPT Звіти про випадки лікування Симптоми
- Лікування безпліддя для жінок із СПКЯ CS Mott Children's Hospital Michigan Medicine
- Мезотерапія - лікування мезотерапією - целюліт - лікар-косметолог
- Мезотерапія лікування целюліту; Зниження жиру в Нью-Йорку, Вестчестер; Бронкс
- ГІСТОПАТОЛОГІЧНІ ЕФЕКТИ МІСЦЕВО-СИСТЕМНОГО ОБРОБКИ ОЗОНУ В ЕКСПЕРИМЕНТАЛЬНОЙ ТИМПАНІЧНІЙ МЕМБРАНІ