Нормативні Т-клітини поза аутоімунітетом: від вагітності до раку та серцево-судинних захворювань
Еліза Мартіні
1 Лабораторія адаптивного імунітету, Клінічний та дослідницький центр Humanitas, Мілан, Італія
Сільвія Джульяно
2 Лабораторія імунології слизової оболонки та мікробіоти, Клінічно-дослідний центр Humanitas, Мілан, Італія
3 Відділ біомедичних наук, Університет Гуманітас, Мілан, Італія
Марія Решиньо
2 Лабораторія імунології слизової оболонки та мікробіоти, Клінічно-дослідний центр Humanitas, Мілан, Італія
3 Відділ біомедичних наук, Університет Гуманітас, Мілан, Італія
Марінос Калікурдіс
1 Лабораторія адаптивного імунітету, Клінічний та дослідницький центр Humanitas, Мілан, Італія
3 Відділ біомедичних наук, Університет Гуманітас, Мілан, Італія
Анотація
Вступ: Функція вибіркових форм тиску у Treg
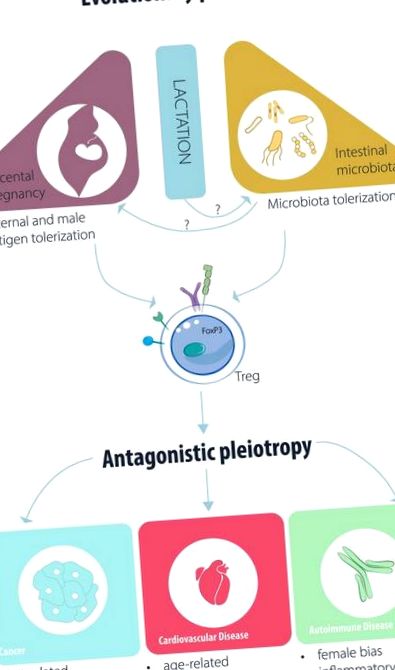
Біологічні системи розвиваються як випадкові розчини селективного тиску, згідно з еволюційною теорією. Еволюція регуляторних Т (Treg) клітин та їх фактор транскрипції головного регулятора, foxp3 (1), мабуть, відбулася у відповідь на селективний тиск, який надав перевагу хребетним, які ними володіли. Хоча рання форма foxp3 існує у даніо (2), повний набір доменів foxp3 з’являється лише у качкодзьоба не-плацентарних ссавців (3). Крім того, підсилювач, необхідний для індукції індукованого Treg (iTreg) на периферії, також вперше з'являється в качкодзьобі (4).
Качкодзьоб - це ссавець, який несе яйце, і яйце створює бар’єр, що відокремлює (несамостійні) батьківські антигени від материнської адаптаційної імунної системи. Відсутність бар'єру вимагало б механізму придушення материнських антифетальних реакцій, що називалося "імунологічним парадоксом вагітності" піонером трансплантації Medawar (5). З іншого боку, усі наступні (з точки зору видоутворення) ссавці є плацентарними, дозуючи яйцеклітину, отримуючи користь від переваги постійного надходження поживних речовин до плода. Таким чином, можна припустити, що випадкове придбання імунодепресивної субпопуляції Т-клітин могло б забезпечити усунення яєчного бар'єру.
На підтвердження такої спекуляції ми та інші показали, що плацентарна вагітність з генетично іншим батьком неможлива за відсутності регуляторних Т-клітин (6–8). Дефекти клітин Treg пов'язані із збільшенням викидня на ранніх стадіях та прееклампсією у людей (9, 10). Підводячи підсумок, хоча міцна адаптивна імунна система, розроблена у хребетних, є важливою для підтримки захисту себе від патогенних мікроорганізмів (11), еволюція клітин Treg у плацентарних ссавців, можливо, дозволила більш складне управління розрізненням самості проти “не-Я того самого виду”. Визнання несамостійності одного виду, що є центральним у плацентарній вагітності, є іронічно набагато старшою проблемою, оскільки протохордат, що мешкає в морі, Ботриллус повинен був відбиватися від конкуренції з боку сусідніх особин цього виду та не терпіти її, використовуючи молекулярні процеси, які не надто відрізняються від процесів клітин природних кілерів (NK) (12). Під час вагітності ссавців NK-клітини матки, що взаємодіють з основними молекулами гістосумісності класу I, такими як HLA-G, незалежно від присутності або відсутності алоантигену, є важливими для васкуляризації плаценти, особливо на початку вагітності (13, 14).
Трег під час вагітності: коливання, але регульоване населення
Докази мишей та людей демонструють, що велика кількість клітин Treg змінюється під час подій, пов’язаних з вагітністю плаценти. Періодичні коливання матки (15) або периферичних (16) рівні трегу роблять клітини більш рясними під час фертильного вікна еструсу/менструального циклу, так що придушення може відбуватися у разі настання вагітності. Ці коливання, можливо, зумовлені естрогеном, оскільки було показано, що естроген посилює функцію Treg (17, 18), тоді як виснажуюча естроген оваріектомія зменшує кількість клітин Treg (19). Як тільки відбувається запліднення, можна спостерігати набагато більш значне розширення клітин Treg (6). У цій експансії було продемонстровано роль експансії Трегу з боку батьків та чоловіків, яка зумовлена антигенами; спочатку у відповідь на антигени насінної рідини (20), а також батьківські антигени (8, 21), що може пояснити клональне розширення клітин Treg у децидуї, але не периферія у вагітних (10).
Що цікаво, розширення, пов’язане з вагітністю, може бути перервано, якщо з’явиться інфекція матки, яка може поставити під загрозу плід та матір (22). З умоглядної еволюційної точки зору буде обрано зниження функціональності Treg, спричинене патогенами, оскільки вони позбавлять матір від патогенів, які можуть неконтрольовано розширюватися в імунодепресованому середовищі. Передбачуваний механізм може включати розпізнавання збудника вродженими імунними клітинами, що продукують IL-6, блокуючи супресивний потенціал Treg (23). Дійсно, IL-6 асоціюється з фертильністю та патологіями, пов’язаними з вагітністю (24), а також відомо, що цитокін опосередковує перетворення клітин Treg у прозапальні клітини Th17 при аутоімунному артриті (25). Слід зазначити, що відторгнення плода, спричинене сигналом небезпеки, може опосередковуватися інваріантними/напівінваріантними лімфоцитами, такими як клітини iNKT (26), інваріантні Т-клітини, пов’язані зі слизовою оболонкою (27), або γδ Т-клітини (28).
Трег в автоімунітеті
Розумно запитати, як функція, найчастіше приписувана клітинам Трега, контроль аутоімунітету, відповідає їх ролі в розмноженні плаценти. Відомо, що вагітність тимчасово полегшує симптоми ревматоїдного артриту у більшості пацієнтів (29). У мишачій моделі аутоімунного артриту ми показали, що розширення Treg, обумовлене вагітністю, справді відповідає за це покращення (30).
Конспекти передбачуваних еволюційних факторів, що впливають на функцію Treg/iTreg та патогенез захворювання.
Після менопаузи та у чоловіків: вікові хвороби
Трег і рак
Зв’язок між запаленням та раком двосторонній. З одного боку, великі результати продемонстрували, що прозапальні цитокіни можуть підвищувати шанси канцерогенезу та генетичної нестабільності (39). Трег-опосередковане придушення такого онкогенного запалення було б корисним. Подібні події явно відбуваються далеко від клінічно спостережуваних станів хворих на рак, діагноз яких відбувається через довгий час після канцерогенної події; це може обмежувати стимул до вивчення ролі клітин Treg у канцерогенезі. Проте навіть при зростаючих пухлинах дані свідчать, що утворення промоторних фіброзних капсул навколо пухлин простати відбувається лише за наявності прозапальних Т-клітин (40), селективне придушення яких було б корисним.
З іншого боку, найбільш клінічно важливою взаємодією між імунітетом та раком є протипухлинна, протизапальна функція імуноспостереження (41), яка дозволила розробити імунотерапію пухлин. Останній, у своїй найбільш застосовній формі імунотерапії з блокуванням контрольних точок, заснований на опосередкованій антитілами реактивації прозапальних Т-клітин. Проте клітини Treg експресують та використовують цільові молекули імунотерапії CTLA-4 (42) та PD-1 (43), а супресивна дія Treg може інгібувати корисний протипухлинний імунітет (44). Чому клітини Treg пригнічують протипухлинну відповідь? Інтерпретовано відповідно до сигналів, з якими клітина Treg, можливо, еволюціонувала, щоб мати справу з нею, пухлина, що експресує власні антигени та неоантигени, може мало чим відрізнятися від плоду, передбачуваного драйвера відбору клітин Treg. Гени та процеси, які допомагають боротися з непедіатричними, зростаючими, солідними пухлинами, не могли бути передані у спадок та відібрані для ссавців, оскільки до недавнього часу було неможливо вижити та розмножитися після захворюваності на рак.
І все ж очевидне рішення справді випливає з, щоправда, спекулятивного, дослідження еволюційних рушіїв функції Трега. Як висувалося вище, придушення Трегу може зруйнуватися, щоб відкинути заражений плід, щоб захистити матір від заражаючого збудника. У цьому контексті, як принципово започаткував токсин Колі (45), стратегії вакцинації, які змушують імунну систему визначити пухлину як заражений плід, можуть представляти собою інструменти, які узгоджуються з еволюційними драйверами біологічних компонентів, які ми намагаємося модулювати (46).
Трег та серцево-судинні хвороби
Зовсім недавно ми встановили, за допомогою послідовності послідовності одноклітинної РНК, що клітини Treg виявили, що проникають у хворий міокард, експресують PD-1. Інгібування PD-1 у здорових серцях блокувало опосередковану Treg супресію, звільняючи серцеві запалення, що, в свою чергу, призводило до значного зниження функції серця (52). Це інтригує, оскільки було показано, що лікування анти-PD-1 у хворих на рак людини іноді призводить до Т-клітинно-опосередкованого фульмінантного міокардиту (53). На щастя, рішення є, оскільки лікування CTLA-4-Ig лікування хворих на міокардит, спричинених імунотерапією пухлини, має рятувальну дію (54).
При ІМ, який переростає у хронічну ішемічну серцеву недостатність, останні дані свідчать про те, що клітини Treg можуть втратити свої імунодепресивні властивості, перетворюючись на прозапальну та погіршуючий результат захворювання (55). Їх роль дещо менш зрозуміла на ранній фазі відновлення після ІМ, де прозапальні звичайні Т-клітини можуть бути корисними в короткий термін для боротьби з великим пошкодженням тканин (56, 57).
Трег та інфекції
Трег може зменшити реакцію на патогени під час інфекції, обмежуючи побічну шкоду. Як наслідок, це також призводить до стійкості збудника, що, в свою чергу, підвищує стійкість захисного імунітету проти самого збудника (58). Тим не менше, одночасно запалення, пов'язане з відповіддю, обмежує функціональність клітин Treg (59), виявлення, яке відповідає пригніченню функції Treg, індукованому вищезазначеними сигналами небезпеки (23), або навіть самим запаленням, в тому числі в контексті серцево-судинних захворювань (60).
Treg та кишкова мікробіота
Плід, що експресує батьківські антигени, не єдиний «не-я», який наша адаптивна імунна система повинна переносити через клітини Treg. Кишкова мікробіота необхідна для нашого виживання і не відкидається (61), незважаючи на те, що досягає дуже високої кількості клітин у кишечнику (62). Толеризація «корисних» бактерій може бути опосередкована шляхом опосередкованого Treg придушення (63), тоді як «шкідливі» бактерії можуть бути атаковані прозапальними субпопуляціями Т-клітин (64). І навпаки, як протизапальні клітини iTreg, так і прозапальні клітини Th17 індукуються в кишечнику, проявляючи пластичність, яка залежить від мікробіоти (65, 66). Наприклад, показано, що імуномодулююча капсула поліахарид А (PSA) Bacteroidetes fragilis індукує IL-10-секретуючі клітини Treg в кишечнику, стримуючи запалення кишечника (67). Крім того, бактеріальні метаболіти, такі як коротколанцюгові жирні кислоти (SCFA), беруть участь у диференціації Трега (68–70).
Наслідки пластичності, спричиненої мікробіоти, можуть вплинути на патогенез захворювання. Описаний вище протипухлинний, протизапальний ефект анти-CTLA-4 або анти-PD-1 був скасований в експериментальних системах, де була ліквідована кишкова мікробіота (71, 72), демонструючи ефективність опосередкованої мікробіоти. ефекти. Згідно з цими вражаючими результатами, багаторазові трансляційні дослідження наголосили на тому, як мікробіом пацієнтів, які реагують на лікування анти-PD-1, суттєво відрізняється від мікробіомів, які не відповідають (73), і як лікування антибіотиками в поєднанні з анти-PD Імунотерапія -1/анти-PD-L1 може мати прямий вплив на рівень виживання пацієнта (74).
Аналогічним чином нові дані свідчать про те, що мікробіом може суттєво впливати на патогенез та результати серцево-судинних захворювань. Зміна мікробіоти кишечника асоціюється з утворенням атеросклеротичного ураження, як виявило аналіз метагеному кишечника у пацієнтів (75). Доведено навіть, що SCFA, що виробляються мікробіоти кишечника, впливають на регуляцію артеріального тиску (76). Вищезазначені дані ілюструють, як мікробіота кишечника, можливо також через їх вплив на популяції iTreg/Th17, виконує значну, хоча все ще в основному невивчену, регулюючу роль у основних групах захворювань, що зумовлюють смертність у всьому світі.
Підсумкові зауваження - Еволюційна роль флори кишечника ссавців перед вагітністю Трег і плаценти?
Взаємодія між мікробіотою кишечника та Treg, особливо якщо гіпотеза про те, що перша, можливо, була рушієм для розвитку останньої, є обґрунтованою, пропонує нові засоби дослідження функціональних аспектів клітин Treg. У довгостроковій перспективі можна було б сподіватися, що це призведе до інноваційних терапевтичних стратегій в контексті аутоімунітету, раку та серцево-судинних захворювань.
Внески автора
Усі перелічені автори внесли значний, прямий та інтелектуальний внесок у роботу та схвалили її до публікації.
Конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Безалкогольна жирова хвороба печінки та серцево-судинний ризик
- Група з непереносимості глютену при вагітності та целіакії
- Харчування під час вагітності з шишкою; «За межами харчування» Розі Леттс
- Вагітність після гастректомії - відсутність шлунку для раку
- Клітини старіння як причина вікових захворювань жирової печінки; Боротьба зі старінням!