Нейропротекторний та антиоксидантний вплив гемодіалізату Актовегін на первинні нейрони щурів in vitro
Мартін В. Елмлінгер
1 Nycomed International Management GmbH, Thurgauerstrasse 130, 8152 Glattpark-Opfikon, Цюрих, Швейцарія
Мартін Крібель
2 Інститут природничих та медичних наук, 72770 Ройтлінген, Німеччина
Ден Циглер
3 Інститут клінічної діабетології, Німецький центр діабету, Центр дослідження діабету Лейбніца при Університеті Генріха Гейне, Дюссельдорф, Німеччина
4 Кафедра метаболічних хвороб, Університетська лікарня, Дюссельдорф, Німеччина
Анотація
Вступ
Діабетична дистальна симетрична полінейропатія (ДПН) вражає приблизно третину хворих на цукровий діабет і пов’язана зі значною захворюваністю, включаючи нестерпний невропатичний біль та виразки стопи, що призводять до ампутації (Ziegler et al. 2008; Boulton et al. 2005). Анальгетики ефективні при лікуванні невропатичного болю (Dworkin et al. 2007), але не уповільнюють прогресування основної нейропатії (Boulton et al. 2005). Були розроблені різні терапевтичні підходи до лікування ДПН (Cameron et al. 2001), які стосуються патології розладу, а не просто полегшують біль (Ziegler et al. 1995; Boulton et al. 2005; Chalk et al. 2007). Однак, незважаючи на очевидний недавній прогрес, потужна стійка терапія ДПН все ще залишається невирішеною медичною потребою.
Показано, що Актовегін, депротеїнізований гемодіалізат, вироблений з телячої крові, що містить низькомолекулярні сполуки до 5000 Да, має суттєві терапевтичні переваги при ДПН. Нещодавно було проведено рандомізоване подвійне сліпе плацебо-контрольоване клінічне дослідження з послідовним внутрішньовенним та пероральним лікуванням актовегіном 567 пацієнтів з ДПН протягом 160 днів (Ziegler et al. 2009). Лікування препаратом Актовегін суттєво покращило такі нейропатичні симптоми, як поріг сприйняття вібрації, сенсорні функції та якість життя пацієнтів з ДПН. Гемодіаліз схвалений у якості лікарського засобу (Актовегін ®) у ряді країн і застосовується для лікування діабетичної полінейропатії та інших захворювань (огляд див .: Buchmayer et al. 2011).
Метою цих досліджень було з'ясувати клітинні ефекти, за допомогою яких актовегін може здійснювати свої сприятливі терапевтичні ефекти в ДПН. Добре відомими фармакологічними діями актовегіну є стимуляція поглинання кисню, використання кисню та клітинний енергетичний обмін (Obermaier-Kusser et al. 1989; Buchmayer et al. 2011). Крім того, він проявляє інсуліноподібну активність, таку як стимуляція транспорту глюкози, піруватдегідрогенази та окислення глюкози (Jacob et al. 1996). Через ці властивості актовегін раніше використовувався для лікування судин головного мозку та дегенеративних розладів (Kanowski et al. 1995; Herrmann et al. 1992). Крім того, гемодіалізати, введені у вигляді інфузій, показали сприятливий вплив на клінічні ознаки деменції (Schlaffer et al. 1991; Beiswenger et al. 2008), що може свідчити про регенеративний ефект на нейрональну тканину.
Матеріали і методи
Підготовка нейрональних культур
Дисоційовані культури нейронів гіпокампа щурів готували за стандартним протоколом (Maar et al. 1997). Тканину гіпокампа з ембріональних плодів щурів 18-го дня збирали у стерильний розчин солі Хенкса (буфер HBSS [Invitrogen, Карлсруе, Німеччина], що містить 7 мМ HEPES, рН 7,3) і трипсинували за допомогою 1 × трипсину – ЕДТА (PAA, Пашинг, Австрія) містить 10 мМ HEPES, рН 7,3. Безсироваткове середовище та умови культивування були пристосовані для росту нейрональних клітин, щоб мінімізувати ріст забруднення інших, наприклад, типів гліальних клітин. Поєднання ядерного фарбування та фазово-контрастної мікроскопії забезпечило, що кількість підрахованих клітин відображає зміни кількості нейрональних клітин. Згодом тканину розтирали в буфері HBSS – HEPES, поки не було видно згустків тканин. Кількість клітин визначали і висівали 2 × 104 клітини/лунку в 100 мкл середовища NMEM-B27 (Burkarth et al. 2007; Goetze et al. 2003) у 96-лункові планшети, покриті полілілізином (Greiner Bio- One, Фрікенхаузен, Німеччина) і культивували при 37 ° C і 5% CO2.
Лікування актовегіном нейронів гіпокампа щурів
Нейрони гіпокампа щурів обробляли зростаючими дозами (0,3, 1, 3, 10, 30, 100, 300, 1000 мкг/мл) актовегіну (Actovegin ®, Nycomed, Лінц, Австрія) додаванням 50 мкл попередньо розведеного маточного розчину до культур, через 5 год після посіву. Випробовували широкий діапазон доз, оскільки було неможливо визначити дозу, яка відповідає дозі, застосовуваній у терапії хворих на цукровий діабет. Клітини культивували при температурі 37 ° C і 5% CO2 у зволоженій атмосфері. Ефекти лікування актовегіном досліджували щодо підтримки культури та синаптичної зв’язку, виростання невритів та нейропротекції (тобто захисту від індукованого Aβ25–35 апоптозу). Крім того, захист актовегіном від окисного стресу (рівні АФК) тестували на нейронах щурів.
Імуноцитохімія
Для імуноцитохімічного маркування дендритів антитілами проти асоційованого з мікротрубочками білка 2 (MAP2; на 3 і 6 дні культури in vitro) для подальшого аналізу невритового наросту та збудливих синапсів (везикулярний глутаматний транспортер 1 (VGlut1); день 10 ) з метою оцінки синаптичної зв’язку культивовані нейрони гіпокампа фіксували 4% параформальдегідом у забуференному фосфатом сольовому розчині (PBS) протягом 15 хв при кімнатній температурі.
Клітини промивали один раз PBS, а потім блокували і замочували блокуючим реагентом (Roche Diagnostics GmbH, Мангейм, Німеччина), що містить 0,2% Triton X-100 (Sigma-Aldrich, Steinheim, Germany), протягом 1 години при кімнатній температурі. Первинні антитіла проти білка 2, асоційованого з мікротрубочками (MAP2; Sigma-Aldrich) і везикулярного транспортера глутамату 1 (VGlut1; Synaptic Systems, Геттінген, Німеччина) розбавляли [1: 1000] в блокуючому реагенті, що містить 0,2% Triton X-100, і інкубували з клітини при 4 ° С протягом ночі. Клітини промивали PBS, і первинні антитіла виявляли за допомогою кон’югованого з Cy3 козячого анти-мишачого IgG (розведеного 1: 600; Діанова, Гамбург, Німеччина) під час 2-годинної інкубації при кімнатній температурі. Ядра фарбували Hoechst 33258 (1 мг/мл; Invitrogen GmbH, Дармштадт, Німеччина). Робоча концентрація 1 мкг/мл була досягнута шляхом розведення 1: 1000 у PBS. Клітини промивали і зберігали при 4 ° C до дослідження за допомогою флуоресцентної мікроскопії. Зображення було здійснено на Zeiss Axiovert 200.
Кількість клітин, наріст невритів та синаптична зв’язок нейронів гіпокампа щурів
Середні довжини нейритів мічених MAP2 культур нейронів визначали, використовуючи ImageJ-Plugin Neurite Average (Інститут природничих та медичних наук, Ройтлінген, Німеччина), який використовує принципи стереології (Ronn et al. 2000). Визначення кількості синаптичних зв’язків мічених VGlut1 культур нейронів та підрахунок кількості клітин проводили за допомогою функції аналізу частинок ImageJ: http://rsb.info.nih.gov/ij/.
Коротко кажучи, Neurite Average проектує віртуальну сітку на мікрофотографії мічених культурами нейронів мічених MAP2 і визначає кількість перетинів цієї сітки з MAP2-позитивними дендритними структурами. Кількість цих перетинів відповідає ступеню дендритної арборизації в даний момент часу. Мікрофотографії пофарбованих нейрональних культур Hoechst 33258- або VGlut1 піддавали порогу та бінеаризували, а отримані сигнали підраховували.
Aβ25–35 Лікування та індукція апоптозу нейронів гіпокампа щурів
Вимірювання окисного стресу
Рівні окисного стресу, тобто рівень АФК, у нейронах гіпокампа щурів визначали на 8-й день після лікування третинним бутил-гідропероксидом (TBHP), щоб стимулювати вироблення АФК експериментально, або на 10-й день після лікування актовегіном, відповідно. У разі обробки TBHP середовище культури клітин замінювали на 8-й день 100 мкл свіжого NMEM-B27 і різні концентрації TBHP додавали до середовища культури клітин, додаючи 50 мкл попередньо розведеного вихідного розчину TBHP в NMEM-B27 до досягти кінцевих концентрацій 0,1, 0,2, 0,3, 0,5, 0,8, 1, 2 та 3 мМ відповідно. Клітини інкубували при температурі 37 ° С та 5% СО2 протягом однієї години, перш ніж піддавати вимірюванню АФК.
Для визначення клітинних рівнів АФК культури нейронів, оброблені TBHP або актовегін, двічі промивали попередньо розігрітим буфером HBSS і після останнього етапу промивання додавали 50 мкл 15-мкМ вихідного розчину c-H2DCFDA (концентрація c-H2DCFDA, 5 мкМ на лунку). Клітини інкубували протягом 25 хв при 37 ° С і 5% СО2, а надлишок c-H2DCFDA змивали попередньо підігрітим HBSS. Інтенсивність флуоресценції (пропорційну загальному вмісту АФК) вимірювали за допомогою зчитувача мікропланшетів Pherastar за допомогою набору фільтрів 485/520 нм. Для того, щоб розрахувати вміст АФК на основі кожної клітини, кількість клітин визначали кількісно в тій же пластині безпосередньо після запису флуоресцентного сигналу за допомогою аналізу життєздатності люмінесцентних клітин CellTiter-Glo ®, описаного вище.
Статистичний аналіз
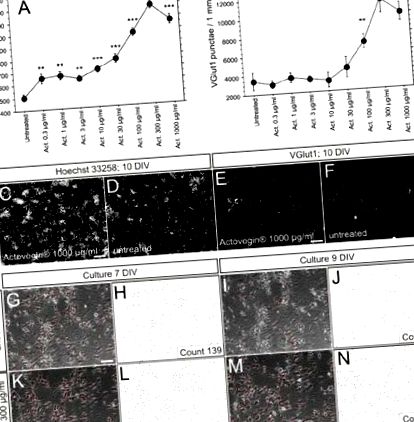
Експериментальні набори даних аналізували за допомогою програмного забезпечення Statview 5.0 (SAS-Institute Inc.) з використанням одностороннього дисперсійного аналізу та пост-тестів PLSD (захищена найменша значуща різниця). Для всіх експериментів було проведено щонайменше три повторення. Усі результати представлені як середні значення ± SEM. Дані вважали суттєво різними при значеннях Р 1 а). Збільшення кількості клітин, що спостерігалося, залежало від дози. Мікрофотографії репрезентативного ядерного та синаптичного фарбування оброблених актовегіном та необроблених культур на 10-й день представлені на рис. 1 c – f. Культури, оглянуті на 7 та 9 день in vitro за допомогою фазово-контрастної мікроскопії, виявили поліпшення підтримки кількості нейрональних клітин та збільшення щільності дендритної сітки в оброблених актовегіном порівняно з необробленими культурами; цей результат було підтверджено ручним підрахунком клітин нейронів (рис. 1 g – n).
Оцінка a номер клітини через фарбування ядер і b загальне число збудливих синапсів через везикулярний транспортер глутамату 1 (VGlut1), забарвлене на 10 день in vitro після інкубації первинних нейронів щурів із збільшенням концентрації Актовегіну ® (закон; 0,3–1 000 мкг/мл) порівняно з необробленими клітинами. Кожна побудована точка представляє середнє значення, отримане з шести повторних свердловин; рядки помилок представляють SEM. *** P ® або не оброблений (шкала шкали: 200 мкм [C], 50 мкм [E]). g-n: Репрезентативні фазові контрастні мікрофотографії та ручне визначення нейронів у необроблених (g-j) та Актовегін ® 300 мкг/мл (k-n) первинні культури нейронів на 7 та 9 день in vitro, відповідно (шкала на рис. 1c: 200 мкм; шкала на рис. 1e, g, k: 50 мкм; DIV = дні in vitro)
Синаптична зв’язок первинних нейронів щурів
Обговорення
У цьому дослідженні ми використовували нейрони гіпокампа, культивовані з мозку ембріональних щурів, як модель in vitro для вивчення впливу лікарських засобів на тканини нейронів. Нейрони лікували зростаючими концентраціями актовегіну з метою виявлення можливих клітинних ефектів, що може пояснити корисні терапевтичні ефекти у пацієнтів із симптоматичною діабетичною полінейропатією (ДПН).
Оскільки культури нейронів отримували з тканини гіпокампа щурів, можливо, були присутні ненейронні типи клітин, такі як астроцити, і це могло сприяти збільшенню кількості клітин, що спостерігається тут. Однак нейронні клітини можна було легко ідентифікувати за допомогою фазово-контрастної мікроскопії завдяки їх морфології, і розширення гліальних клітин не спостерігалося ні в оброблених актовегіном, ні в необроблених культурах. Більш того, малоймовірно, що набагато більша кількість клітин, що спостерігається після лікування актовегіном, було обумовлено збільшенням кількості ненейрональних клітин, оскільки не було доказів зміни (тобто зменшення) синаптичних контактів на основі кожної клітини як це могло бути спричинено збільшенням кількості ненейрональних клітин.
Для того, щоб пролити світло на природу активних властивостей Актовегіну ®, було проведено ряд експериментів для оцінки ефектів лікування первинних нейронів щурів із збільшенням кількості фетальної телячої сироватки (FCS), яка також отримується з крові телят як актовегін. Тут спостерігалася незначна, але статистично незначима тенденція до збільшення кількості клітин та синаптичних зв’язків при субмаксимальних дозах ФКС. Це може аргументувати посилення корисного ефекту Актовегіну ® завдяки збагаченню активної (их) фізіологічної (их) речовин (и) під час виробництва Актовегіну ® .
Хоча було встановлено, що кількість клітин підтримується у присутності Актовегіну ®, експерименти, що досліджували індукцію апоптозу, припустили, що Актовегін ® сам по собі не впливає на зменшення апоптозу при оцінці на 10 день культури за відсутності індукції апоптозу. такі агенти, як амілоїдні пептиди. Ця очевидна невідповідність говорить про те, що втрата нейрональних клітин може відбуватися за допомогою інших механізмів, крім апоптозу.
Слід, однак, мати на увазі, що, незважаючи на його ясність, актуальність поточного дослідження in vitro для корисних ефектів Actovegin ® in vivo, що спостерігаються у пацієнтів з діабетичною полінейропатією, обмежена і потребує подальшого з'ясування шляхом експериментальних досліджень in vivo підходи, включаючи дослідження на тваринах та людях. Слід зазначити, що найвищі експериментально використовувані концентрації Актовегіну, які перебувають у надфізіологічному діапазоні, показали тенденцію до менш ефективної дії щодо експресії VGlut-1 та кількості клітин.
На закінчення, нейропротекторні ефекти, що спостерігаються in vitro, відповідають результатам попередніх клінічних випробувань (Ziegler et al. 2009; Saletu et al. 1990; Semlitsch et al. 1990) і вказують на те, що Actovegin ® може запропонувати потенційний варіант лікування нейродегенеративні розлади.
Подяка
Спонсор цього дослідження - Nycomed GmbH, Констанц, Німеччина. Автори дякують Андреасу Дікманну, Тетяні Бобровій та Катрін Хузум з Нікомеда за науковий внесок у дослідження та рукопис.
Конфлікт інтересів Спонсор цього дослідження - Nycomed GmbH, Констанц, Німеччина. Мартін Елмлінгер - співробітник Nycomed. Ден Циглер отримав гонорар за доповіді та консультації від Nycomed GmbH. Мартін Крібель, тобто NMI Reutlingen, Німеччина, не має заявляти про конфлікт інтересів.
Відкритий доступ Ця стаття розповсюджується на умовах некомерційної ліцензії Creative Commons Attribution, яка дозволяє будь-яке некомерційне використання, розповсюдження та відтворення на будь-якому носії, за умови зарахування оригінальних авторів та джерел.
- Плейотропний нейропротекторний ефект таксіфоліну при церебральній амілоїдній ангіопатії PNAS
- Нейропротекторні ефекти Momordica charantia Огляд доклінічних досліджень International
- Мірицитрин виявляє антиатеросклеротичні та антигіперліпідемічні ефекти при дієті
- Сортування наслідків алкоголю для здоров’я - Гарвардський журнал охорони здоров’я - Гарвардське здоров’я
- Кверцетин Користь для здоров'я, дозування та побічні ефекти