Негерметична кишка як сигнал небезпеки для аутоімунних захворювань
Цинхуей Му
1 Відділ біомедичних наук та патобіології, Коледж ветеринарної медицини штату Вірджинія-Меріленд, штат Вірджинія-Тех, Blacksburg, VA, США
Джей Кірбі
1 Відділ біомедичних наук та патобіології, Коледж ветеринарної медицини штату Вірджинія-Меріленд, штат Вірджинія-Тех, Blacksburg, VA, США
Крістофер М. Рейлі
2 Едвард Віа Коледж остеопатичної медицини, Блексбург, штат Вірджинія, США
Сінь М. Лоо
1 Відділ біомедичних наук та патобіології, Коледж ветеринарної медицини штату Вірджинія-Меріленд, штат Вірджинія-Тех, Blacksburg, VA, США
Анотація
Вступ
Мікробіота кишечника привертала велику увагу протягом останнього десятиліття (9). Хоча вчені багато років вивчали мікробіоти кишечника, останні досягнення в галузі молекулярної біології, включаючи технологію секвенування наступного покоління, дозволили дослідникам отримати нові знання в цій галузі досліджень. Хоча ми все ще далекі від чіткого розуміння точної ролі та впливу режимів мікробіоти кишечника, все більше свідчень свідчить про те, що мікробіота кишечника важлива для модуляції проникності кишечника та функцій кишкового бар’єру. У цьому огляді ми підсумовуємо останні досягнення у розумінні негерметичної кишки, транслокації бактерій та дисбіозу мікробіоти кишечника, приділяючи особливу увагу їх асоціації з позакишковими аутоімунними захворюваннями, такими як T1D та SLE.
Кишковий бар’єр
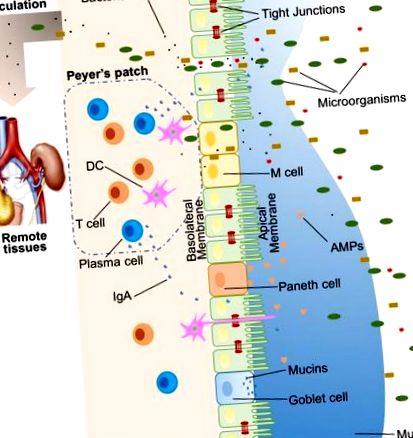
Велика кількість екзогенних речовин колонізує просвіт кишечника, наприклад, мікроорганізми, токсини та антигени. Без інтактного і належним чином функціонуючого кишкового бар’єру ці речовини можуть проникати в тканини під епітеліальною оболонкою кишечника, дифундувати в кров і лімфатичний кровообіг і порушувати тканинний гомеостаз. Однак існує ефективна багатогранна кишкова бар'єрна система з фізичними, біохімічними та імунологічними компонентами, яка запобігає потраплянню більшості патогенів (рис. (Рис. 1). 1). Ці компоненти координуються між собою, щоб запобігти неконтрольованому переміщенню вмісту просвіту в організм. Нижче наводиться короткий огляд основних компонентів, що складають кишковий бар’єр.
Ілюстрація кишкових бар'єрів хазяїна, включаючи фізичний бар'єр (епітелій, щільні з'єднання, слиз, коменсальні бактерії), біомедичний бар'єр [антимікробні білки (АМФ)] та імунологічний бар'єр (лімфоцити та IgA). Також показано мікробна транслокація у віддалені тканини (наприклад, нирки та підшлункова залоза) за наявності негерметичної кишки.
Фізичний бар'єр
У людини кишковий епітелій займає 400 м 2 площі поверхні (1). Хоча клітини епітеліального кишечника (МЕК) є лише одним шаром клітин, вони є опорою кишкового бар'єру та служать фізичним бар'єром (рисунок (рис. 1). 1). Існує щонайменше сім типів функціональних МЕК - ентероцити, келихоподібні клітини, клітини Панета, мікроскладні клітини (М-клітини), ентероендокринні клітини, чашкові клітини та клітини пучка, хоча функції останніх двох популяцій клітин недостатньо вивчені (10 ). Серед усіх цих типів клітин ентероцити становлять абсолютну більшість, що становить щонайменше 90% клітин крипт або клітин ворсинок. Ентероцити є абсорбційними клітинами і життєво важливі для засвоєння поживних речовин. Однак все більше доказів вказує на те, що функції ентероцитів не обмежуються поглинанням поживних речовин. Наприклад, ентероцити можуть контролювати чисельність грампозитивних бактерій, експресуючи RegIIIγ, один тип антимікробних білків (AMP) (11–13). Усі типи епітеліальних клітин походять від стовбурових клітин епітеліального кишечника Lgr5 +, які знаходяться в криптах (14). Коефіцієнт оборотності МЕК високий, і клітини оновлюються кожні 3–5 днів у кишечнику ссавців (10, 15), за винятком клітин Панета, тривалість життя яких становить близько 2 місяців.
Накладка IEC є безперервною, а контакт між IEC герметизований TJ (16). Парацелюлярний шлях, на відміну від трансцелюлярного, дозволяє транспортувати речовини через епітелій кишечника через проміжки між МЕК. Велика кількість молекул, переважно білків, контролює пластичність TJ. Визнано понад 40 білків TJ, включаючи окклюдин, клаудини, молекулу сполучної адгезії А та трицелюлін (17). За різних патологічних станів парацелюлярна проникність може бути підвищена, що призводить до потрапляння небажаних, потенційно шкідливих молекул.
Поверх епітелію кишечника є два шари слизу, внутрішній і зовнішній шари, які покривають всю епітеліальну оболонку кишечника та забезпечують фізичний захист відокремлених просвітніх мікроорганізмів від епітелію. Слиз, організований за допомогою головного компонента, високоглікозильованого гелеутворюючого муцину MUC2, містить різноманітні молекули, включаючи IgA, а також ферменти та білки, такі як лактоферрин (18). Келихоподібні клітини є центральним типом клітин для утворення слизу. Вони не тільки виробляють муцин MUC2, але також секретують інші компоненти слизу, такі як ZG16, AGR2, FCGBP, CLCA1 та TFF3 (19, 20). Коліт спонтанно розвивався у мишей з дефіцитом Muc2, що вказує на критичну роль MUC2 у захисті слизової (21). На додаток до гелеутворюючих муцинів, існує ще один тип муцину, який знаходиться в безпосередній близькості від епітеліальних клітин, який називається трансмембранними муцинами. Ентероцити є основними продуцентами трансмембранних муцинів (20).
Коменсальні бактерії кишечника були описані як один із компонентів кишкового фізичного бар’єру, в першу чергу завдяки його двом основним функціям (22). Перший - сприяти стійкості до колонізації шкідливих або патогенних видів бактерій, конкуруючи за поживні речовини, займаючи місця прикріплення та виділяючи антимікробні речовини (23, 24). Крім того, мікробіота кишечника регулює травлення та поглинання поживних речовин для постачання енергії епітеліальним клітинам, які є головним компонентом фізичного бар'єру (25). Хорошим прикладом прямого енергозабезпечення є вироблення коротколанцюгових жирних кислот мікробіотою кишечника, які використовуються колоноцитами для їх розвитку та метаболізму (26). Взяті разом МЕК, шари слизу та мешканці кишечника служать фізичним бар’єром для обмеження надходження недоброзичливого просвітного вмісту в тканини господаря.
Біохімічний бар’єр
Біохімічні молекули з антимікробними властивостями існують у слизі так само далеко, як і в просвіт, і включають жовчні кислоти та АМФ (27, 28) (рис. (Рис. 1). 1). Ці різноманітні молекули утворюють складну мережу, щоб зменшити навантаження колонізованих бактерій і зменшити ймовірність контакту між просвітніми антигенами та клітинами-господарями. Вони є гарним доповненням до фізичного бар'єру та важливим компонентом бар'єрної функції кишечника.
У проксимальній частині тонкої кишки міститься дуже мало мікроорганізмів (29). Але із збільшенням відстані від шлунка рН зростає, а кількість колонізованих бактерій ескулює (30). Зіткнувшись з великою кількістю мікроорганізмів, які, ймовірно, перевищують кількість клітин-господарів, для боротьби проти загарбників утворюється безліч АМФ. Ці АМФ поділяються на кілька типів, включаючи α- та β-дефензини, лектин С-типу, кателицидин, лізоцим та кишкову лужну фосфатазу (IAP) (27). Їх докладні антимікробні механізми обговорюються в інших місцях (31). Як основний, але не ексклюзивний виробник АМФ, клітини Панета підтримують та опосередковують біохімічну бар’єрну функцію.
Імунологічний бар’єр
Іншим компонентом імунологічного бар’єру є секреторний IgA (SIgA). Як найбільш поширений в організмі імуноглобулін, IgA перебуває переважно на поверхнях слизової оболонки кишечника. Хоча деякі люди з селективним дефіцитом IgA здаються здоровими, SIgA є важливим, оскільки він, мабуть, взаємодіє з коменсальними бактеріями, щоб забезпечити захист від патогенних мікроорганізмів. Унікальною особливістю SIgA є те, що він стійкий до структури в багатих протеазами середовищах, що дозволяє йому залишатися функціонально активним порівняно з іншими ізотипами антитіл на поверхнях слизової (43). У дорослих людей приблизно 50 мг/кг SIgA виробляється щодня плазматичними клітинами, що мешкають у власній пластинці кишечника. Нарешті, SIgA може трансцитозуватися через епітелій і виділятися в просвіт кишечника.
Хоча тут не згадано, самомодулюючі фактори, такі як нерви та різноманітні цитокіни, також важливі для підтримки нормальних функцій кишкового бар'єру.
Мікробіота кишечника та кишковий бар’єр
Мікробіота може бути сприйнята господарем за допомогою рецепторів розпізнавання образів (PRR), таких як платоподібні рецептори (TLR) та нуклеотидно-зв'язуючі домени олігомеризації (NOD), подібні рецепторам (NLR). У кишечнику зв'язок між бактеріями та господарем багато в чому залежить від розпізнавання асоційованих з мікробами молекулярних структур за допомогою PRR, експресованих на імунних та неімунних клітинах. Певні мікробіоти, бактеріальні продукти та метаболіти впливають на кишкову бар’єрну функцію і відповідають за подальший розпад тканинного гомеостазу. Коли є негерметична кишка, коменсальні бактерії в просвіті кишки разом з їх продуктами можуть виходити з просвіту кишки, що може спричинити запалення та спричинити системні пошкодження тканин, якщо їх перенести в периферичний кровообіг (рис. 1). 1 ). Цей процес транслокації називається мікробною транслокацією (44).
Крім того, існує взаємодія між мікробами кишечника та AMP, такими як IAP. Переважно продукуваний IEC, IAP активний або закріплений на мембрані епітелію, або секретується в просвіт кишечника (55, 56). У мишей з дефіцитом IAP було відзначено, що там було менше мікробів і змінений склад бактерій порівняно з контрольними тваринами дикого типу. Зокрема, дослідники відзначили зменшення кількості Lactobacillaceae (57, 58). Посилена регуляція активності IAP може вибірково збільшити пригнічуючі LPS бактерії (наприклад, Bifidobacterium), водночас зменшуючи бактерії, що продукують LPS (наприклад, кишкову паличку) (59). Маючи здатність інактивувати LPS in vivo, IAP є життєво важливим для запобігання транслокації LPS, прозапального стимулу, що походить від бактерій (60, 61). Варто зазначити, що вираження ІАП залежить від присутності мікробіоти. У GF даніо данина, колонізація комменсалів або навіть подача одного ЛПС може достатньо стимулювати експресію IAP (62). Варто згадати, що IAP також може регулювати білки TJ для посилення бар'єрної функції за рахунок збільшення експресії ZO-1, ZO-2 та оклюдину (63). Деякі інші також повідомляли про різні типи АМФ та їх функцію в мікробіоти (64, 65).
Механізми негерметичної кишки
Велика кількість порушників кишкового бар’єру та/або порушників мікробіоти кишечника може потенційно призвести до мікробної транслокації та подальшого запалення локально та системно. Сюди входять дієта, інфекції, вживання алкоголю та опікові травми.
Індукована дієтою кишкова негерметичність
Викликана стресом негерметичність кишечника
Інфекції можуть зіграти певну роль у регуляції слизового бар’єру. Хорошим прикладом є Helicobacter pylori, грамнегативна бактерія, яка інфікує шлунок людини (104). Відомо, що H. pylori безпосередньо підвищує проникність епітелію шляхом перерозподілу білка TJ ZO-1 (105, 106). Крім того, бактеріофаги, які зазвичай не вважаються патогенними для ссавців, можуть мати вплив на негерметичну кишку. Коли щурам давали бактеріофаговий коктейль, що містив фаги проти Salmonella enterica, спостерігали порушення цілісності кишкового бар’єру (107). Автори припустили, що мікробіота кишечника могла бути уражена бактеріофагами, але дані послідовності не були надані на підтвердження їхніх тверджень.
У сукупності збурення мікробіоти кишечника, яке може бути наслідком різноманітних втручань, може призвести до збільшення проникності кишечника та транслокації бактеріальних компонентів та продуктів. Така транслокація мікробів може згодом викликати аномальну імунну відповідь, спричиняючи запалення та/або пошкодження тканин у позакишкових органах.
Негерметичні кишкові та аутоімунні розлади
Кілька захворювань пов’язані з дисбіозом мікробіоти кишечника, дисфункцією кишкового бар’єру та транслокацією мікробів. Сюди входять хвороба Альцгеймера, ALD, рак та множинні аутоімунні розлади. Аутоімунні розлади характеризуються утворенням аутоантитіл проти власних антигенів, які атакують власні тканини організму, що призводить до пошкодження. Генетичні та екологічні фактори довгий час були відомими як головний фактор розвитку аутоімунітету. Збільшення доказів за останні роки свідчить про те, що транслокація мікробів та дисфункція кишкового бар’єру, на які може впливати мікробіота кишечника, є ще одним важливим причинним елементом для аутоімунних розладів (2–6). T1D та SLE - це приклади, розглянуті нижче, які виявляють вдосконалення у розумінні механізмів взаємодії між негерметичною кишкою та аутоімунними розладами.
Діабет 1 типу
Системний червоний вовчак
Зміна негерметичної кишки як потенційна терапія
Внески автора
Усі перелічені автори внесли значний, прямий та інтелектуальний внесок у роботу та схвалили її до публікації.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
Виноски
Фінансування. Підготовка цієї публікації була підтримана Національним інститутом алергії та інфекційних хвороб Національного інституту охорони здоров’я за номером премії R03AI117597. За вміст несуть виключну відповідальність автори і не обов'язково відображають офіційні погляди Національних інститутів охорони здоров'я.
- Знижує ризик серцево-судинних захворювань - 🍑 Найкращий спосіб безпечного схуднення Дієта Magic Plus
- Періодичне голодування може бути ключем, який допоможе вилікувати негерметичну кишку
- Хвороби серця у котів - Хвороби котів Hill s Pet
- Рослинні засоби від серцевих захворювань, аюрведичне лікування
- Хвороби людини - Хвороби харчування Брітаніка