Механізми, що лежать в основі обмеження калорій та регулювання тривалості життя
З кафедри фізіології (Z.U., A.C.), Нью-Йоркський медичний коледж, Вальхалла; Лабораторія експериментальної геронтології (C.P.-F., R.d.C.), Національний інститут старіння, Національний інститут охорони здоров’я, Балтимор, штат Массачусетс; та Laboratorio de Biología Celular (C.P.-F.), Університет Кордови, Іспанія.
З кафедри фізіології (Z.U., A.C.), Нью-Йоркський медичний коледж, Вальхалла; Лабораторія експериментальної геронтології (C.P.-F., R.d.C.), Національний інститут старіння, Національний інститут охорони здоров’я, Балтимор, штат Массачусетс; та Laboratorio de Biología Celular (C.P.-F.), Університет Кордови, Іспанія.
З кафедри фізіології (Z.U., A.C.), Нью-Йоркський медичний коледж, Вальхалла; Лабораторія експериментальної геронтології (C.P.-F., R.d.C.), Національний інститут старіння, Національний інститут охорони здоров’я, Балтимор, штат Массачусетс; та Laboratorio de Biología Celular (C.P.-F.), Університет Кордови, Іспанія.
З кафедри фізіології (Z.U., A.C.), Нью-Йоркський медичний коледж, Вальхалла; Лабораторія експериментальної геронтології (C.P.-F., R.d.C.), Національний інститут старіння, Національний інститут охорони здоров’я, Балтимор, штат Массачусетс; та Laboratorio de Biología Celular (C.P.-F.), Університет Кордови, Іспанія.
Анотація
Цей огляд зосереджений на нових доказах того, що послаблення продукції активних форм кисню та пригнічення запальних шляхів відіграють центральну роль у протистарінні серцево-судинних ефектів обмеження калорій. Особливий акцент робиться на потенційній ролі окислювально-відновної системи плазматичної мембрани в шляхах, індукованих обмеженням калорій, відповідальних за відчуття окисного стресу та підвищення стійкості клітинного окислювального стресу. Ми припускаємо, що обмеження калорій збільшує біодоступність NO, зменшує утворення судинних активних форм кисню, активує шлях реакції елемента відповіді Nrf2/антиоксидант, індукуючи системи детоксикації активних видів кисню, надає протизапальну дію і, таким чином, пригнічує ініціацію/прогресування судинних захворювань, що супроводжують старіння.
Окислювальний стрес, старіння та плазматична мембрана
Мітохондрії є основним джерелом виробництва АТФ. Під час окисного фосфорилювання мітохондрій утворюються активні форми кисню (АФК). АФК пов’язані з пошкодженням ДНК, ліпідів та білків. 14–16 Патологія старіння та вікові захворювання включають окислювальний стрес як ранню стадію свого розвитку, 17–19, що підтверджується зниженням антиоксидантного захисту та збільшенням окислювальної шкоди. 20,21 Старіння також пов'язане зі зміною рівнів антиоксидантної здатності та окислювальної шкоди, що нібито призводить до порушення мітохондрій. Ці зміни були пов’язані із збільшенням окисного пошкодження ДНК, 22–25 ліпідів, 26,27 та білків. 23,28–30 Накопичення мутацій мітохондріальної ДНК, які зазвичай ідентифікуються при вікових захворюваннях, викликають порушення мітохондріальних комплексів, 31–33, включаючи активність мітохондріального комплексу III у похилому серці. 34 Порушення функції мітохондрій спричиняє дефіцит надходження АТФ, що призводить до подальших проблем у біохімічних шляхах. 31
Теорія вільних радикалів старіння 35,36 викликала значний інтерес щодо пошуку можливих біохімічних основ процесів старіння. Багато минулих досліджень показали, що CR зменшує вироблення АФК, тим самим мінімізуючи окислювальну шкоду. 37,38 Ці дослідження в сукупності привели до гіпотези, що ХР за рахунок зменшення окисного стресу продовжує тривалість життя. Мембрани мітохондрій 39 та плазми 40 є місцями активного та рясного утворення АФК, і тому вони мають високий ризик пошкодження АФК. Отже, з цього випливає, що центральний механізм дії CR може включати зміни мембрани, які або зменшують вироблення АФК, або протистоять окислювальним пошкодженням.
Було запропоновано, що тривалість життя обернено пов'язана зі ступенем ненасиченості фосфоліпідів мембрани 41,42, і що з'ясування цього зв'язку може надати розуміння механізму продовження тривалості життя з CR. 43 Модуляція сприйнятливості мембрани до перекисного окислення, проте, може бути занадто спрощеною, щоб пояснити процеси старіння, оскільки ця гіпотеза, здебільшого, не розглядає інші процеси, пов'язані з мембраною. Такі процеси включають зміни в клітинній сигналізації, витоки протонів (та інших іонів), 44 вироблення АФК, 39 індукцію апоптозу, 45 та підтримку антиоксидантних систем. 46–49 Індуковані мембраною зміни в будь-якому з цих процесів можуть мати серйозні наслідки, що впливають на окислювальний стрес і тривалість життя.
CR підвищує Q-залежні редуктази в плазматичних мембранах in vivo та in vitro
Коензим (Co) Q сприяє стабілізації плазматичної мембрани, регенерує такі антиоксиданти, як аскорбат та α-токоферол, та регулює позаклітинний індукований керамід-залежний шлях апоптозу. 49,50 NAD (P) H-залежні редуктази діють на плазматичну мембрану для регенерації CoQH2, сприяючи збереженню її антиоксидантних властивостей. В цілому, як CoQ, так і його редуктази (рис. 1) складають антиоксидантну окислювально-відновну систему трансплазматичної мембрани, відповідальну за вищеописані функції. 51–53 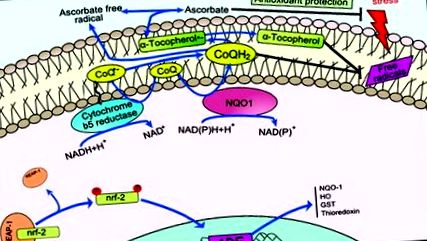
Фігура 1. Схема окисно-відновної системи плазматичної мембрани. Окислювально-відновний цикл показаний синім кольором. CoQ означає окислену форму коферменту Q; CoQ · -, напівхіноновий радикал; CoQH2, відновлена форма коферменту Q; NQO1, NADH-хінон-оксидоредуктаза. Змінено з Hyun et al. 46
CR індукує рівні білка SIRT1 In vivo та in vitro
SIRT1 розподіляється у всіх досліджених тканинах ссавців та модулює клітинний та тканинний гомеостаз, взаємодіючи з метаболічними та стресовими білками та факторами. Наявні дані свідчать про те, що SIRT1 регулює енергетичний метаболізм, ендокринну сигналізацію та деякі реакції на стрес. 83 SIRT1 також індукується широким розмаїттям сигналів у відповідь на CR 79 або натще, 84 що свідчить про широку роль у фізіології ссавців. Стає очевидним, що сиртуїни регулюються стресом та станом поживності дріжджів, глистів, мух та ссавців. 70,79,86,87 Шляхи ендокринного та енергетичного метаболізму координують розвиток і фізіологію організму і є невід'ємними для таких патологій, як рак, нейродегенерація та діабет. Ці системи реагують на різноманітні зовнішні сигнали, такі різноманітні, як навколишнє середовище, стрес та поживні речовини. Sir2 протилежним чином регулює як реплікативні 88, так і хронологічні 89 тривалість життя дріжджів. Додаткові копії генів сиртуїну продовжують тривалість життя багатоклітинних організмів, таких як глисти, мухи та риби. 86,90,91 В принципі, розуміння того, як ці шляхи реагують на фактори навколишнього середовища та харчування, може допомогти нам розробити успішну терапію.
SIRT1 регулює декілька факторів транскрипції, які регулюють реакції на стрес, енергетичний метаболізм та ендокринну сигналізацію, включаючи активований проліфератором пероксисом рецептор (PPAR) γ, коактиватор PPARγ 1 (PGC1) -α, фактори транскрипції вилки (FOXO), рецептор печінки X (LXR ) та p53. 92–98 Існує все більше даних, що підтверджують, що SIRT1 регулює енергетичний обмін, ендокринні сигнали та деякі реакції на стрес. 83,99 Біологічні ефекти, виявлені для сиртуїнів, підживили припущення, що сиртуїни модулюють процеси, що впливають на тривалість життя, вікові захворювання, діабет та пухлину. 100
Вазопротекторні ефекти CR
Показано, що CR послаблює атерогенез у гризунів. 108 Серцево-судинні ефекти CR, що спостерігались до цього часу, узгоджуються з думкою, що CR може надавати вазопротекцію людям, хоча наслідки CR на прогресування атеросклерозу та склад зубного нальоту у людей похилого віку або вікових приматів 109 все ще недостатньо добре задокументовані. Загалом, КР може впливати на здоров’я судин як шляхом поліпшення системних факторів ризику розвитку ішемічної хвороби серця (наприклад, рівня ліпідів і глюкози в плазмі крові, кров’яний тиск), так і шляхом модуляції клітинних функцій та експресії генів в клітинах ендотелію та гладких м’язів, які створюють мікросередовище в судинна стінка, яка не сприяє атерогенезу (наприклад, ослаблення продукції АФК, протизапальний ефект).
CR покращує профіль факторів серцево-судинного ризику
CR підвищує біодоступність NO та покращує функцію ендотелію
Малюнок 2. Розширення у відповідь на збільшення внутрішньосвітлового потоку (A) або введення ацетилхоліну (B) в ізольованих, канюльованих артеріолах м'язів першого порядку (діаметр: ≈100 мкм; тиск до 80 мм рт. Ст. 74) у віці (24 місяці) старі) Щури F344, які харчуються за стандартною дієтою (SD), погіршуються порівняно з молодими судинами. CR протягом усього життя зберігав як мікросудинну, так і макросудинну функцію ендотелію. *P виробництво в аорті щурів F344 запобігає довічному CR. *P
Механізми, за допомогою яких CR підвищує біодоступність NO, що покращує ендотеліальну функцію у старих гризунів, ймовірно, включають підвищення регуляції eNOS (рис. 2C та 2D). Хоча вихідні медіатори (і) судинних ефектів CR недостатньо зрозумілі, є дані, які свідчать про те, що CR може регулювати як активність eNOS, так і експресію за допомогою активації SIRT1. Цікаве дослідження нещодавно повідомило, що SIRT1 і eNOS колокалізуються в ендотеліальних клітинах і що SIRT1 дезацетилює eNOS, стимулюючи активність eNOS і збільшуючи оксид азоту ендотелію. 123 Крім того, CR у мишей призводить до деацетилювання eNOS, 123 тоді як було показано, що надмірна експресія SIRT1 або активатори SIRT1 індукують експресію eNOS в ендотеліальних клітинах. 124 Обов’язково необхідні подальші дослідження, щоб з’ясувати, чи призводить активація SIRT1 до підвищеної біодоступності NO, що покращує функцію ендотелію у людей у віці з ХР.
CR може послабити запалення судин у старінні
CR послаблює окислювальний стрес у судинній системі
Nrf2: Новий шлях до вазозахисту
Висновки та перспективи
Оригінал отриманий 20 листопада 2007 р .; редакція отримана 9 січня 2008 р .; прийнято 15 січня 2008 р.
- Нові висновки щодо механізмів регулювання температури тіла жировою тканиною
- Нові норми охорони здоров’я вимагатимуть попередження про надмірну калорійність, цукор, насиченість
- Фізична активність та регулювання маси тіла Американський журнал клінічного харчування Оксфорд
- Надмірна вага ожиріння - незадоволена потреба - Детальний, розширений аналіз (USEU) Дослідження; повідомляє ДРГ
- Для нарощування м’язів не потрібно зайвого (!) Надлишку калорій; Бурак Джеміль