l-орнітин l-аспартат (LOLA) як новий підхід до терапії неалкогольної жирної хвороби печінки
Алі Канбей
Кафедра гастроентерології, гепатології та інфекційних хвороб, Університет Отто-фон-Геріке, Магдебург, Лейпцигерська вул. 44, 39120 Магдебург, Німеччина
Ян-Пітер Сова
Кафедра гастроентерології, гепатології та інфекційних хвороб, Університет Отто-фон-Геріке, Магдебург, Лейпцигерська вул. 44, 39120 Магдебург, Німеччина
Анотація
NAFLD: Визначення, причини та поширеність
Безалкогольна жирова хвороба печінки (НАЖХП) - це спектр захворювань, заснованих на стеатозі печінки без значного вживання алкоголю (≥ 20 г/добу жінок; ≥ 30 г/добу чоловіків) [1]. Безалкогольна жирова печінка (НАФЛ) - це просто накопичення жиру у вигляді крапель ліпідів у гепатоцитах, а безалкогольний стеатогепатит (НАСГ) як прогресуюча форма з часточковим запаленням та балонна дегенерація гепатоцитів. В даний час NAFLD та NASH визнані печінковими проявами метаболічного синдрому та як такі, що базуються на надмірному споживанні калорій, недостатній активності та фізичних навантаженнях та отриманих надлишкових складах жирової тканини. Факторами ризику розвитку НАЖХП є ожиріння, цукровий діабет 2 типу (Т2ДМ), гіпертонія та дисліпідемія з підвищеними ферментами печінки або без них. Існують й інші можливі причини стеатозу печінки, тобто HCV-інфекція, ліки та генетичні причини (целіакія, хвороба Вільсона, дефіцит ліпазоми лізосомальної кислоти), які слід виключити під час діагностики. Однак, оскільки загальна поширеність НАЖХП зросла приблизно до 25% після пандемії ожиріння [2], більшість випадків НАЖХП та НАСГ обумовлені надмірною вагою та ожирінням.
Патофізіологія НАЖХП та НАСГ
Сучасні консервативні та фармакологічні методи лікування НАЖХП
Таблиця 1
Фармакологічні компоненти для лікування НАЖХП або НАСГ у клінічних випробуваннях фази III.
Таблиця адаптована за [10]
| Обетихолова кислота | Агоніст фарнезоїд-X-рецептора | Поліпшення чутливості до інсуліну та зниження рівня глюконеогенезу та тригліцеридів у сироватці крові |
| Елафібранор | Подвійний агоніст для активованих проліфератором пероксисом рецепторів-α та -δ | Поліпшення гомеостазу глюкози та обміну інсуліну та зменшення запалення. |
| Ценікривірок | Антагоніст 2 і 5 типів рецепторів хемокінів (мотив С-С) | Знижена запальна реакція на пошкодження гепатоцитів клітинами Купфера, згодом зменшила фіброз |
| Селонсертіб | Інгібітор кінази 1, що регулює сигнал апоптозу | Зменшення запалення печінки, апоптозу та фіброзу гепатоцитів внаслідок окисного стресу |
На емпіричній основі багато перспективних цілей для фармакотерапії є багатообіцяючими: інсулінорезистентність печінки та системно, а також фактори, що впливають на саму печінку. У клінічних випробуваннях фази III речовинами, що претендують на участь, є обетихолова кислота (6-етилхенодезоксихолева кислота), елафібранор, ценікривірок та селонсертиб (таблиця 1). Для отримання детальної інформації про поточну ситуацію з фармакологічними варіантами лікування НАСГ зверніться до огляду Alkhouri et al. [10].
Обгрунтування LOLA як можливого лікування НАЖХП
Серед багатьох функцій метаболізму амінокислот печінки катаболізм та детоксикація аміаку виконуються в гепатоцитах. Вони ще не досліджені як потенційні цілі для лікування НАЖХП або НАСГ. l -орнітин l-аспартат (LOLA) - це суміш ендогенних амінокислот, яка повинна сприяти виведенню аміаку у пацієнтів з цирозом печінки [11]. У наступному розділі ми пропонуємо гіпотетичний підхід до лікування метаболічних змін при НАЖХП за допомогою ЛОЛА. На сьогодні деякі з потенційних наслідків розслідуються, і тому вони лише умоглядні.
Відомі гепатопротекторні ефекти LOLA
Метаболізм азоту в м’язах та інших периферичних тканинах призводить до утворення аміаку, який через цикл сечовини перетворюється в печінці та виводиться з сечею [12]. Порушення функції печінки призводить до підвищення концентрації аміаку [13]. При гострій, гострій хронічній та хронічній печінковій недостатності аміак накопичується через зменшену активність циклу сечовини. Високі концентрації аміаку в сироватці крові пов’язані з печінковою енцефалопатією (ВЕ), апоптозом гепатоцитів, запаленням, порушенням функції печінки та високою смертністю [13, 14].
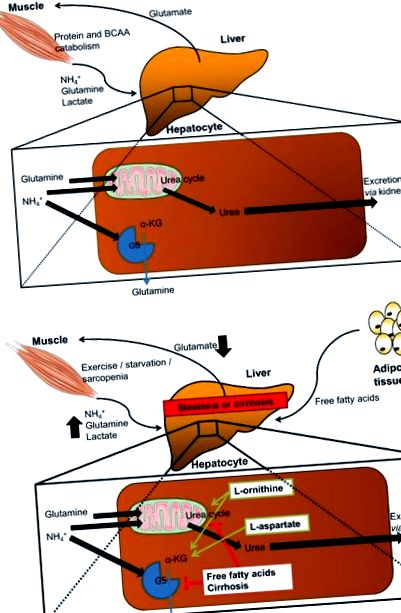
LOLA застосовується у пацієнтів із цирозом печінки для поліпшення мінімального рівня ВІН шляхом посилення виведення аміаку з досі функціональних гепатоцитів [15]. Передбачається, що LOLA впливає на видалення аміаку, з одного боку, посиленим синтезом сечовини, а з іншого боку, посиленим синтезом глутаміну через фермент глутамін-синтетазу (GS) [15]. Крім того, похідний LOLA глутамат також може бути перетворений в глутатіон, який є важливим антиоксидантом для гепатоцитів. На додаток до прямого впливу LOLA на печінку внаслідок посиленого виведення аміаку та покращеної антиоксидантної здатності, можуть спостерігатися непрямі гепатопротекторні ефекти внаслідок часткового зворотного розвитку саркопенії [16] та утворення оксиду азоту (NO) з l -аргініну, що призводить до поліпшення мікроциркуляції печінки [17]. Ці передбачувані прямі та непрямі ефекти LOLA були продемонстровані в доклінічних та невеликих клінічних дослідженнях, чекаючи підтвердження у більших випробуваннях (рис. 1).
Вироблення та детоксикація аміаку та передбачувані механістичні мішені LOLA для лікування НАЖХП. a Детоксикація аміаку в здорових умовах: аміак (NH3) утворюється як побічний продукт від катаболізму білка та амінокислот з розгалуженим ланцюгом (BCAA) і систематично транспортується як амоній (NH4 +). Детоксикація NH4 + у печінці здійснюється або за допомогою циклу сечовини, частина якого знаходиться в мітохондріях, або за допомогою ферменту глутамінсинтетази (GS). Для цих реакцій необхідні глутамін та α-кетоглутарат (α-KG; отримані з BCAA або малату). b Передбачувані ефекти стеатозу або цирозу на детоксикацію аміаку (червоний) та передбачуваний механізм l -орнітину l-аспартату (LOLA; зелений). При цирозі продуктивність циклу сечовини знижується, а запаси глютаміну, а також α-KG вичерпуються, що призводить до накопичення NH4 + та токсичних ефектів, тобто печінкової енцефалопатії. LOLA повинен підсилювати цикл сечовини за допомогою l -орнітину та l-орнітину, отриманого глутаматом. Як l -орнітин, так і l-аспартат можуть поповнювати запаси α-KG. Крім того, l-орнітин може забезпечити антиокислювальну здатність шляхом відновлення глутатіону та оксиду азоту, отриманого l-аспартатом, може покращити мікроциркуляцію печінки (обидва не показані)
Аміак як можливий чинник травми печінки в НАЖХП
Ефективність LOLA в доклінічних моделях та дослідженнях НАЖХП
До цього часу більшість досліджень щодо ефективності LOLA проводились при цирозі або його моделях. Однак існує кілька доклінічних досліджень, які можуть вказати на можливий вплив LOLA на НАЖХП. У двох дослідженнях експериментального цирозу та ВІН описано, що зниження аміаку покращує саркопенію у циротичних щурів Sprague – Dawley за рахунок стабілізації метаболізму амінокислот [22], і що лікування LOLA призвело до значного збільшення плазмового глютаміну, який, ймовірно, походить від l -орнітину через GS [23]. Показано, що глютамін є захисним у доклінічних моделях НАЖХП та НАСГ, можливо завдяки зменшенню окисного стресу [24, 25]. Непрямі дані свідчать про те, що LOLA може зменшити пошкодження печінки при НАЖХП шляхом зменшення аміаку та окисного стресу.
Короткий зміст та висновки
Сучасні дані підтверджують вирішальну роль аміаку у запущених захворюваннях печінки. Дані доклінічних моделей та невеликої кількості клінічних випробувань підтверджують тезу про те, що LOLA має гепатопротекторні властивості при цирозі. У пацієнтів з НАЖХП або НАСГ, як видається, LOLA знижує сироваткові концентрації печінкових ферментів та тригліцеридів. Ротативні механізми впливу LOLA на НАЖХП полягають у посиленому виведенні аміаку, підвищеній антиоксидантній здатності та послабленому перекисному окисленні ліпідів глутаміном та глутатіоном, поліпшеній мікроциркуляції печінки завдяки NO-похідному l -аргініну. Ці ефекти слід досліджувати в добре контрольованих клінічних умовах, щоб продемонструвати, чи може LOLA бути можливим лікуванням НАЖХП або НАСГ.
Примітки
Фінансування
Ця стаття опублікована у спеціальному додатку до журналу, який повністю фінансується Merz Pharmaceuticals GmbH, Франкфурт, Німеччина.
Примітки
Конфлікт інтересів
Професор Алі Канбай отримав грант на дослідження від MERZ та нагороди спікерів від MERZ, Falk, Shire та GILEAD. Ян-Пітер Сова заявляє, що у нього немає конфлікту інтересів.
- L-орнітин L-аспартат для лікування саркопенії при хронічній хворобі печінки Приборкання
- L-орнітин L-аспартат порошок від постачальника оптової торгівлі - харчування Profoods
- Liv 52 відгуки, дозування, користь при жировій печінці, догляд за печінкою в бодібілдингу
- Запальна хвороба кишечника Ранкова діарея Знати про симптоми, причини та профілактику
- Форма озонотерапії HOCATT ™; Красуня Порт-Елізабет