Локалізація, ідентифікація та висічення жирових складів миші
Адріен Манн
1 Кафедра екстреної медицини Медичного коледжу Університету Цинциннаті
Еллі Томпсон
1 Кафедра екстреної медицини Медичного коледжу Університету Цинциннаті
Натан Роббінс
1 Кафедра екстреної медицини Медичного коледжу Університету Цинциннаті
Андра Л. Бломкалнс
1 Кафедра екстреної медицини Медичного коледжу Університету Цинциннаті
Анотація
Вступ
Адіпозе помітно з’явився в центрі уваги ЗМІ через різке збільшення ожиріння протягом останніх кількох десятиліть 20 століття. В даний час ожирінням страждає більше третини дорослих та 17% дітей та підлітків у Сполучених Штатах (США) 1. Охоплюючи всі етнічні групи, статистичні дослідження, що стосуються епідемії ожиріння, показали, що неіспаномовні чорношкірі мають найвищий коефіцієнт ожиріння з урахуванням віку (49,5%) порівняно з американцями Мексики (40,4%), усіма іспаномовними (39,1%) Латиноамериканські білі (34,3%) 2. Економічний ефект ожиріння також зростає занепокоєнням системи охорони здоров’я. У 2012 році було підраховано, що річна вартість медичних послуг на лікування ожиріння в США у 2005 році становила 190,2 мільярда доларів, що становить майже 21% від загального бюджету на медичні витрати. На жаль, за оцінками, ожиріння серед дітей лише на прямі медичні витрати призвело 14 мільярдів доларів. Статистично було встановлено, що середні медичні витрати на людей із ожирінням були на 2741 долар США на рік вищими, ніж у тих, хто не страждає на це 3-5 .
Ожиріння є основним фактором ризику для різних станів, таких як: діабет 2 типу, дисліпідемія, серцево-судинні захворювання, рак, розлади м'язового скелета та хронічне запалення. Ожиріння глибоко пов'язане з патогенезом метаболічного синдрому та інших хронічних захворювань 6-8. Маючи такі різкі та негативні зв’язки між ожирінням та іншими супутніми захворюваннями, наукові дослідження зосередили увагу на тому, щоб краще зрозуміти сучасну епідемію та різноманітні та ключові ролі жирової.
Історично жирова тканина вважалася незначною і розглядалася просто як проста тканина для заповнення. В даний час показано, що жирова кислота відіграє багато важливих ролей у функціонуванні організму: обмін речовин, регуляція гормонів, запалення, захист та ізоляція 9. Жирова тканина складається переважно з адипоцитів, але також містить перицити, ендотеліальні клітини, моноцити, макрофаги та плюрипотентні стовбурові клітини 8. Жирова тканина розподіляється по всьому тілу у різних депо. Основні депо можна знайти підшкірно, підшкірно, внутрішньом’язово та вісцерально 10. Показано, що жирові депо мають специфічні для депо метаболічні профілі, які демонструють специфічну схильність депо до ожиріння та пов'язаних з цим розладів 8 .
Традиційно жирова тканина класифікується на два основних типи: білу жирову тканину (WAT) і коричневу жирову тканину (BAT); хоча недавня література вказує на присутність третьої групи охрещеного брита або бежевого жиру 11. Показано, що жирова тканина має різні кольори, морфологію, метаболічні функції, біохімічні особливості та генетичні закономірності вираження 10. Адипоцити у ВАТ мають одну велику краплю ліпідів і мітохондрії в різній кількості. ВАТ переважно міститься в підшкірних та вісцеральних ділянках тіла. ВАТ функціонує насамперед як місце зберігання енергії та захисту органів. Адипоцити в БАТ мають мультилокулярну морфологію та рясні мітохондрії. BAT знаходиться переважно в області шиї та великих кровоносних судин грудної клітки, а також лопаток 12. BAT головним чином функціонує в енерговитратах, що регулюють термогенез 7. Показано, що жирний або бежевий адипоз має аналогічну морфологію та експресію BAT, але було встановлено, що походить від білих адипоцитів 11 .
Метою цього протоколу є надати точний метод ідентифікації та ізоляції різних типів жирових депо з різних анатомічних місць.
Протокол
ПРИМІТКА: Усі процедури на тваринах проводились із схвалення Інституційного комітету з догляду та використання тварин (IACUC) Університету Цинциннаті та відповідно до Керівництва з догляду та використання лабораторних тварин від Національного інституту охорони здоров’я (публікація NIH No . 85-23, переглянутий 1996).
1. Евтаназію та стерилізацію миші
Помістіть мишу в коробочку, що містить надтерапевтичну дозу ізофлурану, і дайте вдихнути для ефекту. Після того, як миша буде евтаназована, вийміть з коробки.
Вивих шийки матки як другий засіб евтаназії.
Стерилізуйте зовнішню поверхню миші, очищаючи тварину 70% етанолом.
2. Виявлення та виділення трьох різних жирових депо
Ізоляція коричневої жирової тканини (НДТ):
Переконайтеся, що хутро мокрий від очищення спиртом, щоб допомогти прорізати епідермальний та шкірний шари.
Розташуйте мишу в положенні лежачи спиною до столу.
Візьміть щипцями шкіру трохи нижче діафрагми, підніміть і розріжте ножицями.
Розріжте поперек по колу миші, щоб оголити очеревину.
Розкрийте депо BAT у формі метелика, знекровивши верхню половину миші. Тримайте нижні придатки та живіт однією рукою, підтягуючи шкіру вгору до голови.
Орієнтуйте мишу так, щоб вона розташовувалася на столі лежачи. Будьте обережні, щоб не забруднити відкрите депо волоссям.
Очистіть хірургічні інструменти та змініть нову пару рукавичок.
Знайдіть лопатки та відповідне депо. Акуратно видаліть будь-яку поверхневу білу жирову тканину зверху метелика, а потім розсічіть метелика з міжлопаткового коричневого жиру. Будьте обережні, щоб уникати м’язів, тісно пов’язаних з коричневим жиром. ПРИМІТКА. Для видалення білого жиру, а також для відділення коричневого жиру від лопаток рекомендується використовувати дисекційний мікроскоп.
Видаліть жировий склад і перенесіть його в мікропробірну пробірку об’ємом 2 мл.
Якщо потрібно виділити РНК або білок, заморозьте тканину зануренням у рідкий азот і зберігайте при -80 ° C. Відразу заморозьте зразок, щоб запобігти деградації. При культивуванні покрийте тканину ДМЕФ-12 і поставте на лід, поки не будуть зібрані всі зразки для культури (додаткова інформація).
Виділення підшкірної жирової тканини (SQ), депо білої жирової тканини (WAT):
Одягніть свіжу пару рукавичок, щоб не перехресне забруднення між жировими депо.
Розкрийте пахові трикутні депо SQ, знявши рукавички з нижньої половини миші. Тримайте однією рукою верхні придатки та грудну клітку, а другою рукою тягніть шкіру до стоп.
Орієнтуйте мишу в лежачому положенні, дотримуючись обережності, щоб не забруднити відкрите депо волоссям.
Очистіть хірургічні інструменти та змініть нову пару рукавичок.
Обережно розсічіть трикутники жиру SQ. Будьте обережні, щоб не забруднити зразок м’язами, сусіднім жиром, молочними залозами або вирізавши будь-які судини та не забруднити зразок кров’ю. ПРИМІТКА. Рекомендується використовувати дисекційний мікроскоп, якщо межі чітко не визначені.
Видаліть жирові депо та перекладіть у пробірки для мікроцентрифуги об’ємом 2 мл.
Якщо потрібно виділити РНК або білок, заморозьте тканину зануренням у рідкий азот і зберігайте при -80 ° C. Заморожте зразок відразу, щоб запобігти деградації.
Для фарбування зафіксуйте або вставте в OCT. При культивуванні покрийте тканину DMEF-12 і поставте на лід, поки не будуть зібрані всі зразки для культури (додаткова інформація).
Виділення жиру статевих залоз з вісцеральної жирової тканини (ПДВ) та депо білої жирової тканини (WAT):
Одягніть свіжу пару рукавичок, щоб не перехресне забруднення між жировими депо.
Ножицями розріжте очеревину поперечно, безпосередньо під діафрагмою. Розріжте очеревину від діафрагми до прямої кишки в середині вінця, щоб оголити органи черевної порожнини.
Знайдіть яєчка або яєчники та ідентифікуйте прикріплену білу жирову тканину, відому як епідидимальна жирова клітина у чоловіків або жирова залоза у жінок.
Очистіть хірургічні інструменти та змініть нову пару рукавичок
Ретельно розсічіть обидва епідидимальні жирові депо з яєчок, епідидимідів та васа деференції. Або якщо жінка, обережно розсічіть обидві жирові прокладки на гонадах з яєчників.
Видаліть жирові депо та перекладіть їх у пробірки для мікроцентрифуги об’ємом 2 мл.
Якщо потрібно виділити РНК або білок, заморозьте тканину зануренням у рідкий азот і зберігайте при -80 ° C. Заморожте зразок відразу, щоб запобігти деградації.
Для фарбування зафіксуйте або вкладіть в OCT. При культивуванні покрийте тканину ДМЕФ-12 і поставте на лід, поки не будуть зібрані всі зразки для культури (додаткова інформація).
3. Виділення периваскулярної жирової тканини (PVAT)
Ізоляція серця:
Розмістіть мишу в положенні лежачи на спині, витягнувши назовні верхній і нижній відростки.
Закріпіть придатки за допомогою хірургічної стрічки.
Після розташування миші, як зазначено вище, створіть напругу, піднімаючи на мечоподібний відросток щипцями. Розріжте горизонтально через діафрагму, оголюючи нижню частину грудної порожнини.
Зберігаючи напругу, піднімаючи на мечоподібному відростку, проріжте грудну клітку вгору в напрямку до голови, лише з боку грудини.
Візьміть грудну клітку, що трохи поступається ключиці, і розріжте вздовж нижньої довжини ключиці у напрямку до пахвової западини в обох напрямках. Грудна порожнина та її вміст (серце, легені тощо) тепер повинні бути чітко видно.
Очистіть грудну порожнину від сторонньої крові та рідини, використовуючи стерильну марлю для всмоктування рідини. Якщо збір органів або судин обов’язково рясний (додаткова інформація).
Після очищення ділянки від рідини розріжте бронхи та приєднайте судини, щоб видалити легені, що дозволяє краще оголити серце.
Локалізація та висічення периваскулярної жирової тканини аорти (PVAT):
Видаліть такі органи, щоб краще ідентифікувати нижчі частини аорти: печінку, шлунок, селезінку, підшлункову залозу, кишечник і товсту кишку.
Спочатку починайте з ідентифікації шлунка та стравоходу. Розріжте стравохід у шлунково-стравохідному з’єднанні, щоб звільнити шлунок від тіла.
Далі визначте кишечник і навколишню брижу. Поверхово проріжте брижу, оскільки вона лежить дуже близько до ниркової частини аорти, а потім "проведіть кишечник".
Розріжте товсту кишку якомога ближче до прямої кишки. Таким чином, звільняючи шлунок, кишечник і товсту кишку від миші.
Видаліть шлунок, кишечник, товсту кишку, підшлункову залозу та селезінку, прорізаючи прикріплену брижу та судини. Підшлункова залоза і селезінка повинні звільнитися разом із шлунком, кишечником і товстою кишкою.
Видаліть печінку, прорізавши печінкові вени і прикріпивши брижу, видаліть усі частки.
Відріжте вісцеральний шар і жир оточують нирки. Залиште нирки прикріпленими до аорти in vivo, щоб вони служили географічними маркерами для різних сегментів аорти.
Промийте область стерильним 1x PBS і видаліть всю рідину шляхом поглинання стерильною марлею.
За допомогою мікроножиць та мікро-щипців відокремте аорту від її спинного кріплення до хребта та вентрального кріплення до стравоходу.
Ізолюйте аорту, слідуючи і від'єднуючи аорту довжиною низхідної аорти від початку в серці до біфуркації в клубовій області.
Визначте та ізолюйте підключичні судини. Ізолюйте ці судини від шийки до кореня аорти, щоб краще оголити аортальний зв’язок і корінь у серці.
Видаліть тимус, а потім переріжте брахіоцефальну артерію, ліву загальну сонну артерію та ліву підключичну артерію, дозволяючи рух серця.
За допомогою дисекційного мікроскопа огляньте шар периваскулярної жирової тканини (PVAT), що оточує аорту.
Дуже обережно, щоб не затиснути і не стиснути ПВАТ, обережно витягніть ПВАТ із аорти мікро-щипцями. Акуратно розріжте прикріплення PVAT до аорти за допомогою мікроножиць, починаючи з грудної області, трохи вище, ніж розташована діафрагма. ПРИМІТКА: Рекомендується дисекційний мікроскоп.
Повторіть цей процес по всій довжині аорти, закінчуючи в області інфраренальної аорти, яка розташована безпосередньо вище від клубової біфуркації судини аорти.
Якщо потрібна PVAT дуги аорти, використовуйте той самий метод для видалення PVAT з меншої кривизни дуги.
Помістіть зразки ПВАТ у пробірку (и) мікроцентрифуги об’ємом 2 мл.
Якщо потрібно виділити РНК або білок, заморозьте тканину зануренням у рідкий азот і зберігайте при -80 ° C. Відразу заморозьте зразок, щоб запобігти деградації. Якщо культивують, покривають тканину DMEF-12 і встановлюють на лід, поки не будуть зібрані всі зразки для культури (додаткова інформація). ПРИМІТКА. Додаткові жирові депо, які слід розглянути, якщо зацікавлені у всебічному аналізі жирового депо, включають: заочеревинну, брижову, сальникову, перикардіальну та підколінні.
Репрезентативні результати
Ідентифікація та локалізація пахової підшкірної жирової, міжлопаткової коричневої жирової, вісцеральної епідидимальної жирової (Фігура 1), а також дуги аорти, периваскулярні жирові, грудні аортальні жири, надниркові аортальні жири та інфраренальні жири аорти (Малюнок 2) було успішно досягнуто з використанням описаного хірургічного методу. Гістологічне дослідження та диференціація між зразками BAT та WAT були позитивно оцінені за допомогою фарбування гематоксиліном та еозином (H&E) (Малюнок 3). Аналіз рівнів РНК адипонектину (AdipoQ), гамма-рецептора, що активується проліфератором пероксисоми (PPAR-γ), DFFA-подібного ефектора a (CIDEA), що індукує загибель клітин, та інших специфічних для жиру маркерів вимірювали для всіх вищезазначених ізольованих та вирізаних депо (дані не відображаються).
Первинні клітинні лінії підшкірних адипоцитів та периваскулярних адипоцитів культивували та диференціювали від преадипоцитів до адипоцитів успішно для аналізу мікрочипів. Культивовані преадипоцити, перетворені в адипоцити, підтверджували фарбуванням Oil Red O (Малюнок 4). Було досягнуто успішного виділення, посіву та диференціювання адипоцитів для використання в дослідженнях in vitro, і активність білка була успішно виміряна. Ферментативну активність матриксної металопротеази-2 (MMP2) вимірювали в групі лікування порівняно з контролем. Активність MMP2 вимірювали in situ у первинній периваскулярній лінії адипоцитів за допомогою зимографії (Малюнок 5).
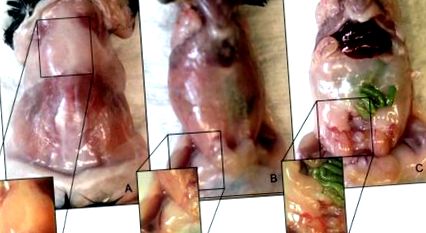
Рисунок 1. Анатомічне розташування жирових депо самців мишей C57BL/6. (A) Міжлопаткове депо жирового жиру. (B) Депо підшкірної жирової жирової клітковини. (C) Вісцеральний епідидимальний склад жирового жиру. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Рисунок 2. Анатомічне розташування складів PVAT у миші-самця C57BL/6. (A) Дуга аорти периваскулярне жирове депо. (B) Периваскулярне жирове депо грудної аорти. (C) Наднирково-аортальне периваскулярне жирове депо. (D) Інфраренальне периваскулярне жирове депо аорти. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Рисунок 3. H&E фарбування жирних речовин НДТ та ВАТ. (A) H&E фарбування зафіксованого параформальдегіду, вкладеного в парафін C57BL/6 зразка чоловічої миші жирової тканини WAT при збільшенні 40X. (B) H&E фарбування з фіксованим параформальдегідом, вкладеним у парафін C57BL/6 зразком чоловічої миші BAT при збільшенні 40X. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Малюнок 4. Масляне червоне фарбування O культивованих преадипоцитів та адипоцитів PVAT. (A) Масляно-червоне фарбування окультурених периваскулярних периваскулярних преадипоцитів аорти на початковій лінії диференціації при збільшенні 20X із фазовим контрастом. (B) Масляно-червоне фарбування окультурених периваскулярних адипоцитів аорти через 5 днів диференціації при 20-кратному збільшенні з фазовим контрастом. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Рисунок 5. Зимографія диференційованих адипоцитів, виділений з периваскулярної жирової тканини, продемонстрував знижену активність MMP2, що виділяється після лікування, порівняно з необробленими (контрольними) клітинами, * P 13-14 .
У рамках цієї методології існує кілька етапів, які життєво важливі для ізоляції та чистоти зразка. Чистка інструментів, рукавичок і поверхонь, часто для видалення волосся та забруднень, є обов’язковим кроком для уникнення забруднення депо. Розрізаючи шкіру поперек навколо окружності миші, щоб викрити очеревину для глищення, життєво важливо уникати надмірного різання. Різання очеревини дуже ускладнить дегловізацію та підвищить потенціал забруднення зразка. При вирізанні жирових депо SQ життєво важливо визначити трикутні межі депо перед висіченням будь-якого з жирових відкладень. Крім того, слід робити обережні порізи, щоб уникнути м’язів, сусідніх судин, залоз та жирової тканини. Це запобіжить забрудненню зразка жирами, тканинами залоз, м’язами або кров’ю, що чергуються.
Основне обмеження ізоляції та висічення жирових депо у цьому методі та інших порівнянних методах можна знайти у визначенні меж певних депо. Через погано визначені межі депо, таких як підшкірні депо, ізоляція, в якій відсутня невелика кількість забруднень із сусіднього жиру, може бути складною. Ще одне обмеження можна знайти у забезпеченні збору достатньої кількості тканини для додаткових експериментів у судинних сховищах. Це обмеження іноді вимагає об’єднання зразків, хоча це залежить від місця ізоляції та раціону, пов’язаного з твариною.
Після виділення жирових депо їх можна використовувати для різних аналізів. Жирову клітковину можна використовувати для молекулярних досліджень, таких як експресія білка, активність ферментів та аналіз експресії генів. Крім того, можна виділити адипоцити для досліджень первинних клітин in vitro. Безсмертні клітинні лінії також можуть бути використані для досліджень in vitro, однак безсмертні клітини не настільки надійні, як первинні ізольовані клітинні лінії. Нарешті, жирову клітковину можна зафіксувати або заморозити в ОКТ для гістологічного дослідження для виявлення лейкоцитарної інфільтрації, локалізації білка, а також для характеристики морфології адипоцитів.
Розкриття інформації
Автори заявляють, що у них немає конкуруючих фінансових інтересів чи інших конфліктів інтересів.
- Протокол виявлення та розрізування різноманітних жирових депо мишей
- Дозрілі компоненти хмелю, що гірчать, індукують термогенез у коричневій жировій тканині через симпатичний нерв
- Гриб омарів (Hypomyces lactifluorum) Ідентифікація; Інформація
- ЧИ Є РОЛЬ ХРАНЕННЯ ФАРМАЦЕВТІВ
- Гавайська вечеря з курячого аркуша - гарне життя в передмісті