Лазерно-синтезовані оксид-пасивовані яскраві квантові точки Si для біовізуалізації
Предмети
Анотація
Наночастинки кристалічного кремнію (Si) представляють надзвичайно перспективний об'єкт для біовізуалізації на основі фотолюмінесценції (PL) у видимій та ближній інфрачервоній областях спектра, але їх ефективне викид PL у водну суспензію зазвичай спостерігається після мокрих хімічних процедур, що призводить до проблем залишкової токсичності. Тут ми вводимо ультрачисті синтезовані на лазері квантові точки (КТ) на основі Si, які диспергуються у воді та демонструють яскравий екситон PL у вікні відносної прозорості тканини близько 800 нм. Заснований на лазерній абляції кристалічних мішеней Si в газоподібному гелію з подальшою дисперсією осаджених плівок у фізіологічному сольовому розчині за допомогою ультразвуку, запропонований спосіб дозволяє уникнути будь-яких токсичних побічних продуктів під час синтезу. Ми демонструємо ефективний контраст КТ Si в живих клітинах, слідуючи екситону PL. Ми також показуємо, що підготовлені КТ не викликають жодних ефектів цитоксичності, проникаючи в клітини та ефективно накопичуючись біля клітинної мембрани та в цитоплазмі. У поєднанні з можливістю створення паралельних терапевтичних каналів ультрачисті наноструктури Si, синтезовані лазером, представляють унікальний об'єкт для терапевтичного застосування раку.
Вступ
Тут ми повідомляємо про вирішення проблеми вторинної токсичності яскраво люмінесцентної вододисперсійної Si-КТ на основі лазерного синтезу. Утворюється шляхом лазерної абляції з твердої речовини c-Si ціль у газоподібному Він і вирощується в лазерно-плазмовому середовищі, Si нанокластери відчувають майже ідеальну кристалізацію, за якою відбувається пасивація поверхні киснем під час їх дії повітря (пасивація оксидом). Після диспергування у водних розчинах оксид пасивується Si КТ демонструють сильний PL на основі екситону з QY у кілька відсотків без додаткових процедур вологої хімії. КТ не демонструють жодних ознак токсичності, демонструють біологічну здатність до розкладання та відмінне поглинання клітин, що робить їх ідеальними кандидатами для застосування біовізуалізацій.
Результати і обговорення
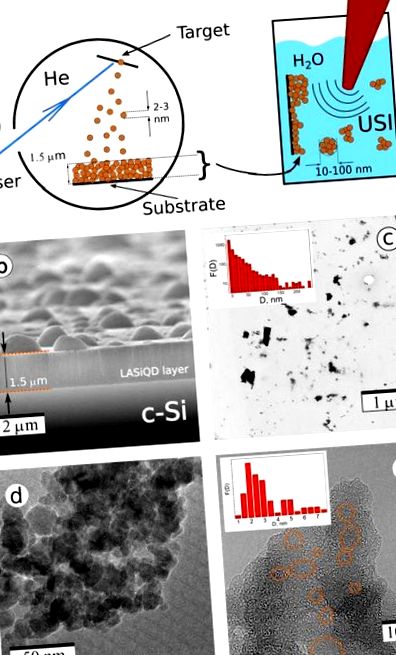
(a) Лазерно-аблятивний синтез наноструктур Si. (a) Схеми двоступеневого лазерного синтезу: Лазерна абляція а c-Si ціль в залишковому Він газ призводить до осадження наноструктурованої LA-Si плівка (ліва панель); потім плівку обробляють ультразвуковим опроміненням у водному фізіологічному розчині, що призводить до видалення Si нанокристали та утворення вододисперсних НП; (b) Скануюча електронна мікроскопія (SEM) зображення лазерно-абляційної Si-на основі наноструктурної плівки, нанесеної на c-Si підкладка; Трансмісійна електронна мікроскопія (TEM) (c) та зображення TEM із високою роздільною здатністю (d, e) Лос-Анджелеса-Si НЧ, отримані методом ультразвукового фрезерування лазерно-аблятованих наноструктурованих плівок. Помаранчеві еліпси зображують Si нанокристали.
На рис. 1в представлено типове зображення просвічуючої електронної мікроскопії (ТЕМ) Si наночастинки (NP), отримані після етапу ультразвукування та відповідного розподілу за розмірами NP перед будь-яким фільтруванням за розміром (вставка). Можна помітити, що, незважаючи на наявність великих агломератів, більшість лазерно-аблятованих Si NP (LA-Si NP) мають діаметр менше 100 нм, що робить їх придатними для біомедичних застосувань. Більше того, великі LA-Si НП представляють агрегації дрібних наночастинок (рис. 1г) і можуть розпадатися під час їх зберігання у водних середовищах (рис. 2в). Тонка структура типового ЛА-Si НП можна побачити на зображенні HRTEM на рис. 1д. Видно, що ці LA-Si НЧ складаються з хаотично розподілених кристалічних зерен (позначаються помаранчевими кружечками), включених у пористу матрицю. Така матриця в основному складається з аморфного SiOx, як це було раніше засвідчено 33,37,38. Як випливає з даних FTIR (див. Рис. S2 у Додатковій інформації), склад верхнього шару близький до діоксиду кремнію, тобто. х = 1,95 ± 0,05, але глибші шари свідчать про наявність частки субоксидної фази, близької до SiO1,5 38. Це можна трактувати як неоднорідне покриття, що означає майже сполуку SiO2 на поверхні та SiOx (х 13 .
Властивості LA-Si QD.
(а) Спектри фотолюмінесценції LA-Si наноструктуровані плівки (червона крива) та водні суспензії LA-Si NP (чорна крива); (b) типовий перехідний ФЛ для смуги екситонів (1.5 еВ). На вставці показано перехідний рівень PL для смуги, пов'язаної з дефектами, на рівні 2.7 еВ; (c) Динамічні спектри розсіяння світла від LA-Si Агломерати QD після різного часу їх зберігання в сольовому розчині.
Ефективна ФЛ з лазерно-аблятованих плівок та суспензій Si QD - це приємний сюрприз, враховуючи це Si наноструктури, виготовлені більшістю альтернативних сухих методів, таких як лазерний піроліз силану 1,22,26, не забезпечують люмінесценції перед додатковим етапом вологої хімічної обробки в розчинах HF-HNO3. Ми вважаємо, що утворення сильно люмінесцентних КТ Si у нашому випадку зумовлене особливими умовами росту кристалів у лазерно-плазмовому шлейфі та їх подальшою пасивацією в навколишньому повітрі. Відомо, що шлейф аблят Si нанокластери здатні ефективно іонізувати атоми навколишнього середовища Він газу і, таким чином, утворюють плазму з відносно довгим (> 1 мс) життям 47. Видно неозброєним оком завдяки характерному випромінюванню люмінесценції, така область плазми іонізованого газу може досягати відстаней 1,5–2 см від цілі. Хоча нанокластери рухаються з відносно високою швидкістю (
В пробірці візуалізація LA-Si НП в ракових клітинах.
Зображення конфокальної флуоресцентної мікроскопії ракових клітин CF2Th, інкубованих з LA-Si NP (кольорові червоні, рожеві та частково фіолетові) під різними шкалами збільшення (a – c) та контрольної проби без НЧ (d). Панель (c) представляє клітини після вимивання з LA-Si КТ з позаклітинного простору. Ядра клітин пофарбовані в синій колір, їх цитоплазма забарвлена в зелений колір на панелях (б – г).
Таким чином, інкубація Si КТ в живі клітини не викликає жодних токсичних ефектів, тоді як НЧ легко проникають у клітини і концентруються в різних клітинних регіонах, крім ядер. Наявність НЧ можна ефективно відстежувати за допомогою червоно-синього випромінювання смуг ФЛ Si QD.
Висновки
На закінчення ми підготували та дослідили лазерну абляцію Si наночастинки, що складаються з дрібних Si КТ як нові контрастні речовини для фотолюмінесцентного біовізуалізації. Наночастинки отримували методами імпульсної лазерної абляції з c-Si ціль в газоподібному (Він) навколишнього середовища з наступним ультразвуковим подрібненням нанесених лазером плівок у водних розчинах. Слідуючи сигналам фотолюмінесценції від Si КТ, які ми засвідчили, були чудовими Si наночастинки раковими клітинами та їх ефективне накопичення в різних клітинних регіонах. Застосування таких КТ не виявляє жодних ознак залишкової цитотоксичності, що робить їх надзвичайно перспективними кандидатами для завдань біологічної візуалізації.
Методи
На першому кроці ми використовували звичайну геометрію імпульсного лазерного осадження в газовій атмосфері. Випромінювання імпульсного лазера KrF (довжина хвилі: 248 нм, тривалість імпульсу: 17 нс, частота повторення: 10 Гц) використовувалося для абляції матеріалу від обертової мішені c-Si ((100) -орієнтованої c-Si пластини n-типу, питомий опір 10 Ом · см) 33. Випромінювання було сфокусовано на фокусній плямі 2 мм 2 на цілі під кутом падіння 45 °, що дало інтенсивність випромінювання близько 5 * 10 8 Вт/см 2. Підкладки на основі пластин c-Si, ідентичні мішені, поміщали на обертовий тримач підкладки на 2 см від цілі. Експериментальну камеру відкачували до залишкового тиску 10−7 Торр перед заповненням гелієм (чистота 99,9995%) для осадження при постійному тиску близько 1–2 Торр. Товщина плівки після десяти тисяч лазерних знімків становила близько 1 мкм.
Водні суспензії LA-Si НЧ отримували ультразвуковою обробкою лазерно-аблятованих плівок в деіонізованій воді або сольовому розчині (0,9% NaCl в H2О) за 1 h. Щільність потужності та частота ультразвуку становили 5 W/см 2 і 44 кГц, відповідно.
Зображення скануючої електронної мікроскопії (SEM) отримували за допомогою мікроскопа Tescan Lyra 3 XM з роздільною здатністю 1,2 нм і прискорювальна напруга 30 кВ. Зображення трансмісійної електронної мікроскопії (ТЕМ) отримували за допомогою мікроскопа Zeiss Libra 120 з роздільною здатністю 0,5 нм і прискорювальна напруга 120 кВ. ТЕМ-зображення з високою роздільною здатністю забезпечували мікроскоп JEOL JEM-2100F з роздільною здатністю 0,8 Å та прискорювальною напругою 200 кВ. Розподіл розмірів NP та QD розраховували за допомогою програмного забезпечення ImageJ.
Спектри PL вимірювали за допомогою спектрометра SOLAR, обладнаного CCD-блоком від Hamamatsu. Всі спектри були скориговані на спектральну реакцію вимірювальних систем. Перехідні процеси PL були виявлені за допомогою фотопомножувача R928 (Hamamatsu Photonics, Hamamatsu, Shizuoka, Japan) при імпульсному лазерному опроміненні азотним лазером (довжина хвилі збудження 337 нм і тривалість імпульсу 10 росіяни). Часова реакція системи виявлення була коротшою, ніж 1 мкс. Квантовий вихід PL вимірювали шляхом порівняння інтенсивності PL та поглинання зразків з розчинами родаміну 6 G (PL QY близько 100%).
Щоб мінімізувати шуми при вимірюванні КР, ми опустили краплю водного розчину НЧ LA-Si на зразки нержавіючої сталі. Крім того, в окремому експерименті ми наносили наноструктуровані шари Si на підкладки CaF2. Спектри КРС вимірювали за допомогою мікрораманівського спектрометра від Horiba Jobin Yvon, довжина хвилі збудження становила 488 нм, максимальна щільність потужності збудження становила 10 Вт/см 2, спектральна роздільна здатність становила 0,1 см -1 . Щоб уникнути несприятливого нагрівання використовували набір ослаблюючих фільтрів (0,3, 0,6, 1 і 2 дБ). Розподіл розмірів НП вимірювали за допомогою динамічного розсіювання світла (DLS) Zetasizer ZS від Malvern. Пористість LA-Si фільми та композиція Л.А.-Si НЧ вивчали за допомогою інфрачервоного (ФТІР) спектрометра з перетворенням Фур'є Bruker IFS 66v/S. Перед вимірюванням спектрів FTIR суспензії LA-Si НП осідали на кристалі ATR, потім сушили на повітрі і евакуювали при 10-3 Торр.
В пробірці експерименти з біовізуалізації проводили з клітинами CF2Th (тимус собаки), інфікованими геном зеленого флуоресцентного білка (GFP). Останній індукувався індуктором RSL-1, доданим до культури CF2Th, за 30 год до аналізу біовізуалізації. GFP характеризувався лінією флуоресценції при 515 нм (зелене світло). LA-Si НП були введені в культуру клітин 5 h після ін'єкції індуктора і 25 h до експерименту. 30 хв до експерименту клітинні ядра просочували 5 мг Хохст, який світився поблизу 460 року нм (синє світло). Клітини, що містять LA-Si НП вивчали за допомогою конфокального флуоресцентного мікроскопа Leica TCS SP5 з багатобарвним освітленням при 488 нм, 496 нм, 514 нм, 543 нм та 633 нм, щоб забезпечити одночасне збудження як КТ Si, так і клітин, забарвлених ГФП і забарвлених барвником Хохста.
Додаткова інформація
Як цитувати цю статтю: Гонгальський, М. Б. та ін. Лазерно-синтезовані оксид-пасивовані яскраві квантові точки Si для біовізуалізації. Наук. Респ. 6, 24732; doi: 10.1038/srep24732 (2016).
- Як прати подушку, щоб вона пахла свіжо - Звіти споживачів
- Джеймі; s Харчова революція; Антологія яскравих плям
- Як люди перешкоджають чистій воді - Scientific American
- Любовні ручки Вивчіть ці наукові методи втрати жиру, щоб їх видалити
- Міжнародна науково-практична конференція; Здорове харчування - здорова нація; відбувся о