Контроль центральної нервової системи щодо прийому їжі та маси тіла
Анотація
Здатність регулювати споживання їжі у відповідь на мінливі потреби в енергії має важливе значення для виживання. Недавній прогрес дозволив зрозуміти молекулярні, клітинні та поведінкові механізми, які пов'язують зміни запасів жиру в організмі з адаптивними корекціями поведінки годування. Фізіологічне значення цієї системи гомеостатичного контролю підкреслюється важким ожирінням, яке виникає внаслідок порушення функції будь-якого з кількох його ключових компонентів. Ця нова інформація забезпечує біологічний контекст, в якому можна розглянути глобальну епідемію ожиріння, та визначає численні потенційні шляхи терапевтичного втручання та майбутніх досліджень.
Параметри доступу
Підпишіться на журнал
Отримайте повний доступ до журналу протягом 1 року
лише 3,58 € за випуск
Усі ціни вказані у нетто-цінах.
ПДВ буде додано пізніше під час оплати.
Оренда або купівля статті
Отримайте обмежений за часом або повний доступ до статей на ReadCube.
Усі ціни вказані у нетто-цінах.
Список літератури
Сімс, Е. А. та ін. Ендокринні та метаболічні ефекти експериментального ожиріння у людини. Останній Prog. Горм. Рез. 29, 457–496 (1973)
Leibel, R. L., Rosenbaum, M. & Hirsch, J. Зміни у витратах енергії внаслідок зміни маси тіла. Н. Енгл. J. Med. 332, 621–628 (1995)
Кеннеді, Г. Роль депо-жиру в гіпоталамічному контролі надходження їжі у щурів. Proc. Р. Соц. Лонд. B 140, 578–592 (1953)
Schwartz, M. W., Woods, S. C., Porte, D. Jr, Seeley, R. J. & Baskin, D. G. Контроль центральної нервової системи над прийомом їжі. Природа 404, 661–671 (2000)
Гарофало Р. С. Генетичний аналіз сигналізації інсуліну в Росії Дрозофіла. Тенденції розвитку ендокринолу. Метаб. 13, 156–162 (2002)
Кімура, К. Д., Тіссенбаум, Х. А., Лю, Ю. та Рувкун, Г. daf-2, ген, подібний рецептору інсуліну, який регулює тривалість життя та діапаузу у Caenorhabditis elegans. Наука 277, 942–946 (1997)
Doyon, C., Drouin, G., Trudeau, V. L. & Moon, T. W. Молекулярна еволюція лептину. Gen. Comp. Ендокринол. 124, 188–198 (2001)
Чжан Ю. та ін. Позиційне клонування миші ожиріння ген та його гомолог людини. Природа 372, 425–432 (1994)
Farooqi, I. S. та співавт. Ефекти терапії рекомбінантним лептином у дитини з вродженою недостатністю лептину. Н. Енгл. J. Med. 341, 879–884 (1999)
Heymsfield, S. B. та співавт. Рекомбінантний лептин для зниження ваги у дорослих із ожирінням та худорлявих організмів: рандомізоване, контрольоване, дослідження підвищення дози. J. Am. Мед. Доц. 282, 1568–1575 (1999)
De Souza, C. T. et al. Вживання жирної дієти активує прозапальну реакцію та індукує резистентність до інсуліну в гіпоталамусі. Ендокринологія 146, 4192–4199 (2005)
Munzberg, H., Flier, J. S. & Bjorbaek, C. Регіон-специфічна стійкість до лептину в гіпоталамусі мишей із ожирінням, спричинених дієтою. Ендокринологія 145, 4880–4889 (2004)
Bruning, J. C. та співавт. Роль рецептора інсуліну мозку в контролі маси тіла та відтворення. Наука 289, 2122–2125 (2000)
Коен, П. та ін. Вибіркове делецію рецептора лептину в нейронах призводить до ожиріння. J. Clin. Інвестуйте. 108, 1113–1121 (2001)
Batterham, R. L. та співавт. Кишковий гормон PYY3–36 фізіологічно пригнічує споживання їжі. Природа 418, 650–654 (2002)
Каммінгс, Д. Е. та співавт. Підвищення рівня греліну в їжі перед їжею свідчить про роль у розпочатому прийомі їжі у людей. Діабет 50, 1714–1719 (2001)
Tschop, M., Smiley, D. L. & Heiman, M. L. Грелін викликає ожиріння у гризунів. Природа 407, 908–913 (2000)
Наказато, М. та ін. Роль греліну в центральній регуляції годівлі. Природа 409, 194–198 (2001)
Рен, А. М. та ін. Грелін посилює апетит і збільшує споживання їжі у людей. J. Clin. Ендокринол. Метаб. 86, 5992 (2001)
Каммінгс, Д. Е. та співавт. Рівень греліну в плазмі після індукованої дієтою втрати ваги або шлункового шунтування. Н. Енгл. J. Med. 346, 1623–1630 (2002)
Ді Марцо, В. та ін. Ендоканабіноїди, що регулюються лептином, беруть участь у підтримці споживання їжі. Природа 410, 822–825 (2001)
Leibowitz, S. F. & Alexander, J. T. Гіпоталамічний серотонін у контролі харчової поведінки, розміру їжі та маси тіла. Біол. Психіатрія 44, 851–864 (1998)
Leibowitz, S. F., Roossin, P. & Rosenn, M. Хронічна ін’єкція норадреналіну в паравентрикулярне ядро гіпоталамуса викликає гіперфагію та збільшення маси тіла у щурів. Фармакол. Біохім. Поводитись. 21, 801–808 (1984)
Обічі, С. та ін. Центральне введення олеїнової кислоти пригнічує вироблення глюкози та споживання їжі. Діабет 51, 271–275 (2002)
Лофтус, Т. М. та співавт. Зниження споживання їжі та маси тіла у мишей, які отримували інгібітори синтази жирних кислот. Наука 288, 2379–2381 (2000)
He, W., Lam, T. K., Obici, S. & Rossetti, L. Молекулярне порушення зондування гіпоталамічних поживних речовин викликає ожиріння. Природа Neurosci. 9, 227–233 (2006)
Мінокоші, Ю. та ін. AMP-кіназа регулює споживання їжі, реагуючи на гормональні та поживні сигнали в гіпоталамусі. Природа 428, 569–574 (2004)
Андерссон, У. та ін. АМФ-активована протеїнкіназа відіграє роль у контролі надходження їжі. Дж. Біол. Хім. 279, 12005–12008 (2004)
Кота, Д. та ін. Гіпоталамічний mTOR регулює споживання їжі. Наука 312, 927–930 (2006)
Strubbe, J. H. & Woods, S. C. Час прийому їжі. Психол. Преподобний. 111, 128–141 (2004)
Гіббс, Дж., Янг, Р. С. і Сміт, Г. П. Холецистокінін зменшує споживання їжі у щурів. J. Comp. Фізіол. Психол. 84, 488–495 (1973)
Emond, M., Schwartz, G. J., Ladenheim, E. E. & Moran, T. H. Центральний лептин модулює поведінкову та нервову реакцію на CCK. Am. J. Physiol. 276, R1545 – R1549 (1999)
Мортон, Дж. Дж. Та ін. Дія лептину в передньому мозку регулює реакцію заднього мозку на сигнали ситості. J. Clin. Інвестуйте. 115, 703–710 (2005)
Гриль, Х. Дж. Та ін. Докази того, що каудальний стовбур мозку є мішенню для інгібуючого впливу лептину на споживання їжі. Ендокринологія 143, 239–246 (2002)
Elmquist, J. K., Bjorbaek, C., Ahima, R. S., Flier, J. S. & Saper, C. B. Розподіл ізоформ мРНК рецепторів лептину в мозку щурів. J. Comp. Нейрол. 395, 535–547 (1998)
Blevins, J. E., Schwartz, M. W. & Baskin, D. G. Докази того, що нейрони окситоцину паравентрикулярного ядра пов'язують дію гіпоталамусного лептину з каудальними ядрами стовбура мозку, контролюючи розмір їжі. Am. J. Physiol. Регул. Інтегр. Комп. Фізіол. 287, R87 – R96 (2004)
Келлі, А. Е., Бальдо, Б. А., Пратт, В. Є. та Вілл, М. Дж. Фізіол. Поводитись. 86, 773–795 (2005)
Роллс, Е. Т. Обробка смаку, нюху та текстури їжі в мозку та контроль споживання їжі. Фізіол. Поводитись. 85, 45–56 (2005)
Kringelbach, M. L., O'Doherty, J., Rolls, E. T. & Andrews, C. Активація орбітофронтальної кори людини до рідкого харчового стимулу корелює з її суб'єктивною приємністю. Цереб. Кортекс 13, 1064–1071 (2003)
Kelley, A. E. & Berridge, K. C. Неврологія природних винагород: значення для наркотиків, що викликають залежність. J. Neurosci. 22, 3306–3311 (2002)
Stuber, G.D., Evans, S.B., Higgins, M.S., Pu, Y. & Figlewicz, D.P. Синапс 46, 83–90 (2002)
Керролл, М. Є., Франція, С. П. і Мейш, Р. А. Позбавлення їжі збільшує пероральне та внутрішньовенне споживання наркотиків щурами. Наука 205, 319–321 (1979)
Фултон, С., Вудсайд, Б. та Шизгаль, П. Модуляція схеми винагороди мозку лептином. Наука 287, 125–128 (2000)
Фіглевич, Д. П. та ін. Внутрішньошлуночковий інсулін та лептин зворотне місце надають перевагу, зумовлену дієтою з високим вмістом жиру у щурів. Поводитись. Невроски. 118, 479–487 (2004)
Фіглевіч, Д. П. Сигнали ожиріння та винагорода за їжу: розширення ролі інсуліну та лептину в ЦНС. Am. J. Physiol. Регул. Інтегр. Комп. Фізіол. 284, R882 – R892 (2003)
Флієр, Дж. С. Війни за ожиріння: молекулярний прогрес стикається з наростаючою епідемією. Клітинка 116, 337–350 (2004)
Dhillon, H. та співавт. Лептин безпосередньо активує нейрони SF1 у VMH, і ця дія лептину необхідна для нормального гомеостазу ваги тіла. Нейрон 49, 191–203 (2006)
Fan, W., Boston, B. A., Kesterson, R. A., Hruby, V. J. & Cone, R. D. Роль меланокортинергічних нейронів у годуванні та синдромі ожиріння агуті. Природа 385, 165–168 (1997)
Cowley, M. A. та співавт. Лептин активує анорексигенні нейрони POMC через нейронну мережу в дугоподібному ядрі. Природа 411, 480–484 (2001)
Thornton, J.E., Cheung, C.C., Clifton, D.K. & Steiner, R.A.Регуляція мРНК гіпоталамічної проопіомеланокортину за допомогою лептину в об/об мишей. Ендокринологія 138, 5063–5066 (1997)
Shutter, J. R. et al. Експресія гіпоталамусу АРТ, нового гена, пов'язаного з агуті, регулюється вгору у мишей-мутантів із ожирінням та діабетом. Genes Dev. 11, 593–602 (1997)
Yaswen, L., Diehl, N., Brennan, M. B. & Hochgeschwender, U. Ожиріння в мишачій моделі дефіциту пропіомеланокортину реагує на периферичний меланокортин. Nature Med. 5, 1066–1070 (1999)
Seeley, R. J. et al. Меланокортинові рецептори в ефектах лептину. Природа 390, 349 (1997)
Еріксон, Дж., Клег, К. та Пальмітер, Р. Чутливість до лептину та сприйнятливість до судом мишей, у яких відсутній нейропептид Y. Природа 381, 415–418 (1996)
Цянь, С. та ін. Ні білок, пов'язаний з гуті, ні нейропептид Y не є критично необхідними для регуляції енергетичного гомеостазу у мишей. Мол. Клітинка. Біол. 22, 5027–5035 (2002)
Luquet, S., Perez, F. A., Hnasko, T. S. & Palmiter, R. D. Нейрони NPY/AgRP необхідні для годування у дорослих мишей, але можуть бути абляційними у новонароджених. Наука 310, 683–685 (2005)
Гропп, Е. та співавт. Нейрони, що експресують пептиди, пов’язані з Агуті, є обов’язковими для годування. Природа Neurosci. 8, 1289–1291 (2005)
Бевік, Г. А. та ін. Постембріональна абляція нейронів AgRP у мишей призводить до худого, гіпофагічного фенотипу. FASEB J. 19, 1680–1682 (2005)
Xu, A. W. та ін. Вплив нейродегенерації гіпоталамуса на енергетичний баланс. PLoS Biol. 3, e415 (2005)
Ламберт, П. Д. та ін. Циліарний нейротрофічний фактор активує лептиноподібні шляхи та зменшує жирові відкладення без кахексії та збільшення маси тіла, навіть при лептинорезистентному ожирінні. Proc. Natl Акад. Наук. США 98, 4652–4657 (2001)
Кокоева, М. В., Інь, Х. і Флієр, Дж. С. Нейрогенез у гіпоталамусі дорослих мишей: потенційна роль в енергетичному балансі. Наука 310, 679–683 (2005)
Taniguchi, C. M., Emanuelli, B. & Kahn, C. R. Критичні вузли в сигнальних шляхах: розуміння дії інсуліну. Nature Rev. Mol. Клітинна біол. 7, 85–96 (2006)
Bjorbaek, C., Uotani, S., da Silva, B. & Flier, J. S. Дивергентні сигнальні можливості довгих та коротких ізоформ рецептора лептину. Дж. Біол. Хім. 272, 32686–32695 (1997)
Xu, A. W. та ін. PI3K інтегрує дію інсуліну та лептину на нейрони гіпоталамусу. J. Clin. Інвестуйте. 115, 951–958 (2005)
Niswender, K. D. та ін. Внутрішньоклітинна сигналізація. Ключовий фермент при лептинової анорексії. Природа 413, 794–795 (2001)
Niswender, K. D. та співавт. Активація інсуліном фосфатидилінозитол 3-кінази в дугоподібному ядрі гіпоталамуса: ключовий медіатор інсулінової анорексії. Діабет 52, 227–231 (2003)
Kitamura, T. et al. Білок Forchhead FoxO1 опосередковує залежний від Agrp вплив лептину на споживання їжі. Nature Med. 12, 534–540 (2006)
Spanswick, D., Smith, M. A., Mirshamsi, S., Routh, V. H. & Ashford, M. L. Інсулін активує ATP-чутливі канали K + в гіпоталамічних нейронах худих, але не ожирілих щурів. Природа Neurosci. 3, 757–758 (2000)
Чудхурі, А. І. та ін. Роль субстрату рецептора інсуліну 2 у функції гіпоталамусу та β-клітин. J. Clin. Інвестуйте. 115, 940–950 (2005)
van den Top, M., Lee, K., Whyment, A. D., Blanks, A. M. & Spanswick, D. нейрони електростимулятора NPY/AgRP, чутливі до орексигена, в дугоподібному ядрі гіпоталамуса. Природа Neurosci. 7, 493–494 (2004)
Jaworski, J., Spangler, S., Seeburg, D. P., Hoogenraad, C. C. & Sheng, M. Контроль дендритної арборизації фосфоїнозитид-3'-кіназою-Akt – ссавцем мішені рапаміцинового шляху. J. Neurosci. 25, 11300–11312 (2005)
Бальтасар, Н. та співавт. Сигналізація рецепторів лептину в нейронах POMC необхідна для нормального гомеостазу маси тіла. Нейрон 42, 983–991 (2004)
Пінто, С. та співавт. Швидке переключення ланцюгів живлення дугоподібного ядра лептином. Наука 304, 110–115 (2004)
Стернсон, С. М., Шеперд, Г. М. і Фрідман, Дж. М. Топографічне відображення ВМГ → мікросхеми дугоподібного ядра та їх реорганізація натщесерце. Природа Neurosci. 8, 1356–1363 (2005)
Бертуд, Х. Р. Розум проти метаболізму при контролі споживання їжі та енергетичного балансу. Фізіол. Поводитись. 81, 781–793 (2004)
Подяки
Цю роботу підтримали гранти NIH, Центр досліджень ендокринології діабету та Відділ клінічних досліджень Вашингтонського університету, а також грант Благодійного фонду Мердока. Ми вдячні за допомогу в підготовці рукописів, яку надав К. Балах; дискусії з науковими співробітниками та викладачами Вашингтонського університету; і мудрість, отримана під час конференції з питань поведінки годування, що відбулася в центрі Банбері в Нью-Йорку, у травні 2006 року.
Інформація про автора
Приналежності
Медичний факультет Медичного центру Гарборв'ю та Вашингтонського університету, Сіетл, Вашингтон, 98104, США
Г. Дж. Мортон і М. В. Шварц
Департамент медицини, у справах ветеранів, система охорони здоров'я Пьюджет Саунд та Вашингтонський університет, Сіетл, Вашингтон, 98108, США
Д. Е. Каммінгс і Д. Г. Баскін
Кафедри медицини та біологічної структури, Університет Вашингтона, Сіетл, Вашингтон, 98104, США
Кафедри генетики та педіатрії, Медична школа Стенфордського університету, Стенфорд, Каліфорнія, 94305, США
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Відповідний автор
Декларації про етику
Конкуруючі інтереси
Інформація про передрук та дозволи доступна на веб-сайті www.nature.com/reprints. Автори заявляють про відсутність конкуруючих фінансових інтересів.
Права та дозволи
Про цю статтю
Цитуйте цю статтю
Мортон Г., Каммінгс Д., Баскін Д. та ін. Контроль центральної нервової системи щодо прийому їжі та маси тіла. Природа 443, 289–295 (2006). https://doi.org/10.1038/nature05026
Дата випуску: 21 вересня 2006 р
Подальше читання
Детальніше розглянемо роль інсуліну в регуляції репродуктивної функції чоловіків
- Хаджар Огбай
- , Амір Фаттахі
- , ГоламРеза Гамідіан
- , Саїд Саді-Етегад
- , Мойтаба Зіаее
- & Джавад Махмуді
Загальна та порівняльна ендокринологія (2021)
Терапевтичні механізми традиційної китайської медицини для поліпшення метаболічних захворювань за допомогою мікробіоти кишечника
- Хай-Ю Чжан
- , Цзя-Сін Тянь
- , Фен-Мей Ліан
- , Мін Лі
- , Вень-Ке Лю
- , Чжун Чжень
- , Цзян-Цюань Ляо
- & Сяо-Лін Тонг
Біомедицина та фармакотерапія (2021)
Різна регуляція розгалуженої ланцюгової амінокислоти на споживання їжі сигналом TOR у китайського окуня (Siniperca chuatsi)
- Ке Чень
- , Чжень Чжан
- , Цзяо Лі
- , Шуан Се
- , Лін-Цзе Ши
- , Ю-Хуей Хе
- , Сю-Фанг Лян
- , Цян-Шен Чжу
- & Шань Хе
Аквакультура (2021)
Тривалий вплив бісфенолу А посилює переддіабет, спричинений дієтою, через TLR4-залежне запалення гіпоталамуса
- Циньлун Ма
- , Пінг Ден
- , Мін Лін
- , Lingling Yang
- , Ле Лі
- , Лу Го
- , Лей Чжан
- , Мінді Хе
- , Йонхуй Лу
- , Хуйфенг Пі
- , Янвен Чжан
- , Чженпін Ю.
- , Чунхай Чень
- & Чжоу Чжоу
Журнал небезпечних матеріалів (2021)
Хронічний вплив метилртуті порушує дії греліну у мишей C57BL/6J
- Беатріс Феррер
- , Ліза М. Принц
- , Олексій Олександрович Тиньков
- , Абель Сантамарія
- , Аарон Б. Боумен
- & Майкл Ашнер
Харчова та хімічна токсикологія (2021)
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватись наших Умов та Правил спільноти. Якщо ви виявите щось образливе або не відповідає нашим умовам чи інструкціям, будь ласка, позначте це як невідповідне.
Коріння ожиріння
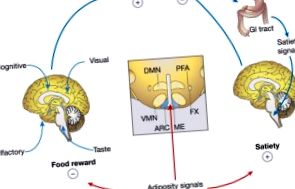
Широко поширена епідемія ожиріння зосередила увагу на характері процесів центральної нервової системи, які контролюють споживання їжі та масу тіла. У відповідь на зменшення запасів жиру в організмі зростає як мотивація пошуку їжі, так і розмір їжі (через сприйняття ситості), поки запаси енергії не поповняться, а мутації, що впливають на цей нейрональний процес, можуть спричинити сильне ожиріння як у тваринних моделей, так і у людей. Теоретично ліки, націлені на нейронні рецептори лептину та інших відповідних лігандів, мають потенціал як засоби проти ожиріння, але сподіваються на терапевтичний прорив, який ще не з’явився. Мортон та ін. переглянути останні дослідження в цій галузі, висвітливши тонкі відмінності між нормальним та аномальним енергетичним гомеостазом.
- 10 біблійних віршів про самоконтроль у харчуванні (знайдіть свободу їжі!)
- Контроль апетиту для зменшення споживання калорій Дієтичні таблетки Cobra Labs The Ripper Anti-Suppressant - St
- 10 дивовижних продуктів, які допомагають швидко схуднути! Продовольча політика CCC
- 10 порад щодо прийому їжі для здорового польоту - юридично; Медичні послуги (PPS) AOPA
- Камілла Белль Зріст, вага, вік, хлопець, статистика тіла, біографія