Клітинна біологія зберігання жиру
Лабораторія молекулярного метаболізму, Університет Рокфеллера, Нью-Йорк, штат Нью-Йорк 10065
Інститут раку Дани-Фарбер та відділ клітинної біології, Гарвардська медична школа, Бостон, Массачусетс 02115
Анотація
Світова епідемія ожиріння та діабету 2 типу значно посилила інтерес до біології та фізіології жирових тканин. Жирові (жирові) клітини спеціалізуються на накопиченні енергії у формі тригліцеридів, але дослідження за останні кілька десятиліть показали, що жирові клітини також відіграють важливу роль у сприйнятті та реагуванні на зміни системного енергетичного балансу. Білі жирові клітини виділяють важливі гормоноподібні молекули, такі як лептин, адипонектин і адипсин, щоб впливати на такі процеси, як споживання їжі, чутливість до інсуліну та секреція інсуліну. З іншого боку, коричневий жир розсіює хімічну енергію у вигляді тепла, захищаючи тим самим від переохолодження, ожиріння та діабету. Зараз визнано, що існує два різних типи термогенних жирових клітин, які називаються коричневими та бежевими адипоцитами. На додаток до цих виразних властивостей жирових клітин, адипоцити існують у жировій тканині, де вони знаходяться в динамічному зв'язку з імунними клітинами і на них впливає іннервація та кровопостачання. Цей огляд покликаний послужити ознайомленням з біологією жирової клітини та ознайомити читача з тим, як ці типи клітин відіграють роль у метаболічних захворюваннях і, можливо, як цілі для терапевтичного розвитку.
ВСТУП
ВИДИ ТЛИВУ
До недавнього часу термін "коричневий жир" використовувався для позначення клітин UCP1 + у двох різних анатомічних місцях: 1) депо, що формуються у розвитку в міжлопатковій та перинальній областях, що складаються в основному з адипоцитів UCP1 +, які мають багато дрібних крапель ліпідів (називаються багатоколорна) і щільні мітохондрії, що надають тканині характерний коричневий колір; та 2) клітини UCP1 +, які розміщені у багатьох складах білого жиру, особливо у підшкірних регіонах гризунів та людей. Ці два типи "коричневого жиру" є не лише різними типами клітин (Ву та ін., 2012), але вони також із абсолютно різних ліній клітин (Seale та ін., 2008). Сформовані в процесі розвитку коричневі жирові клітини, які тепер називають «класичними бурими жировими клітинами», походять від скелетних м’язів, як лінія, позначена Myf5 або Pax7 (Seale та ін., 2008; Леппер і Фан, 2010). Бежеві клітини походять, принаймні частково, із судинних гладком'язових ліній, як позначено промотором Myh11 (Long та ін., 2014; Ягода та ін., 2016).
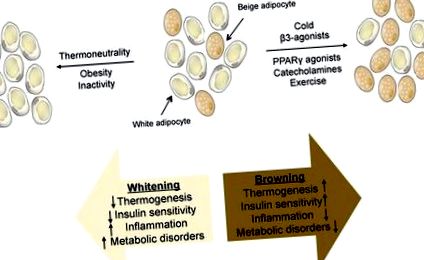
У більшості досліджень не було розмежовано функціональну роль цих двох типів жирових клітин UCP1 +, оскільки вплив холодом або β-адренергічна стимуляція активує обидва типи клітин. Нещодавно була розроблена мишача модель, у якій відсутні бежеві жирові клітини, але вона має повністю функціональний коричневий жир (Cohen та ін., 2014). Ці миші розвивають легке ожиріння на дієті з високим вмістом жиру порівняно з контролем. Більше того, це ожиріння виникає виключно через надлишок підшкірного жиру, що є досить незвичною знахідкою. Ці тварини мають серйозну печінкову резистентність до інсуліну та стеатоз печінки, що свідчить про те, що бежевий жир захищає печінку; чи це відбувається через окислення циркулюючих ліпідів бежевими клітинами або через вироблення секретується гормону, який захищає печінку від накопичення жиру, невідомо. Виявлено дедалі більшу кількість факторів, які призводять до посилення («підрум’янення») або зниження («відбілювання») активності бежевого жиру (рис. 1).
РИСУНОК 1: Зображення жирової тканини бежевого кольору, яка складається із суміші білих і бежевих адипоцитів. Схема подразників, що призводять до підвищеної («порум’янення») або зниження («відбілювання») активності бежевого жиру, разом із фізіологічними наслідками.
КЛІТИНОВА БІОЛОГІЯ АДИПОЗНОЇ ТКАНИНИ
Колись жирова тканина розглядалася як пасивне сховище для накопичення тригліцеридів у адипоцитах, але зараз вважається складною тканиною, що містить безліч взаємодіючих типів клітин, включаючи жирові клітини, імунні клітини, ендотелій, фібробласти, нейрони та стовбурові клітини. Хоча на адипоцити припадає> 90% обсягу жирових прокладків, ці інші типи клітин (в сукупності іменовані стромальною судинною фракцією) переважають у загальній кількості (Kanneganti and Dixit, 2012). Зараз відомо, що кілька підмножин імунних клітин накопичуються в жировій тканині та виконують важливі функції. Це можна простежити із спостереження, що жирова тканина виробляє TNF-α та інші прозапальні цитокіни, при цьому рівень ожиріння збільшується; вони опосередковують місцеву та системну інсулінорезистентність (Готаміслігіл та ін., 1993). Ці цитокіни значною мірою виробляються макрофагами в жировій тканині (Weisberg та ін., 2003; Сюй та ін., 2003). Гістологічно можна побачити макрофаги, що оточують адипоцити в так званих «короноподібних структурах» (Cinti та ін., 2005)
Фенотипи жирової тканини також залежать від кровопостачання та іннервації, хоча регуляція цих процесів була порівняно менш вивчена. Оскільки жирова маса розширюється в умовах переїдання, може розвинутися місцева гіпоксія, а активований гіпоксією фактор 1α (HIF1α), чутливий до кисню фактор транскрипції (Кришнан) та ін., 2012). Генетичні та фармакологічні дослідження показують, що специфічна для жиру делеція або інгібування HIF-1α може захистити від метаболічної дисфункції, пов’язаної з ожирінням (Цзян та ін., 2011 р .; Сонце та ін., 2013). Дані також вказують на те, що біла та коричнева жирова тканина можуть утворювати судинний ендотеліальний фактор росту А та інші фактори для посилення її кровопостачання (Фредрікссон та ін., 2000 р .; Мік та ін., 2002). Жирова тканина, особливо коричневий жир, також інтенсивно іннервується симпатичними волокнами, які стимулюють ліполіз на час голодування, введення лептину та холодного впливу (Бартнесс та ін., 2010а, б; Дзен та ін., 2015). Навпаки, парасимпатичні волокна можуть стимулювати накопичення ліпідів (Kreier та ін., 2002). Коричневі та бежеві адипоцити виражають високий рівень β3-адренергічного рецептора, а фармакологічна активація CL 316,243 сприяє термогенезу (Хіммс-Хаген та ін., 1994). Фактори, що регулюють іннервацію жирових клітин, залишаються сферою активних досліджень.
БЕЗОСВІДЧЕНІ ПИТАННЯ ТА ПЕРСПЕКТИВИ ЛЮДИНОТЕРАПЕТИКИ
Успішне націлювання жирової тканини на терапевтичну користь залежатиме від подальшого роз'яснення кількох ключових питань без відповіді. По-перше, що являє собою повну колекцію регуляторів транскрипції, які регулюють розвиток та підтримку білого, коричневого та бежевого жиру? По-друге, який повний спектр фенотипів кожного типу адипоцитів? Наприклад, стає все більш очевидним, що коричневий та бежевий жири роблять набагато більше, ніж генерують тепло, і можуть бути важливими ендокринними органами (Каджімура та ін., 2015). По-третє, як різні типи жирових клітин подають сигнал іншим типам клітин і тканин, і як ці сигнали впливають на системний метаболізм та сприйнятливість до діабету, гіпертонії, серцево-судинних захворювань та раку? Нарешті, чи можна ключові молекулярні регулятори жирової тканини модулювати для створення здорової жирової тканини? Досягнення цієї мети вимагатиме базового розуміння того, як такі важливі фактори, як PRDM16, регулюються фізіологічно (наприклад, транскрипційно, поступально, посттрансляційно).
Зрештою, будь-яке обговорення жирових тканин як мішені для людської терапії повинно повернутися до уявлення про жирові тканини як про найздоровіше місце для відкладення надлишкової калорійної енергії (Унгер та ін., 2013). З людської генетики ми знаємо, що будь-яке пригнічення розвитку жиру призведе до ектопічного відкладення ліпідів та серйозних захворювань (Savage та ін., 2003). З огляду на це, які потенційні цілі відносяться до жирових тканин? По-перше, що стосується білого жиру, ми можемо націлити аномалії, що пов’язують жирові тканини із наслідками ожиріння, включаючи діабет, серцево-судинні розлади та жирові захворювання печінки. Як згадувалося раніше, жирова тканина при ожирінні демонструє аспекти запалення, включаючи секрецію запальних цитокінів; нейтралізація цитокінів, таких як TNFα, покращує резистентність до інсуліну у гризунів (Hotamisligil та ін., 1994). Так само було показано, що антагонізм запальних протеїнкіназ I-каппа-В кінази епсилон (IKKε) та TANK-зв'язуючої кінази 1 (TBK1) покращує діабет у мишей (Reilly та ін., 2013). Завданням у майбутньому буде отримання терапевтичної вигоди при цукровому діабеті або серцево-судинних захворюваннях, не викликаючи токсичності, пов'язаної із загальним придушенням запалення.
- Біологія - Чи може що-небудь вижити, харчуючись камінням та іншими ґрунтовими мінералами Worldbuilding Stack
- Біоінформатика та обчислювальна біологія (BCB); Університет Сент-Луїс
- Біологія для дитячого харчування
- Біологія для дітей Мендель та спадщина
- Біологія - що таке велетень; s Дієта Worldbuilding Stack Exchange